Содержание
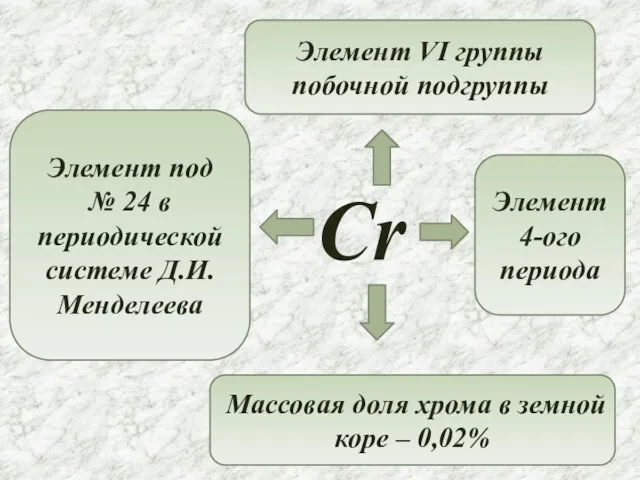
- 2. Cr Элемент под № 24 в периодической системе Д.И.Менделеева Элемент VI группы побочной подгруппы Элемент 4-ого
- 3. Нахождение в природе Хромистый железняк FeO* Cr2O3 Хромит FeCr2O4 Крокоит PbCrO4
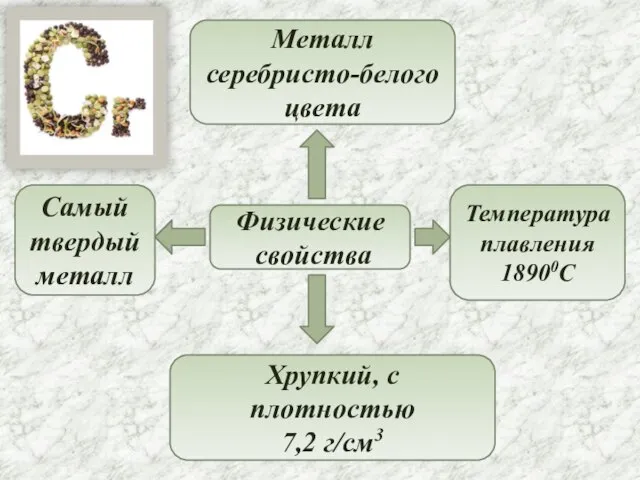
- 4. Физические свойства Металл серебристо-белого цвета Самый твердый металл Хрупкий, с плотностью 7,2 г/см3 Температура плавления 18900C
- 5. Химические свойства хрома 1.Реагирует с неметаллами(при нагревании) А) 4Cr + 3O2 =2Cr2O3 Б) 2Cr + N2
- 6. Применение хрома В производстве хромированной, т.е. обладающей антикоррозионными свойствами, стали
- 7. В нагревательных элементах электрических печей (сплав железа, никеля и хрома)
- 8. Хромирование (создание защитных от коррозии, а также декоративных покрытий)
- 9. Соединения хрома Соединения хрома(II) CrO –основный оксид Cr(OH)2- основание Соединения хрома(III) Cr2O3-амфотерный оксид Cr(OH)3-амфотерный гидроксид Соединения
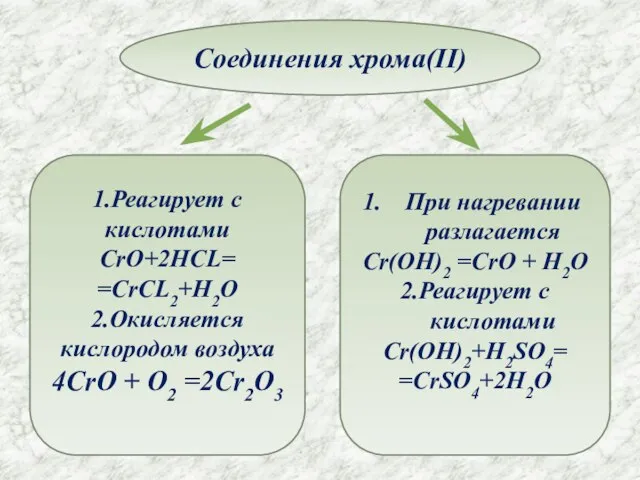
- 10. Соединения хрома(II) 1.Реагирует с кислотами CrO+2HCL= =CrCL2+H2O 2.Окисляется кислородом воздуха 4CrO + O2 =2Cr2O3 При нагревании
- 11. Соединения хрома(III) Cr2O3 –при обычных условиях не реагирует с растворами кислот и щелочей . Cr2O3 –реагирует
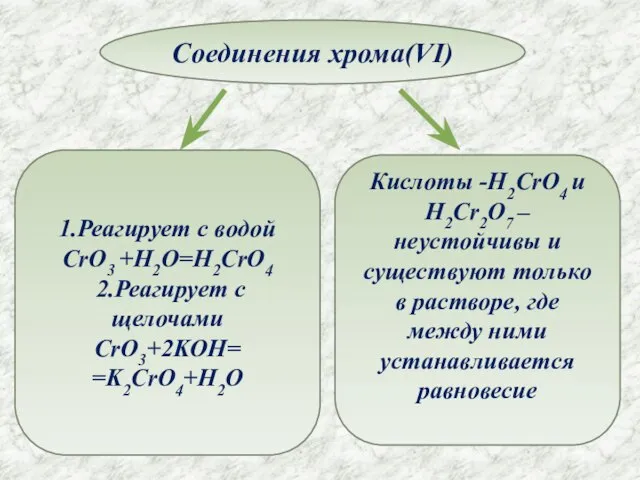
- 12. Соединения хрома(VI) 1.Реагирует с водой CrO3 +H2O=H2CrO4 2.Реагирует с щелочами CrO3+2KOH= =K2CrO4+H2O Кислоты -H2CrO4 и H2Cr2O7
- 13. Соли Хроматы (хромовой кислоты) Дихроматы (дихромовой кислоты) Дихроматы - термически неустойчивые соединения. Реакция разложения дихромата Аммония
- 14. Сульфат хрома и хромокалиевые квасцы используют для изготовления прочной хромовой кожи Соединения хрома применяют в качестве
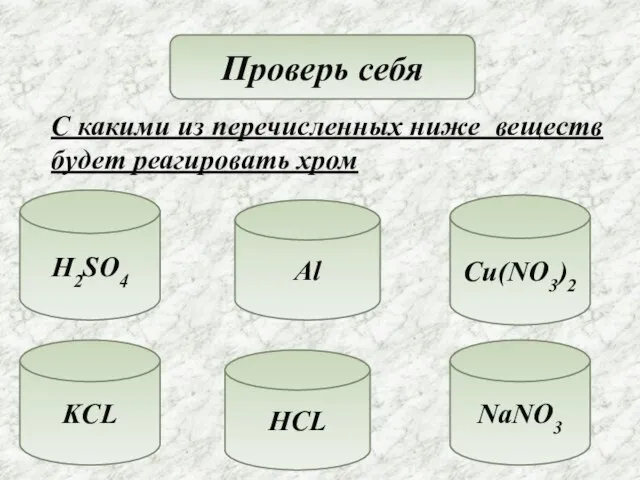
- 15. Проверь себя С какими из перечисленных ниже веществ будет реагировать хром H2SO4 Al KCL HCL NaNO3
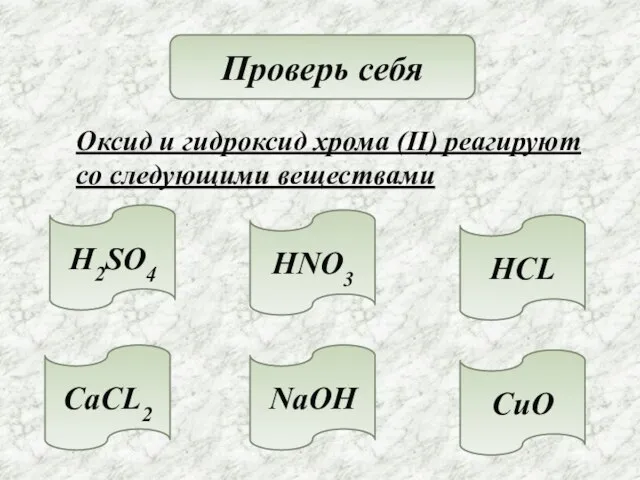
- 16. Проверь себя Оксид и гидроксид хрома (II) реагируют со следующими веществами H2SO4 HNO3 HCL CaCL2 NaOH
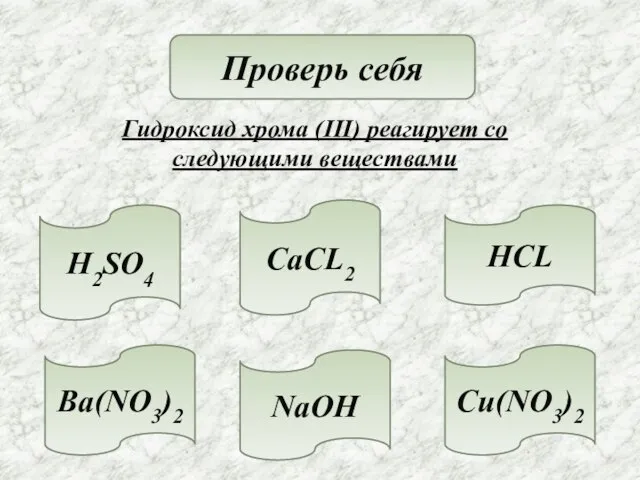
- 17. Проверь себя Гидроксид хрома (III) реагирует со следующими веществами H2SO4 NaOH HCL CaCL2 Cu(NO3)2 Ba(NO3)2
- 18. http://im5-tub-ru.yandex.net/i?id=92218102-28-72&n=21 http://im7-tub-ru.yandex.net/i?id=152996174-45-72&n=21 http://im7-tub-ru.yandex.net/i?id=113413894-55-72&n=21 http://im2-tub-ru.yandex.net/i?id=31291566-60-72&n=21 http://dabi.ru/attachments/7044/6952/images/large.jpg http://im0-tub-ru.yandex.net/i?id=461512314-61-72&n=21 Ссылки на источники информации и изображения: И.И.Новошинский Н.С.Новошинская Химия 10
- 20. Скачать презентацию










 Инструкция по получению учебно-методических материалов в личном кабинете студента
Инструкция по получению учебно-методических материалов в личном кабинете студента Презентация на тему Внутренняя политика Ивана Грозного. Последние годы правления.
Презентация на тему Внутренняя политика Ивана Грозного. Последние годы правления.  Мануал по решению основных проблем при переводе с японского на русский
Мануал по решению основных проблем при переводе с японского на русский Путешествие по Смольному монастырю
Путешествие по Смольному монастырю Презентация на тему Собор святой Софии в Константинополе
Презентация на тему Собор святой Софии в Константинополе Дизайн-менеджмент
Дизайн-менеджмент Семинар SLS в Новосибирске. - презентация
Семинар SLS в Новосибирске. - презентация Организация работы классного руководителя
Организация работы классного руководителя Загадки о цветах
Загадки о цветах Как работать с заданиями. Пошаговая инструкция для студентов ФНиДО БГУИР
Как работать с заданиями. Пошаговая инструкция для студентов ФНиДО БГУИР Мы и дорога
Мы и дорога Использование компьютерных технологий в начальной школе
Использование компьютерных технологий в начальной школе www.brianna-trans.com
www.brianna-trans.com Реклама Альфа-Банку
Реклама Альфа-Банку Пищевые продукты, питательные вещества и их превращения в организме
Пищевые продукты, питательные вещества и их превращения в организме Коэффициент графика функции
Коэффициент графика функции Приветствуем участников окружного семинара руководителей ОУ «Формирование единого информационного пространства школы».
Приветствуем участников окружного семинара руководителей ОУ «Формирование единого информационного пространства школы». Паровозик. Рисунок
Паровозик. Рисунок Аналитическо-проектная работа по анализу кадровой политики организации
Аналитическо-проектная работа по анализу кадровой политики организации ЭКОЛОГИЧЕСКОЕ ПРАВО
ЭКОЛОГИЧЕСКОЕ ПРАВО Теорема Пифагора
Теорема Пифагора ОТЧЕТ О РАБОТЕПО ЗАМЕЧАНИЯМ НА ПРОЕКТ«МЕТОДИЧЕСКИЕ РЕКОМЕНДАЦИИ ПО ПЛАНИРОВАНИЮ И ОРГАНИЗАЦИИ ИННОВАЦИОННОЙ ДЕЯТЕЛЬНОСТИ ПР
ОТЧЕТ О РАБОТЕПО ЗАМЕЧАНИЯМ НА ПРОЕКТ«МЕТОДИЧЕСКИЕ РЕКОМЕНДАЦИИ ПО ПЛАНИРОВАНИЮ И ОРГАНИЗАЦИИ ИННОВАЦИОННОЙ ДЕЯТЕЛЬНОСТИ ПР Определитель и действие с ними
Определитель и действие с ними Понятие «контроллинг»
Понятие «контроллинг» Художественная культура Древнего Египта
Художественная культура Древнего Египта Работа школы в режиме Полного Дня
Работа школы в режиме Полного Дня Новгородская земля
Новгородская земля Утверждение тоталитаризма
Утверждение тоталитаризма