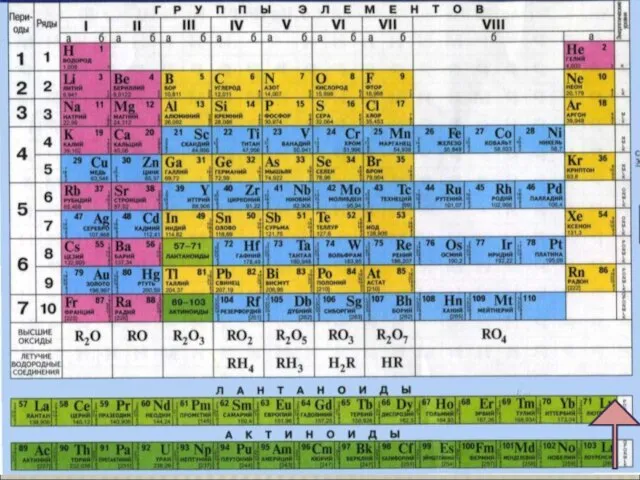
Содержание
- 2. ХРОМ
- 3. I. Исторические сведения II. Хром – химический элемент: 1.Положение хрома в периодической системе химических элементов Д.И.Менделеева
- 4. В 1766 году в окрестностях Екатеринбурга был обнаружен минерал, который получил название «сибирский красный свинец», PbCrO4.
- 5. Французский химик Луи Николя Воклен родился в Сент-Андре-д'Эберто (Нормандия). Совместно с А. Ф. Фуркруа выяснил (1799)
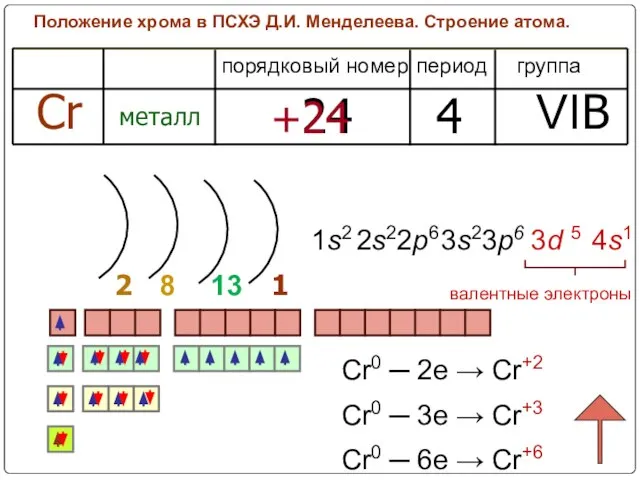
- 7. Положение хрома в ПСХЭ Д.И. Менделеева. Строение атома. период группа порядковый номер Cr металл 24 4
- 8. Нахождение хрома в природе Хром является довольно распространённым элементом (0,02 масс. долей, %). Основные соединения хрома
- 9. Физические свойства Плотность 7,19 г/см3; t плавления 1890°С; t кипения 2480°С. В свободном виде — голубовато-
- 10. Получение Из хромистого железняка Fe(CrO2)2 (хромита железа) получают феррохром восстановлением в электропечах коксом (углеродом): FeO· Cr2O3
- 11. Чтобы получить чистый хром, реакцию ведут следующим образом: 1) сплавляют хромит железа с карбонатом натрия (кальцинированная
- 12. С помощью электролиза получают электролитический хром из раствора хромового ангидрида в воде, содержащего добавку серной кислоты.
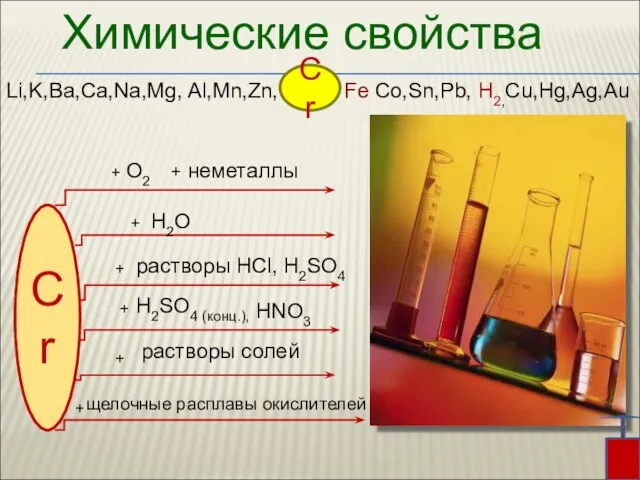
- 13. Химические свойства Li,K,Ba,Ca,Na,Mg, Al,Mn,Zn, Fe Co,Sn,Pb, H2,Cu,Hg,Ag,Au Cr Cr + + + + H2SO4 (конц.), растворы
- 14. При комнатной температуре хром химически мало активен из-за образования на его поверхности тонкой прочной оксидной пленки.
- 15. Cr0 + O20 = Cr2+3O3–2 4 2 3 Cr0 – 3e → Cr+3 4 O20 +
- 16. Cr0 + N20 = Cr+3N–3 Cr0 – 3e → Cr+3 2 N20 + 6e → 2N–3
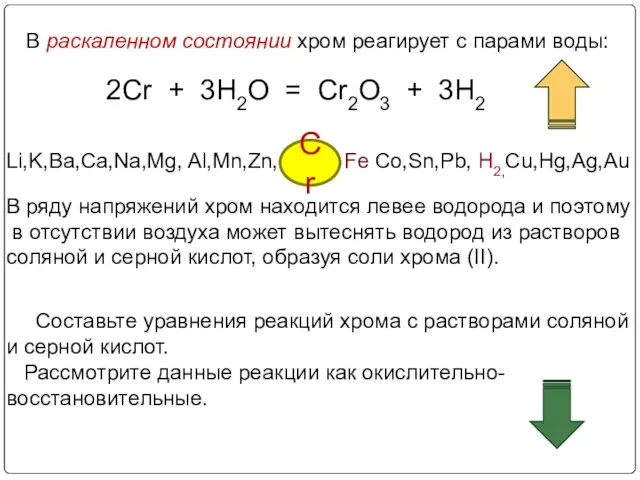
- 17. В раскаленном состоянии хром реагирует с парами воды: 2Cr + 3H2O = Cr2O3 + 3H2 Li,K,Ba,Ca,Na,Mg,
- 18. Cr0 + H+1Cl = Cr+2Cl2 + H20 Cr0 – 2e → Cr+2 1 2H+ + 2e
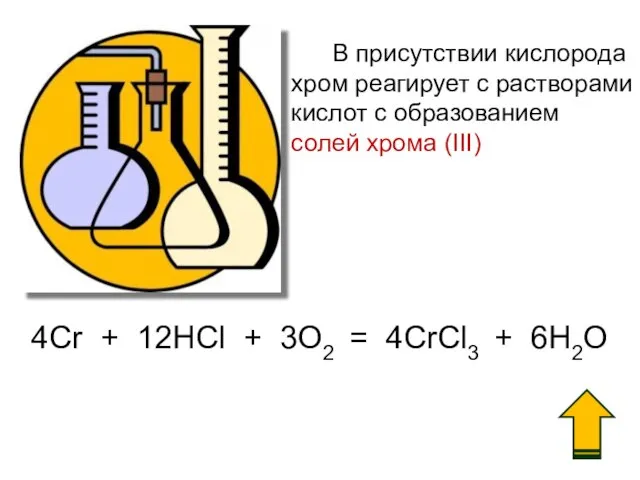
- 19. В присутствии кислорода хром реагирует с растворами кислот c образованием солей хрома (III) 4Cr + 12HCl
- 20. Концентрированные серная и азотная кислоты на холоду пассивируют хром При сильном нагревании кислоты pастворяют хром с
- 21. Cr0 + H2S+6O4 → Cr2+3(SO4)3 + S+4O2 + H2O Cr0 + HN+5O3 → Cr+3(NO3)3 + N+4O2
- 22. Хром способен вытеснять многие металлы, например медь, олово, серебро и другие, из растворов их солей: Cr0
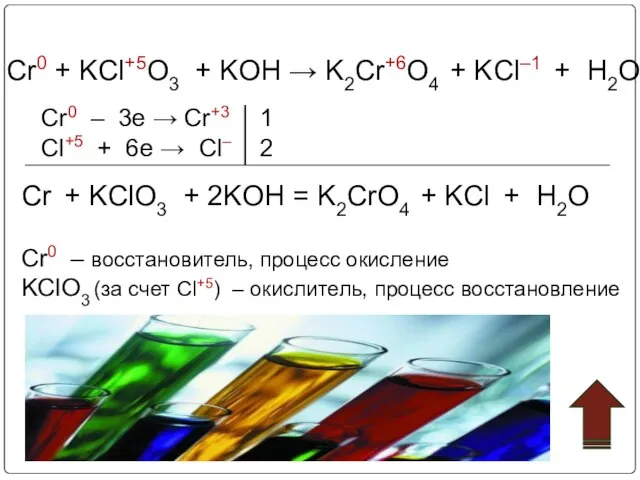
- 23. Cr + KClO3 + KOH K2CrO4 + KCl + H2O Рассмотрите эту реакцию как окислительно-восстановительную Расставьте
- 24. Cr0 + KCl+5O3 + KOH → K2Cr+6O4 + KCl–1 + H2O Cr0 – 3e → Cr+3
- 25. Хром - постоянная составная часть растительных и животных организмов. В крови содержится от 0,012 до 0,0035
- 26. Хром важный компонент во многих легированных сталях. Используется в качестве износоустойчивых и красивых гальванических покрытий (хромирование)
- 27. Соединения хрома Соединения хрома (II) Соединения хрома (III) Соединения хрома (VI) оксид гидроксид соли оксид гидроксид
- 28. Соединения хрома (II) CrO Оксид хрома (II) – кристаллы черного цвета, имеет основный характер При осторожном
- 29. Составьте уравнение реакции оксида хрома (II) с соляной и серной кислотами. Рассмотрите реакции с точки зрения
- 30. Оксид хрома (II) – сильный восстановитель. Кислородом воздуха окисляется до оксида хрома (III) Составьте уравнение реакции.
- 31. Cr(OH)2 Гидроксид хрома (II) Гидроксид хрома (II) получают в виде желтого осадка действием растворов щелочей на
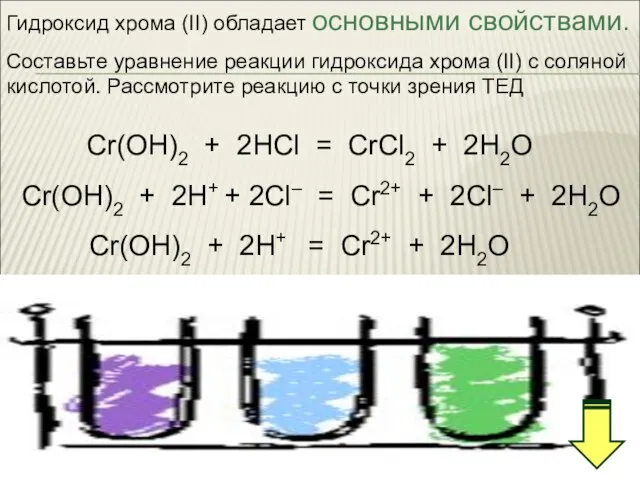
- 32. Гидроксид хрома (II) обладает основными свойствами. Составьте уравнение реакции гидроксида хрома (II) с соляной кислотой. Рассмотрите
- 33. Гидроксид хрома (II) – сильный восстановитель. Кислородом воздуха окисляется до гидроксида хрома (III) Составьте уравнение реакции.
- 34. Соли хрома (II) Водные растворы солей хрома (II) получают без доступа воздуха растворением металлического хрома в
- 35. Cr+2Cl2 + O20 + HCl → Cr+3Cl3 + H2O–2 Cr+2 – 1e → Cr+3 4 O20
- 36. Cr+2Cl2 + HN+5O3 (к) →Cr+3(NO3)3 + N+4O2↑ + HCl↑ + H2O Cr+2 – 1e → Cr+3
- 37. Соединения хрома (III) Cr2O3 Оксид хрома () – тугоплавкий порошок темно-зеленого цвета. Получение. В лабораторных условиях
- 38. Оксид хрома (III) обладает амфотерными свойствами При взаимодействии с кислотами образуются соли хрома (III): Составьте уравнение
- 39. При сплавлении оксида хрома (III) с оксидами, гидроксидами и карбонатами щелочных и щелочноземельных металлов образуются хроматы
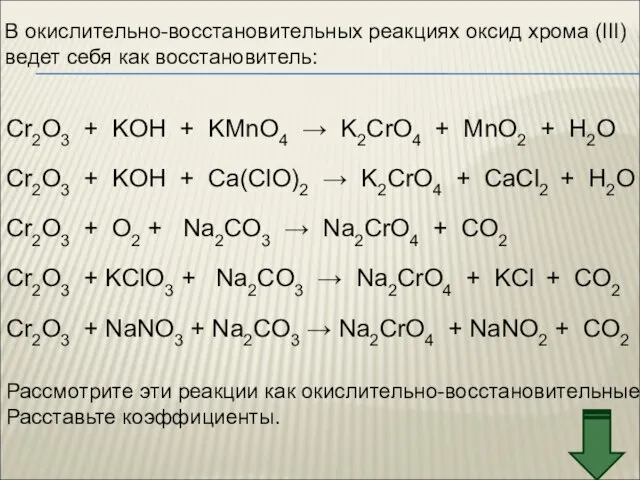
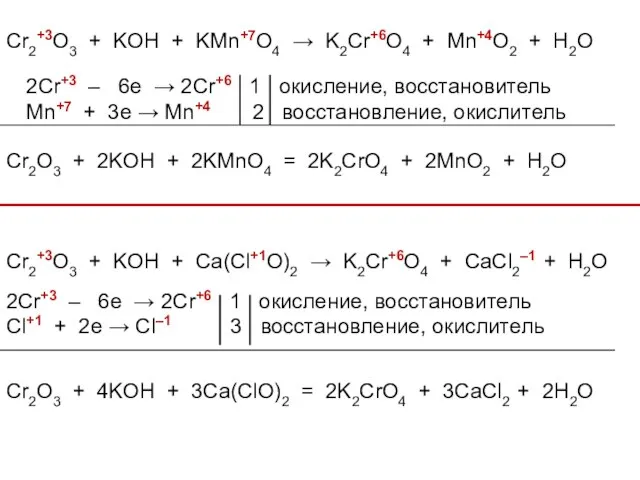
- 40. В окислительно-восстановительных реакциях оксид хрома (III) ведет себя как восстановитель: Cr2O3 + KOH + KMnO4 →
- 41. Cr2+3O3 + KOH + KMn+7O4 → K2Cr+6O4 + Mn+4O2 + H2O 2Cr+3 – 6e → 2Cr+6
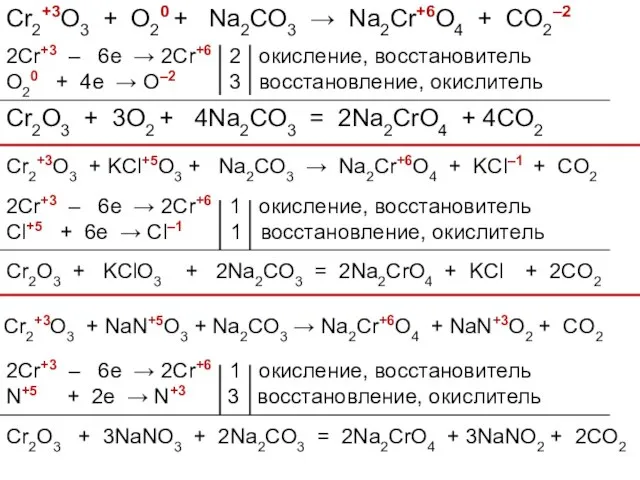
- 42. Cr2+3O3 + O20 + Na2CO3 → Na2Cr+6O4 + CO2–2 2Cr+3 – 6e → 2Cr+6 2 окисление,
- 43. Оксид хрома (III) – катализатор В присутствии оксида хрома (III) аммиак окисляется кислородом воздуха до монооксида
- 44. Каталитическое окисление этанола Окисление этилового спирта кислородом воздуха происходит очень легко в присутствии оксида хрома (III)
- 45. Гидроксид хрома (III) Cr(OH)3 Получают гидроксид хрома (III) действием растворов щелочей или аммиака на растворы солей
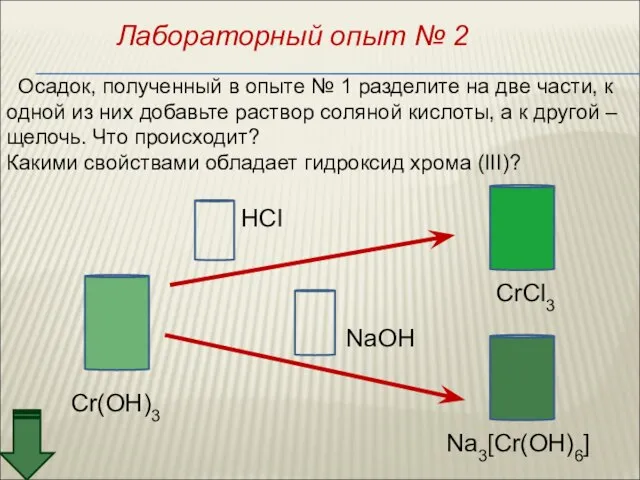
- 46. Лабораторный опыт № 2 Осадок, полученный в опыте № 1 разделите на две части, к одной
- 47. +H2SO4 +NaOH Осадок, полученный в опыте № 1 разделите на две части, к одной из них
- 48. Гидроксид хрома (III) обладает амфотерными свойствами. При взаимодействии с кислотами образуются соли хрома (III): Составьте уравнение
- 49. Cr(OH)3 + 3NaOH = Na3[Cr(OH)6] Cr(OH)3 + 3Na+ + 3OH– = 3Na+ + [Cr(OH)6]3– Cr(OH)3 +
- 50. Соли хрома (III) Хроматы (III) устойчивы в щелочной среде. Они легко реагируют с кислотами: недостаток кислоты:
- 51. Сульфат хрома (III) образует двойные соли – хромовые квасцы. Из смешанного раствора сульфата хрома (III) и
- 52. Соединения хрома (III) могут проявлять как окислительные так и восстановительные свойства. Рассмотрите эти реакции как окислительно-восстановительные
- 53. K3[Cr+3(OH)6] + Br20 + KOH → K2Cr+6O4 + KBr– + H2O Cr+3 – 3e → Cr+6
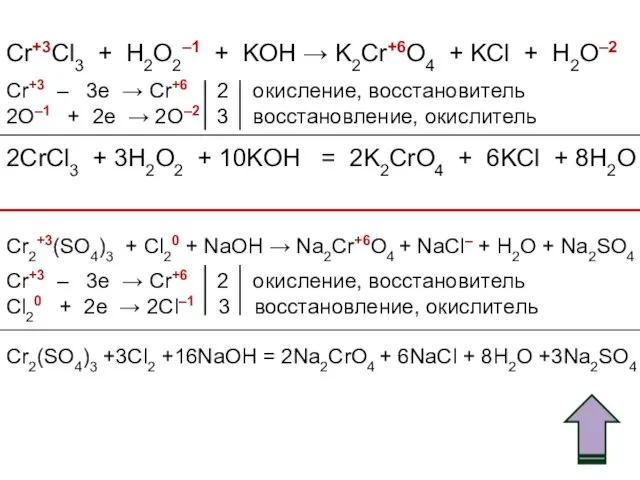
- 54. Cr+3Cl3 + H2O2–1 + KOH → K2Cr+6O4 + KCl + H2O–2 Cr+3 – 3e → Cr+6
- 55. Получают CrO3 действием избытка концентрированной серной кислоты на насыщенный водный раствор дихромата натрия: Na2Cr2O7 + 2H2SO4
- 56. CrO3 — кислотный оксид. С избытком воды образуется хромовая кислота H2CrO4 CrO3 + Н2O = Н2CrO4
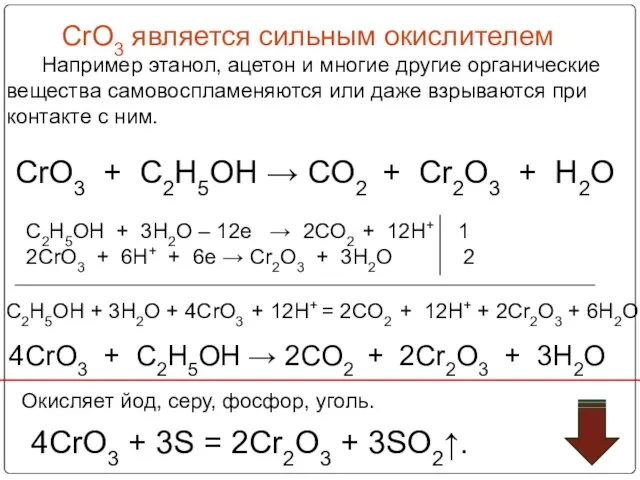
- 57. CrO3 является сильным окислителем Например этанол, ацетон и многие другие органические вещества самовоспламеняются или даже взрываются
- 58. Если поместить оксид хрома на фарфоровую пластинку и капнуть на него несколько капель ацетона,то через несколько
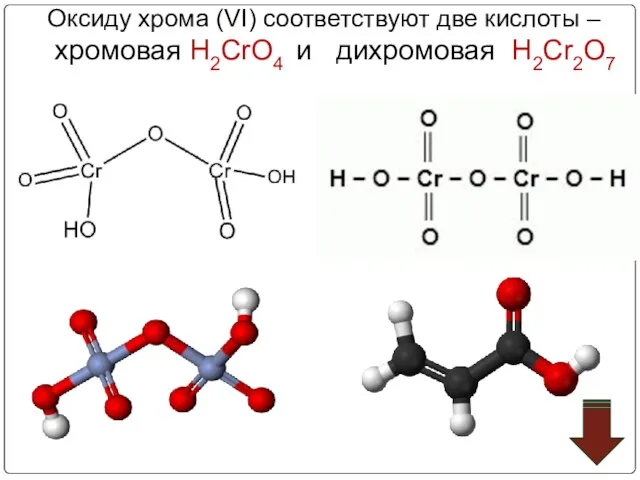
- 59. Оксиду хрома (VI) соответствуют две кислоты – хромовая Н2CrO4 и дихромовая Н2Cr2O7
- 60. Хромовая кислота — кристаллическое вещество красного цвета; выделена в свободном состоянии при охлаждении насыщенных водных растворов
- 61. хроматы – соли хромовой кислоты устойчивы в щелочной среде, при подкислении переходят в оранжевые дихроматы, соли
- 62. Лабораторный опыт № 3 К раствору дихромата калия добавьте гидроксид калия. Как изменилась окраска? Чем это
- 63. 2K2CrO4 + H2SO4(разб.) = K2Cr2O7 + K2SO4 + H2O K2Cr2O7 + 2KOH = 2K2CrO4 + H2O
- 64. Взаимопревращение хроматов и дихроматов Оксиду хрома (VI) соответствуют две кислоты – хромовая Н2CrO4 и дихромовая Н2Cr2O7,
- 65. Соединения хрома (VI) – сильные окислители Cr2O72– Cr3+ Cr(OH)3 [Cr(OH)6]3– H+ H2O OH– Cr2O72– + 14H+
- 66. Окислительные свойства дихроматов Дихроматы, например дихромат калия K2Cr2O7 – сильные окислители. Под действием восстановителей дихроматы в
- 67. Zn + K2Cr2O7 + H2SO4 → ZnSO4 + Cr2(SO4)3 + K2SO4 +H2O K2Cr2O7 + H2S +
- 68. Zn0 + K2Cr2+6O7 + H2SO4 → Zn+2SO4 + Cr2+3(SO4)3 + K2SO4 +H2O Cr+6 + 3e →
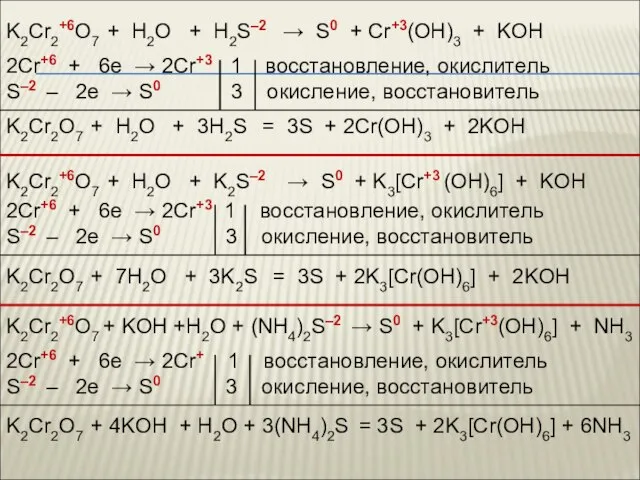
- 69. K2Cr2+6O7 + H2O + H2S–2 → S0 + Cr+3(OH)3 + KOH K2Cr2+6O7 + H2O + K2S–2
- 70. K2Cr2+6O7 + S0 → K2S+6O4 + Cr2+3O3 K2Cr2O7 + S = K2SO4 + Cr2O3 K2Cr2+6O7 +
- 71. Дихромат калия (хромпик) широко применяется как окислитель органических соединений: 3С2H5OH + K2Cr2O7 + 4H2SO4 CH3– CHO
- 72. Хроматы щелочных металлов плавятся без разложения, а дихроматы при высокой температуре превращаются в хроматы. Дихромат аммония
- 73. В ряду гидроксидов хрома различных степеней окисления Cr(ОН)2 — Cr(ОН)3 — Н2CrО4 закономерно происходит ослабление основных
- 74. Степень окисления хромa +2 +3 +6 Оксид CrO Cr2O3 CrO3 Гидроксид Cr(OH)2 Cr(OH)3 H2CrO4 H2Cr2O7 Кислотные
- 76. Скачать презентацию




































![Cr(OH)3 + 3NaOH = Na3[Cr(OH)6] Cr(OH)3 + 3Na+ + 3OH– = 3Na+](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/362284/slide-48.jpg)



![K3[Cr+3(OH)6] + Br20 + KOH → K2Cr+6O4 + KBr– + H2O Cr+3](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/362284/slide-52.jpg)








![Соединения хрома (VI) – сильные окислители Cr2O72– Cr3+ Cr(OH)3 [Cr(OH)6]3– H+ H2O](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/362284/slide-64.jpg)








 В. Гинуков. Условный портрет автора Слова
В. Гинуков. Условный портрет автора Слова Кафедра естественных наук
Кафедра естественных наук 249175
249175 Голосовой помощник Маруся
Голосовой помощник Маруся Девять предметов в системе счисления
Девять предметов в системе счисления Саморегулирующиеся организации «СРО Телеком» и СРО Телеком-Про»
Саморегулирующиеся организации «СРО Телеком» и СРО Телеком-Про» «Страницы семейного архива»
«Страницы семейного архива» Статистика терроризма
Статистика терроризма Социальные, этнические, конфессиональные и культурные различия личности
Социальные, этнические, конфессиональные и культурные различия личности Опиливание заготовок из сортового проката.Резание металла слесарной ножовкой.
Опиливание заготовок из сортового проката.Резание металла слесарной ножовкой. Гай Юлий Цезарь
Гай Юлий Цезарь Презентация на тему Новогодние игры со Снегурочкой и Дедом Морозом
Презентация на тему Новогодние игры со Снегурочкой и Дедом Морозом Презентация на тему Ёлочка из перьев
Презентация на тему Ёлочка из перьев Структура спонсорского пакета для чемпионата Санкт-Петербурга по водному поло.u
Структура спонсорского пакета для чемпионата Санкт-Петербурга по водному поло.u Заголовок Название раздела 1 Ленвендо Кто мы www.lenvendo.ru.
Заголовок Название раздела 1 Ленвендо Кто мы www.lenvendo.ru. ПОЛЯРИЗАЦИЯ И ДИФРАКЦИЯ СВЕТА
ПОЛЯРИЗАЦИЯ И ДИФРАКЦИЯ СВЕТА Тема урока: «Тайны поэзии Н.Гумилева»
Тема урока: «Тайны поэзии Н.Гумилева» Презентация на тему Лингвистический проект
Презентация на тему Лингвистический проект Цифровые автоматы, кодирование сигнала
Цифровые автоматы, кодирование сигнала Самодержавие Алексея Михайловича Тишайшего
Самодержавие Алексея Михайловича Тишайшего Презентация на тему Рулевое управление автомобиля
Презентация на тему Рулевое управление автомобиля Евгений Замятин. Роман-антиутопия "Мы“ как предупреждение потомкам
Евгений Замятин. Роман-антиутопия "Мы“ как предупреждение потомкам Модель управления имущественными комплексами вузов и вопросы распоряжения имуществом
Модель управления имущественными комплексами вузов и вопросы распоряжения имуществом Техника построения эллипсов во фронтальной плоскости проекций
Техника построения эллипсов во фронтальной плоскости проекций Нательные кресты XI – конца XIX вв. в экспозиции музея им. 1000-летия Брянска
Нательные кресты XI – конца XIX вв. в экспозиции музея им. 1000-летия Брянска Запатентован первый кассовый аппарат (1879)
Запатентован первый кассовый аппарат (1879) Система права
Система права Тест по рыбе
Тест по рыбе