Содержание
- 2. Примеры применение метода химической модификации белков Отслеживание in vivo конъюгатов белков с флуорофорами Пегилирование белков с
- 3. Методы обнаружения «существенных» и «избыточных» а.о. 1. Направленный (сайт-специфический) мутагенез. 2. Химическая модификация боковых групп а.о.
- 4. Типы химических модификаций 1. Модификация отдельных а.о. с помощью селективных химических реагентов. 2. Модификация двух функциональных
- 5. Особенности химической модификации белков Химические свойства идентичных функциональных групп в аминокислотах и в белках различаются по
- 6. Условия среды для химических модификаций природных белков pH 6-8 реакция в водном растворе
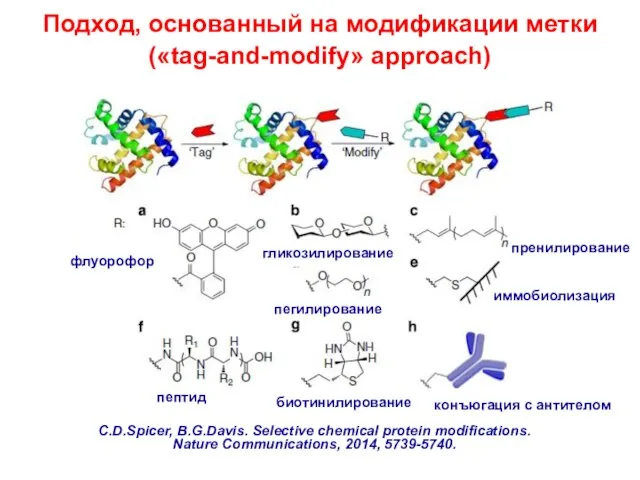
- 7. Подход, основанный на модификации метки («tag-and-modify» approach) C.D.Spicer, B.G.Davis. Selective chemical protein modifications. Nature Communications, 2014,
- 8. Функциональные группы белков, которые могут быть модифицированы 1. α-NH2 –группа и ε-NH2-группа остатков Lys. 2. Вторичная
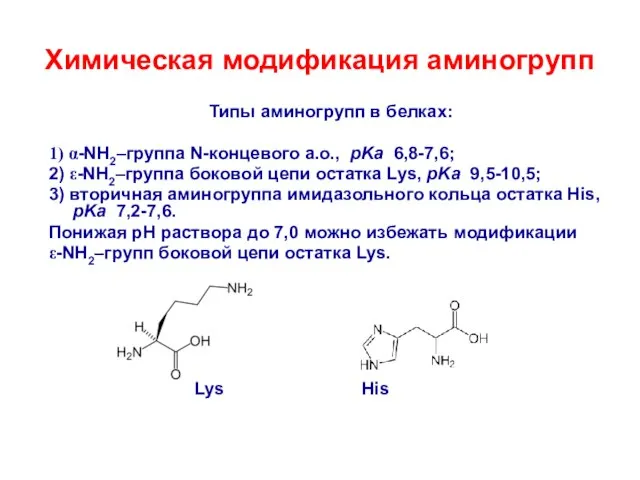
- 9. Химическая модификация аминогрупп Типы аминогрупп в белках: 1) α-NH2–группа N-концевого а.о., pKa 6,8-7,6; 2) ε-NH2–группа боковой
- 10. ε-NH2–группа боковой цепи остатка Lys может быть модифицирована следующими методами: 1) ацилирование; 2) арилирование; 3) реакция
- 11. Ацилирование ε-NH2–группы Lys Ацилирование можно вести с помощью: 1) симметричных ангидридов (уксусного, трифторуксусного, янтарного, малеинового, цитраконового);
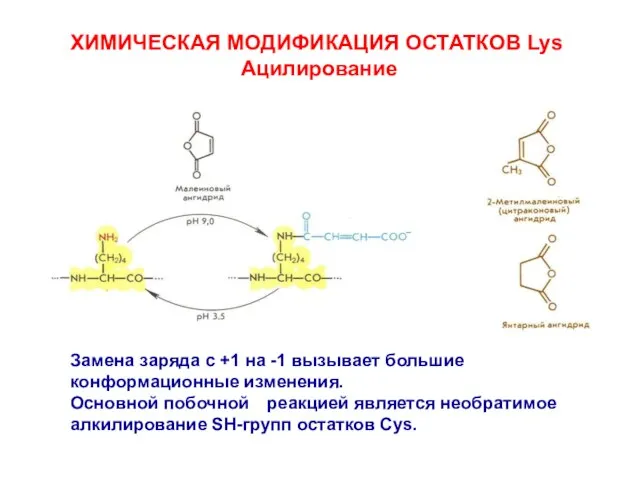
- 12. ХИМИЧЕСКАЯ МОДИФИКАЦИЯ ОСТАТКОВ Lys Ацилирование Замена заряда с +1 на -1 вызывает большие конформационные изменения. Основной
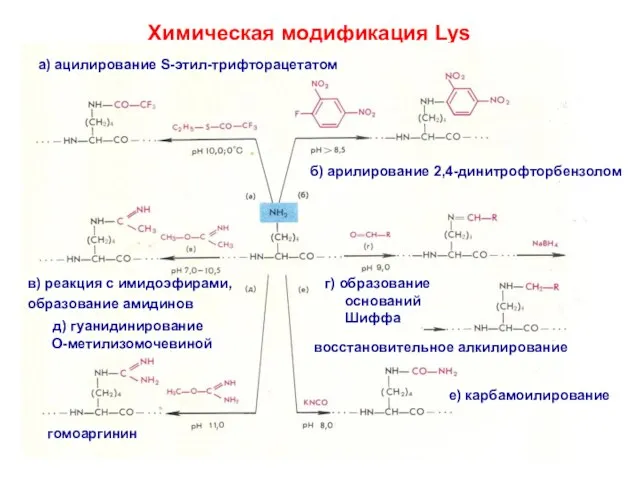
- 13. Химическая модификация Lys а) ацилирование S-этил-трифторацетатом д) гуанидинирование О-метилизомочевиной б) арилирование 2,4-динитрофторбензолом в) реакция с имидоэфирами,
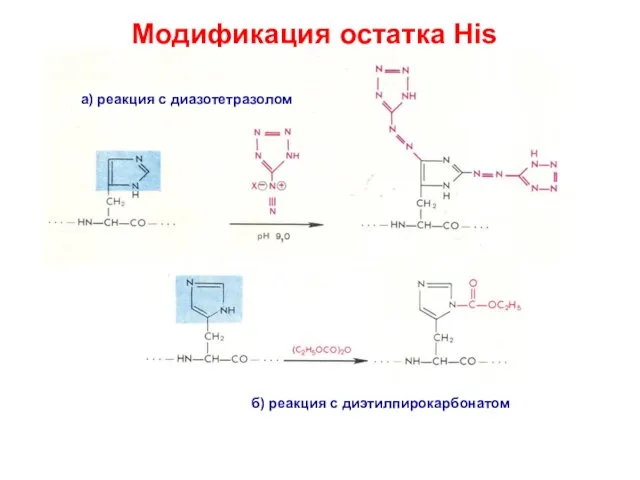
- 14. Модификация остатка His а) реакция с диазотетразолом б) реакция с диэтилпирокарбонатом
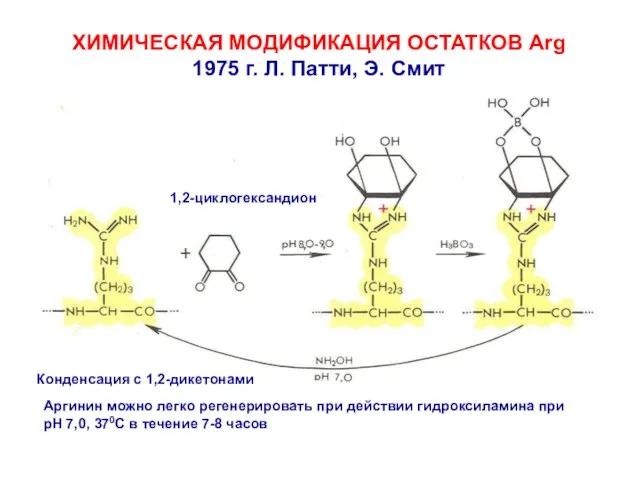
- 15. ХИМИЧЕСКАЯ МОДИФИКАЦИЯ ОСТАТКОВ Arg 1975 г. Л. Патти, Э. Смит Конденсация с 1,2-дикетонами 1,2-циклогександион Аргинин можно
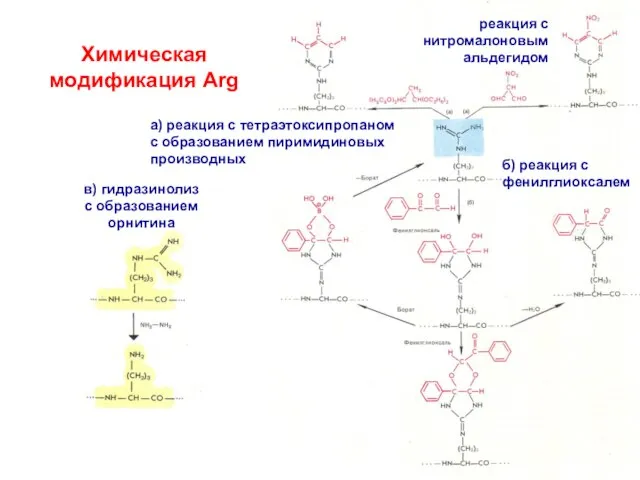
- 16. Химическая модификация Arg реакция с нитромалоновым альдегидом а) реакция с тетраэтоксипропаном с образованием пиримидиновых производных б)
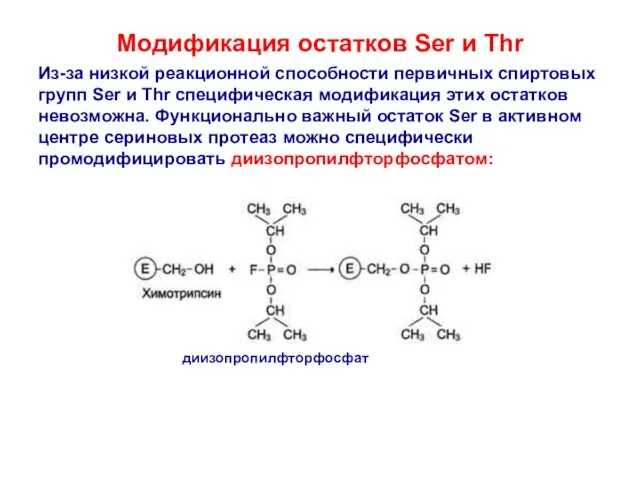
- 17. Модификация остатков Ser и Thr Из-за низкой реакционной способности первичных спиртовых групп Ser и Thr специфическая
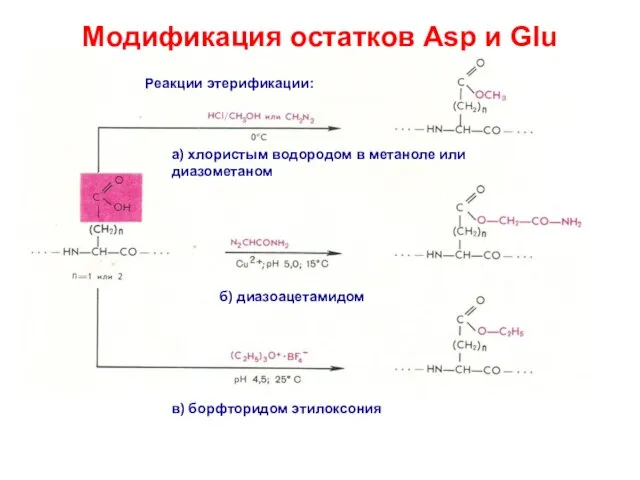
- 18. Модификация остатков Asp и Glu Реакции этерификации: б) диазоацетамидом а) хлористым водородом в метаноле или диазометаном
- 19. Модификация остатка Met Алкилирование иодацетамидом с образованием карбоксиметилсульфониевой соли
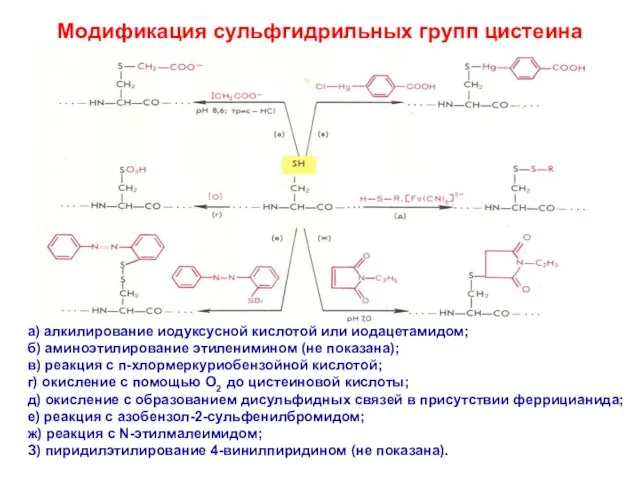
- 20. Модификация сульфгидрильных групп цистеина а) алкилирование иодуксусной кислотой или иодацетамидом; б) аминоэтилирование этиленимином (не показана); в)
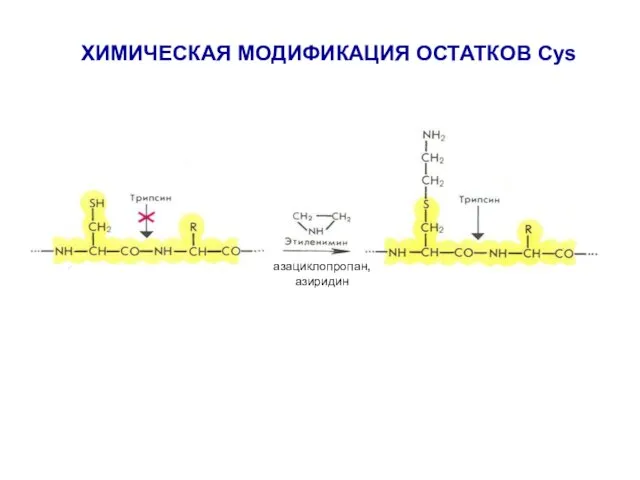
- 21. ХИМИЧЕСКАЯ МОДИФИКАЦИЯ ОСТАТКОВ Cys азациклопропан, азиридин
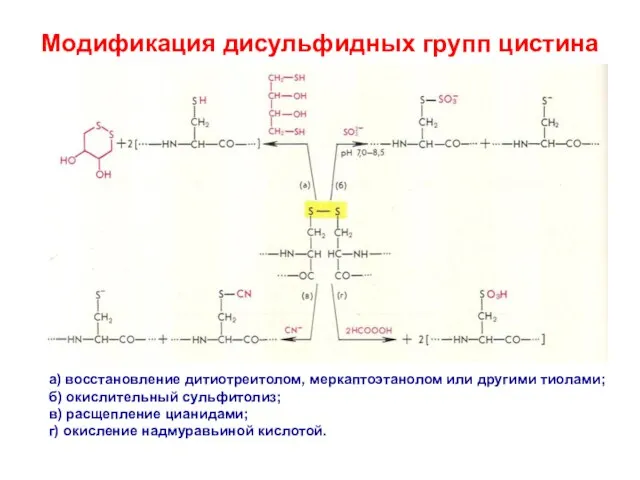
- 22. Модификация дисульфидных групп цистина а) восстановление дитиотреитолом, меркаптоэтанолом или другими тиолами; б) окислительный сульфитолиз; в) расщепление
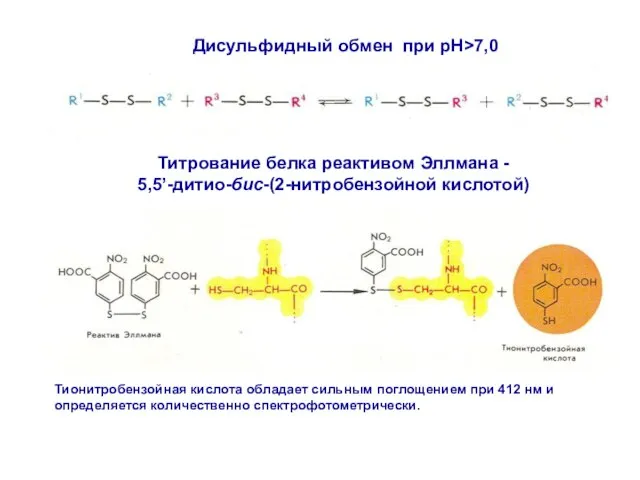
- 23. Титрование белка реактивом Эллмана - 5,5’-дитио-бис-(2-нитробензойной кислотой) Дисульфидный обмен при pH>7,0 Тионитробензойная кислота обладает сильным поглощением
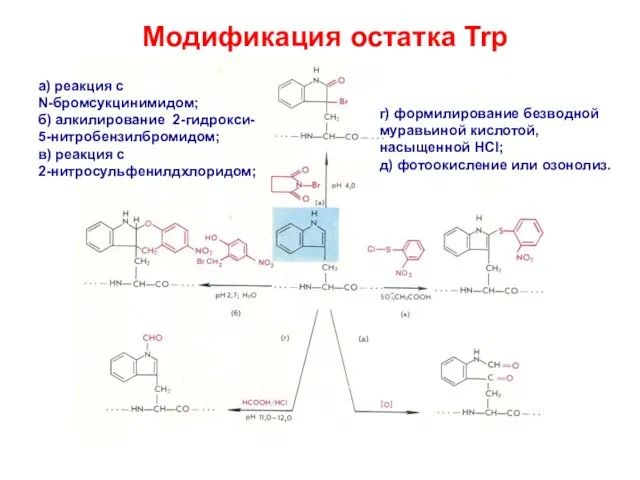
- 24. Модификация остатка Trp а) реакция с N-бромсукцинимидом; б) алкилирование 2-гидрокси- 5-нитробензилбромидом; в) реакция с 2-нитросульфенилдхлоридом; г)
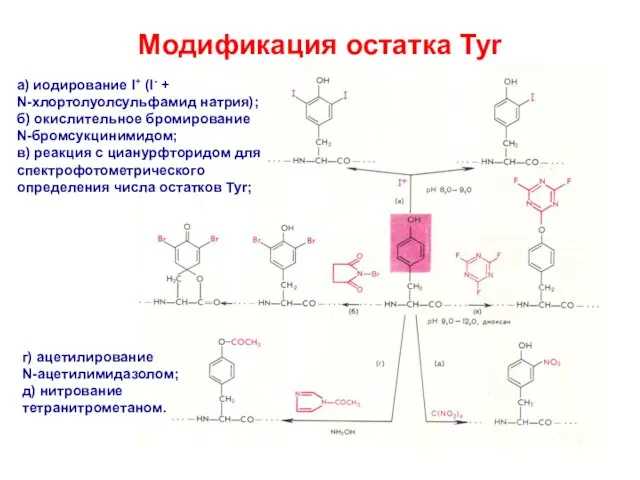
- 25. Модификация остатка Tyr а) иодирование I+ (I- + N-хлортолуолсульфамид натрия); б) окислительное бромирование N-бромсукцинимидом; в) реакция
- 26. Кросс-сшивающие или бифункциональные реагенты Кросс-сшивающими или бифункциональынми реагентами называются соединения с двумя реакционноспособными группами. Общая формула
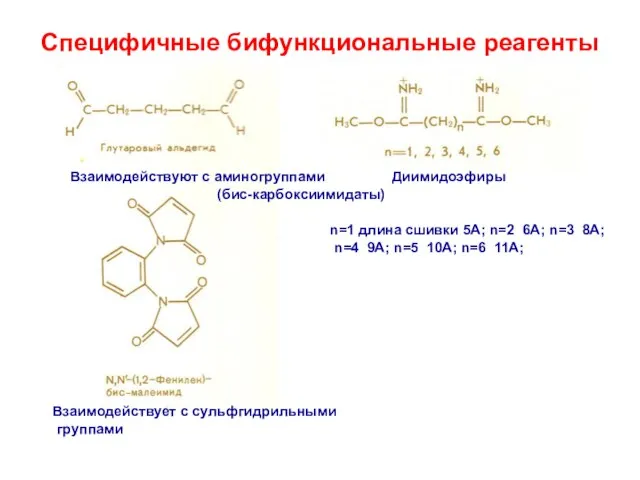
- 27. Специфичные бифункциональные реагенты n=1 длина сшивки 5A; n=2 6A; n=3 8A; n=4 9A; n=5 10A; n=6
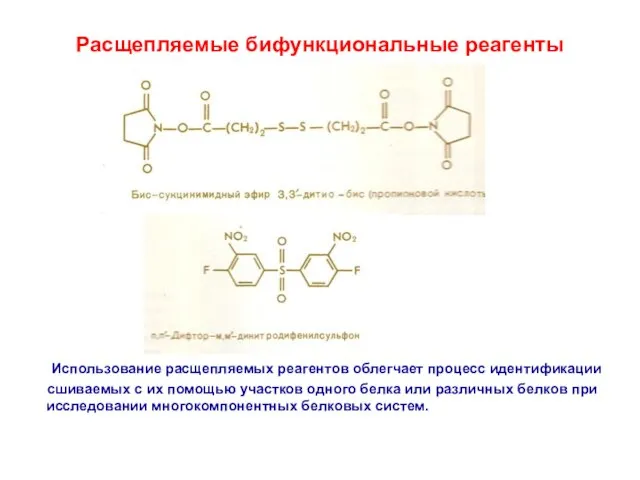
- 28. Расщепляемые бифункциональные реагенты Использование расщепляемых реагентов облегчает процесс идентификации сшиваемых с их помощью участков одного белка
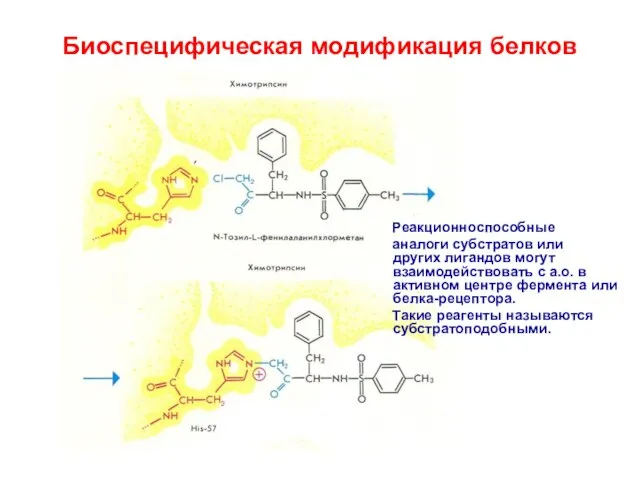
- 29. Биоспецифическая модификация белков Реакционноспособные аналоги субстратов или других лигандов могут взаимодействовать с а.о. в активном центре
- 31. Скачать презентацию










 Валерий Яковлевич Брюсов ( 1873 - 1924 )
Валерий Яковлевич Брюсов ( 1873 - 1924 ) Тест по теме «Информация. Информационные процессы»
Тест по теме «Информация. Информационные процессы» 6. Прямоугольник. Свойства прямоугольника. 5.10.22
6. Прямоугольник. Свойства прямоугольника. 5.10.22 Электронные измерительные приборы
Электронные измерительные приборы Внутренняя политика Екатерины 2
Внутренняя политика Екатерины 2 Выбор платежной системы для Интернет-магазина.
Выбор платежной системы для Интернет-магазина. MENU do Velykodnja
MENU do Velykodnja Коммерческое предложение от SmartExpert для Пивной двор
Коммерческое предложение от SmartExpert для Пивной двор Природные часы, календарь и компас
Природные часы, календарь и компас Волки
Волки Конференция«Рынок бытовой химии и household»
Конференция«Рынок бытовой химии и household» Особенности договоров аренды транспортных средств и договоров фрахтования Санников А.В.
Особенности договоров аренды транспортных средств и договоров фрахтования Санников А.В. Никола Тесла - человек из будущего «Наука ради науки не более чем извращенное занятие, если только она не служит высшей цели совер
Никола Тесла - человек из будущего «Наука ради науки не более чем извращенное занятие, если только она не служит высшей цели совер Metbolizme
Metbolizme  Калевала
Калевала Жила-была на белом свете лягушка-квакушка. Сидела она в глубоком болоте ловила серых комаров весною громко квакала вместе со всем
Жила-была на белом свете лягушка-квакушка. Сидела она в глубоком болоте ловила серых комаров весною громко квакала вместе со всем Архитектура Древней Руси 11 -13 вв
Архитектура Древней Руси 11 -13 вв Презентация на тему Нравственно-патриотическое восприятие дошкольников в процессе взаимодействия с семьями воспитанников
Презентация на тему Нравственно-патриотическое восприятие дошкольников в процессе взаимодействия с семьями воспитанников Buchungen von Forderungen nach US-Standards
Buchungen von Forderungen nach US-Standards SOA СТОИТ ДЕНЕГ
SOA СТОИТ ДЕНЕГ Автомобили Франции
Автомобили Франции  Реки и озера Кольского полуострова
Реки и озера Кольского полуострова Инструктор по тхэквон-до
Инструктор по тхэквон-до Монументы
Монументы پاور خلاصه نویسی
پاور خلاصه نویسی Решение задач при подготовке к государственным экзаменам в рамках дисциплины МПУР, Инновационный менеджмент
Решение задач при подготовке к государственным экзаменам в рамках дисциплины МПУР, Инновационный менеджмент Россия священная наша держава, Россия любимая наша страна. Могучая воля, великая слава Твоё достоянье на все времена! Славься, Отеч
Россия священная наша держава, Россия любимая наша страна. Могучая воля, великая слава Твоё достоянье на все времена! Славься, Отеч Италия
Италия