Содержание
- 2. Общая характеристика железа
- 3. Нахождение в природе Fe ХАЛЬКОПИРИТ ПИРИТ ЧЁРНЫЙ ПИРИТ ГЕМАТИТ
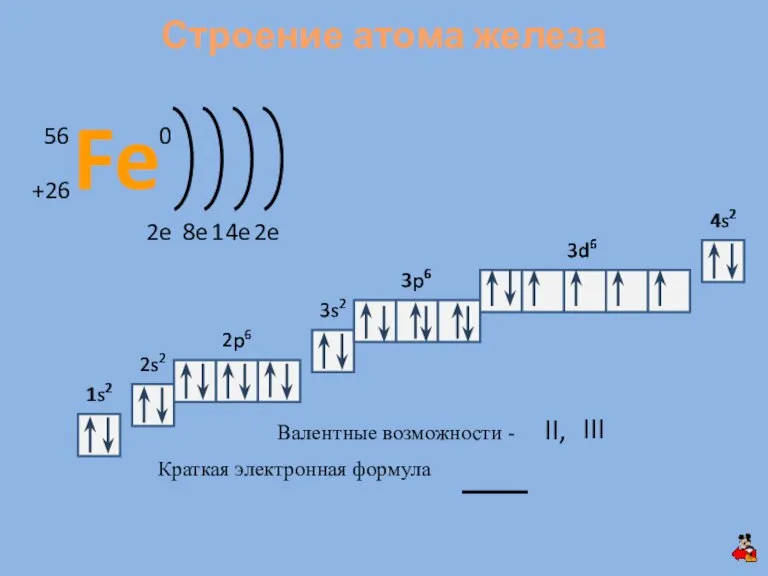
- 4. 1s2 2s2 2p6 3s2 3p6 1s2 2s2 2p6 3s2 Краткая электронная формула Валентные возможности - II,
- 5. Железо - сравнительно мягкий ковкий серебристо-серый металл. Температура плавления – 1535 0С Температура кипения около 2800
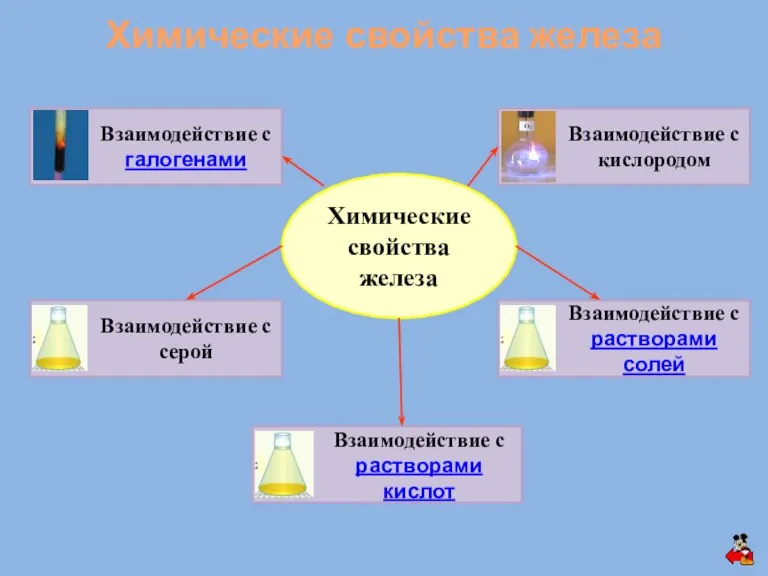
- 6. Химические свойства железа Химические свойства железа
- 7. Восстановление из оксидов железа: Алюмотермия: 2Al + Fe2O3 = 2Fe + Al2O3 Водородом: 2Н2 + Fe3O4
- 8. Когда открыто железо никто не знает и не узнает, так как это было слишком давно. Но
- 9. Закончите уравнения реакций: Fe + HBr = Fe + HCl(р-р) = Fe + O2 = Fe
- 11. Скачать презентацию






 Общая характеристика ресурсной базы социально-культурной деятельности
Общая характеристика ресурсной базы социально-культурной деятельности Новая Редполитика
Новая Редполитика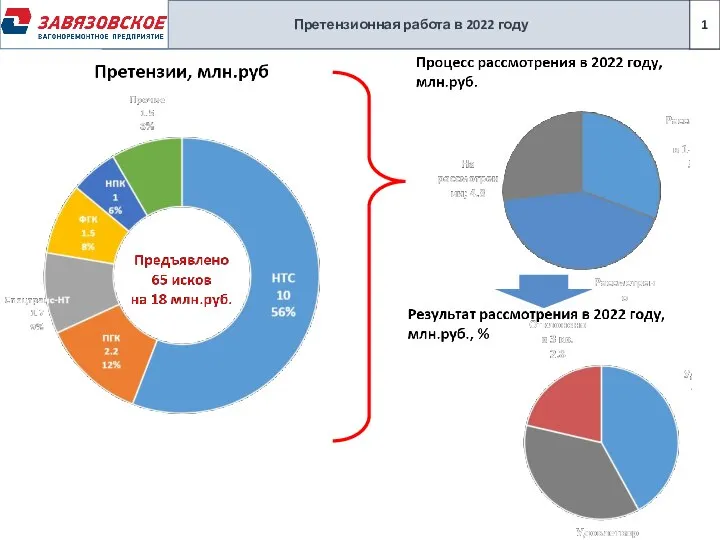 Претензии
Претензии История немецкой валюты
История немецкой валюты Современные средства оснащения образовательных учреждений
Современные средства оснащения образовательных учреждений Картинная галерея. Пейзажи
Картинная галерея. Пейзажи Александр III и его внутренняя политика
Александр III и его внутренняя политика Нумерация. Счёт предметов. Разряды
Нумерация. Счёт предметов. Разряды Дед Мороз и Снегурочка
Дед Мороз и Снегурочка Пушкинские места
Пушкинские места Традиции духовно-нравственного воспитания у народов России
Традиции духовно-нравственного воспитания у народов России Презентация на тему Разряды наречий по значению
Презентация на тему Разряды наречий по значению Времена года в творчестве А.С.Пушкина
Времена года в творчестве А.С.Пушкина Авторское право
Авторское право Ученик года-2021 6 а класс
Ученик года-2021 6 а класс От пандоры до модели…
От пандоры до модели… Применение лазерных технологий в обработке материалов в ювелирной отрасли
Применение лазерных технологий в обработке материалов в ювелирной отрасли Российские программы с мировым именем!
Российские программы с мировым именем! Как не разбиться в тумане
Как не разбиться в тумане Игровая технология
Игровая технология Firmensortiment
Firmensortiment Оценка и моделирование пенсионных обязательств
Оценка и моделирование пенсионных обязательств Занятость и социальная защита населения
Занятость и социальная защита населения Помещение на ул. Греческая, д. 69, г. Таганрог
Помещение на ул. Греческая, д. 69, г. Таганрог Совместная проектная деятельность обучающихся как инструмент творческой интеграции
Совместная проектная деятельность обучающихся как инструмент творческой интеграции Гумилёв Николай Степанович
Гумилёв Николай Степанович Презентация на тему Что такое ноосфера
Презентация на тему Что такое ноосфера  Высокое возрождение. Леонардо да Винчи. Рафаэль Санти
Высокое возрождение. Леонардо да Винчи. Рафаэль Санти