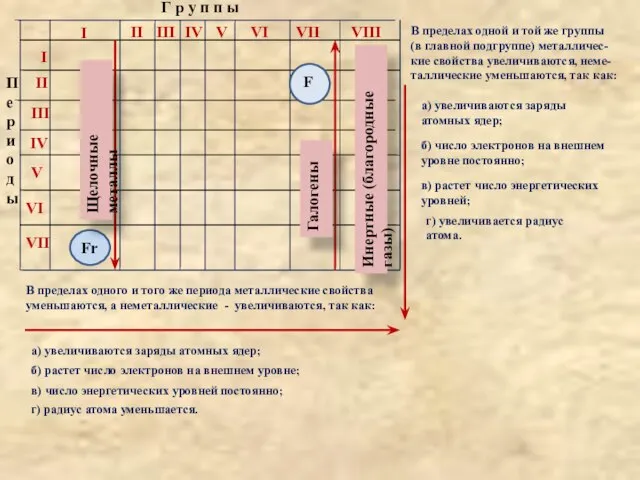
того же периода металлические свойства
уменьшаются, а неметаллические - увеличиваются, так как:
а) увеличиваются заряды атомных ядер;
б) растет число электронов на внешнем уровне;
в) число энергетических уровней постоянно;
г) радиус атома уменьшается.
В пределах одной и той же группы
(в главной подгруппе) металличес-
кие свойства увеличиваются, неме-
таллические уменьшаются, так как:
а) увеличиваются заряды
атомных ядер;
б) число электронов на внешнем
уровне постоянно;
в) растет число энергетических
уровней;
г) увеличивается радиус
атома.






 Юрий Алексеевич Гагарин родился 9 марта 1934 года в деревне Клушино Гжатского района Западной области РСФСР, неподалёку от города Гж
Юрий Алексеевич Гагарин родился 9 марта 1934 года в деревне Клушино Гжатского района Западной области РСФСР, неподалёку от города Гж О бабушке
О бабушке Сравнительная характеристика особенностей формирования образа жизни учащихся общеобразовательных учреждений города Кирова
Сравнительная характеристика особенностей формирования образа жизни учащихся общеобразовательных учреждений города Кирова Робот-рыболов
Робот-рыболов Скелет строение и состав костей
Скелет строение и состав костей Предприятие по производству грибов
Предприятие по производству грибов Литературный обзор и практическая часть
Литературный обзор и практическая часть Род несклоняемых имен существительных. УМК «Начальная школа ХХI века»
Род несклоняемых имен существительных. УМК «Начальная школа ХХI века» Методические рекомендации по проведению Всероссийского фестиваля любительских творческих коллективов с вручением грантов
Методические рекомендации по проведению Всероссийского фестиваля любительских творческих коллективов с вручением грантов Развитие речи на примере произведения И.С. Тургенева "Голуби"
Развитие речи на примере произведения И.С. Тургенева "Голуби" Праздник 8 Марта в начальной школе - презентация для начальной школы
Праздник 8 Марта в начальной школе - презентация для начальной школы Деньги медные, серебряные и золотые
Деньги медные, серебряные и золотые Вспомним школьные годы
Вспомним школьные годы Хлебновка. Борщ по-украински. Полтавские налистники с творогом
Хлебновка. Борщ по-украински. Полтавские налистники с творогом Военная служба по контракту
Военная служба по контракту Судьба и родина едины!
Судьба и родина едины! Снятие мерок
Снятие мерок Past Continuous
Past Continuous Презентация на тему Осетинский театр
Презентация на тему Осетинский театр  Сборка неподвижных неразъемных соединений. Лужение
Сборка неподвижных неразъемных соединений. Лужение Новоиерусалимский монастырь
Новоиерусалимский монастырь Площади
Площади Бизнес-задача
Бизнес-задача Светоносный элемент
Светоносный элемент Дворянское сословие, вольные хлебопашцы и военные поселения
Дворянское сословие, вольные хлебопашцы и военные поселения Фитбол для всех
Фитбол для всех Олимпионики античных олимпийских игр
Олимпионики античных олимпийских игр Презентация на тему Как Русь начиналась
Презентация на тему Как Русь начиналась