Слайд 2Вопросы для самоконтроля
1.Цель 1-го тапа. Манипуляции.
2.Продолжительность бак. Метода.
3.Этапы.
4.Методы выделения аэробов (описание, при

выделении какой культуры используется конкретный метод).
5.Особенности посева fecies, гноя.
6.Методы посева механическим разобщением.(рис!)
7.Метод Дригальского.
Слайд 3
Бактериологический метод -
основной метод бактериологического исследования
Метод заключается в выделении чистой культуры

возбудителя и его идентифи-кации, т.е. определение этиологии инфекционного заболевания
Слайд 4Терминологический словарь
Культура – это микроорганизмы, выросшие на питательной среде.
Чистая культура – это

микроорганизмы одного вида
Гемокультура- культура выделенная из крови
Копрокультура – культура выделенная из fecies
Колония - это потомство одной
микробной клетки. В изолирован-
ной колонии– чистая культура.
Слайд 5Штамм – это м.о. одного вида выделен-ные из разных источников (от разных

больных)
Культивирование – создание благопри-ятных условий роста и размножения возбудителя (температура, время, влаж-ность наличие или отсутствие кисло-рода и др.)
Культуральные свойства – характер роста возбудителя на питательных средах
Слайд 6Продолжительность и этапы бак. метода
Средняя продолжительность – 4 -5 дней. 3 этапа:
1

этап – выделение чистой культуры
2 этап – накопление чистой культуры
3 этап - идентификация чистой культуры
Слайд 7Идентификация –это изучение свойств микроорганизмов с целью установления рода, вида, варианта возбудителя

Слайд 8
1 этап выделение чистой культуры
1-ый день исследования
Цель: получение изолирован-ных колоний
Манипуляции:
Визуальное изучение

исследуемого материала для выявления нехарактерных включений
Микроскопия (при необходимости)
Подготовка материала для посева
Посев на среды обогащения и специальные среды
культивирование
Слайд 92 этап( 2-ой день исследования)
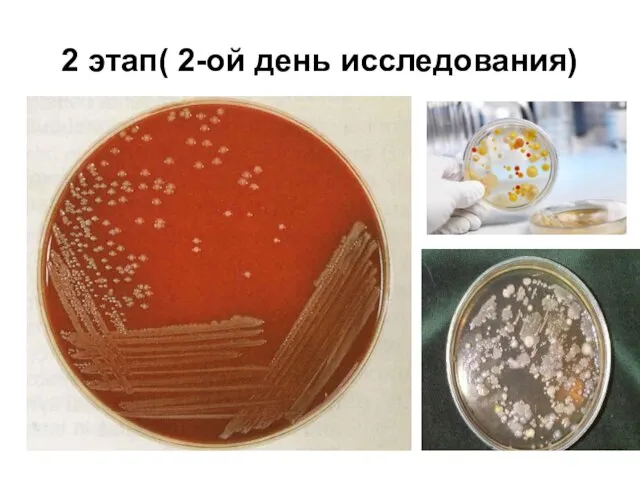
Слайд 10Цель этапа – накопление чистой культуры
Манипуляции:
Выбор характерной изолированной колонии
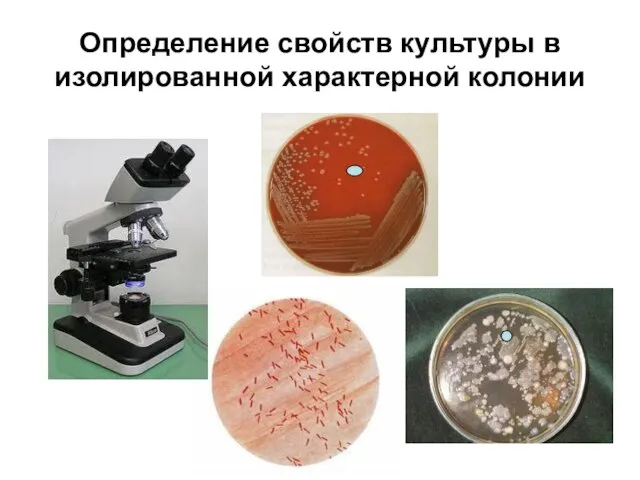
Изучение морфологических, тин- кториальных

свойств и чистоты культуры в характерной колонии – окраска по Граму
Посев остатков культуры из хара-
ктерной колонии на скошенный агар
для накопления чистой культуры
Культивирование
Слайд 11Определение свойств культуры в изолированной характерной колонии
Слайд 12Посев на скошенный агар для накопления чистой культуры

Слайд 133 этап (3 и 4 день исследования)– идентификация накопленной чистой культуры
Идентификацию проводят

по:
Морфологическим свойствам
Тинкториальным свойствам
Культуральным свойствам
Биохимической активности
Чувствительности к антибиотикам
Чувствительности к бактериофагу
Антигенной структуре
Слайд 14Изучение биохимической активности возбудителя: сахаролитической и протеолитической

Слайд 15Изучение биохимических свойств чистой культуры
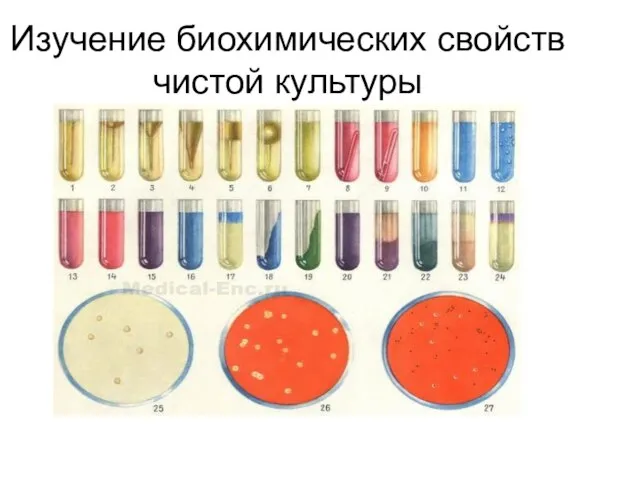
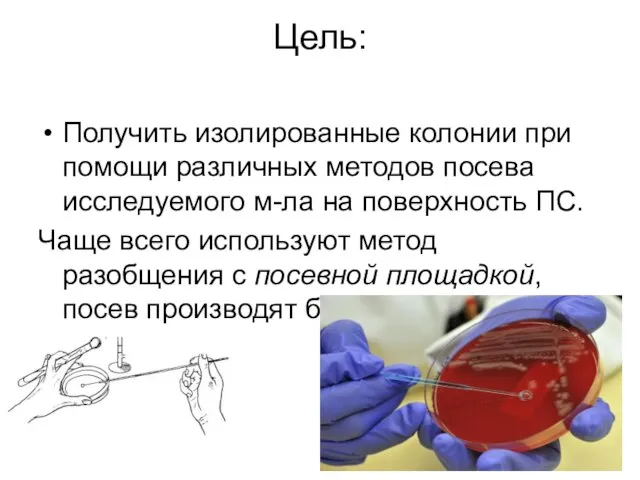
Слайд 16Рис. 1—6. Различные формы расщепления желатины.
Рис. 7 — 9. Жидкая среда

с углеводом и индикатором Андраде: рис. 7 — отсутствие ферментации; рис. 8 — ферментация с образованием кислоты; рис. 9 — ферментация с образованием кислоты и газа.
Рис. 10 — 12. Полужидкая среда с углеводом и индикатором BP (из сухой питательной среды): рис. 10 — отсутствие ферментации; рис. 11 — ферментация с образованием кислоты; рис. 12 — ферментация с образованием кислоты и газа.
Рис. 13—15. Искусственная лакмусовая сыворотка по Зейтцу: рис. 13 — отсутствие ферментации; рис. 14 — ферментация с образованием кислоты; рис. 15 — ферментация с образованием щелочи.
Рис. 16 и 17. Молоко с метиленовым синим: рис. 16 — отсутствие редукции; рис. 17 —редукция.
Рис. 18 и 19. Среда Симонса: рис. 18 —отсутствие ассимиляции цитрата; рис. 19 — ассимиляция цитрата.
Рис. 20 — 24. Лакмусовое молоко: рис. 20 — отсутствие ферментации; рис. 21 — ферментация с образованием кислоты; рис. 22 — ферментация с образованием щелочи; рис. 23 — пептонизация; рис. 24 — редукция.
Рис. 25. Разжижение свернутой сыворотки (в проходящем свете).
Рис. 26. Гемолиз на кровяном агаре (в проходящем свете).
Рис. 27. Кровяная среда с теллуритом калия.
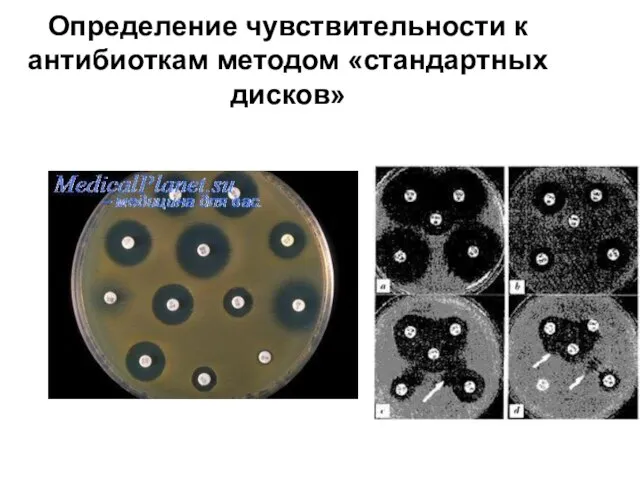
Слайд 17Определение чувствительности к антибиоткам методом «стандартных дисков»
Слайд 19Методы выделения чистой культуры возбудителя
Чистая культура – это скопление м/о одного вида

на плотной или в жидкой питательной среде
Слайд 21Техника посевов
Методы выделения чистых культур , основанные на принципе механического разобщения.
Методы механического

разобщения:
Фильтрация
Концентрация возбудителя – центрифугирование (применяется , если в исслед.м-ле мало возбудителя- ликвор)---осадок на исследование
Посевы методом механического разобщения с посевной площадкой
Слайд 22Цель:
Получить изолированные колонии при помощи различных методов посева исследуемого м-ла на поверхность
ПС.
Чаще всего используют метод разобщения с посевной площадкой, посев производят бак.петлей.
Слайд 23Техника посева
Сначала стерилизуют петлю в верхней части пламени горелки. Пробирку(емкость с иссл.м-лом)

открывают и проносят через пламя горелки. Петлю опускают в пробирку и, осторожно касаясь стенки, охлаждают. В последующем петлю опускают в пробирку и набирают материал. Если он находится в жидком состоянии, для посева достаточно капли жидкости, которая задерживается в бак.петле. Когда используют микроорганизмы, которые выросли на поверхности среды, осторожно плавным движением набирают небольшое количество их, следя, чтобы не повредить питательную среду.Петлю медленно вынимают из пробирки, не касаясь ее стенок, и переносят (втирают !) в ч. Петри на поверхность среды возле края чашки – это «посевная площадка»
Следующий этап посева начинают с места, где закончился предыдущий. Петлю кладут горизонтально на поверхность агара, где была сделана «посевная площадка», делают рассев по поверхности остальной среды. Необходимо пытаться, чтобы штрихи посева длились от края к краю чашки, не повреждали поверхности агара и располагались близко друг к другу. Этим искусственно продлевается линия посева и создаются возможности для получения изолированных колоний.
После этого петлю стерилизуют в пламени, чтобы уничтожить избыток материала.
Слайд 24Техника посева
Сначала стерилизуют петлю в верхней части пламени горелки. Пробирку(емкость с иссл.м-лом)

открывают и проносят через пламя горелки. Петлю опускают в пробирку и, осторожно касаясь стенки, охлаждают. В последующем петлю опускают в пробирку и набирают материал. Если он находится в жидком состоянии, для посева достаточно капли жидкости, которая задерживается в бак.петле. Когда используют микроорганизмы, которые выросли на поверхности среды, осторожно плавным движением набирают небольшое количество их, следя, чтобы не повредить питательную среду.Петлю медленно вынимают из пробирки, не касаясь ее стенок, и переносят (втирают !) в ч. Петри на поверхность среды возле края чашки – это «посевная площадка»
Следующий этап посева начинают с места, где закончился предыдущий. Петлю кладут горизонтально на поверхность агара, где была сделана «посевная площадка», делают рассев по поверхности остальной среды. Необходимо пытаться, чтобы штрихи посева длились от края к краю чашки, не повреждали поверхности агара и располагались близко друг к другу. Этим искусственно продлевается линия посева и создаются возможности для получения изолированных колоний.
После этого петлю стерилизуют в пламени, чтобы уничтожить избыток материала.
Слайд 25Спустя сутки инкубации посевов при оптимальной температуре на поверхности чашки вырастают изолированные
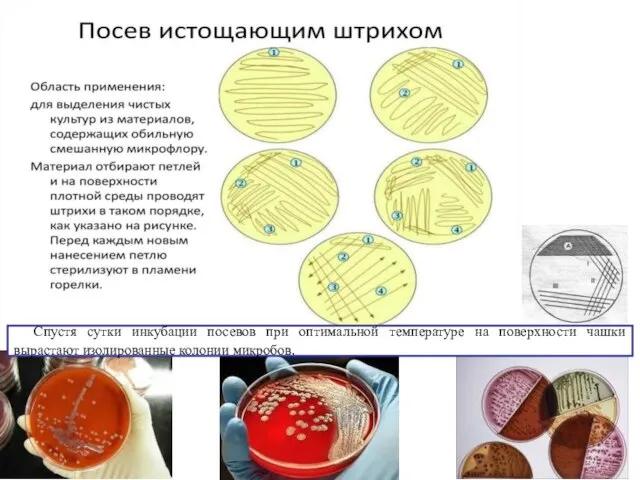
колонии микробов.
Слайд 26Посев шпателем и тампоном в чашки Петри. Материал предварительно наносят на поверхность
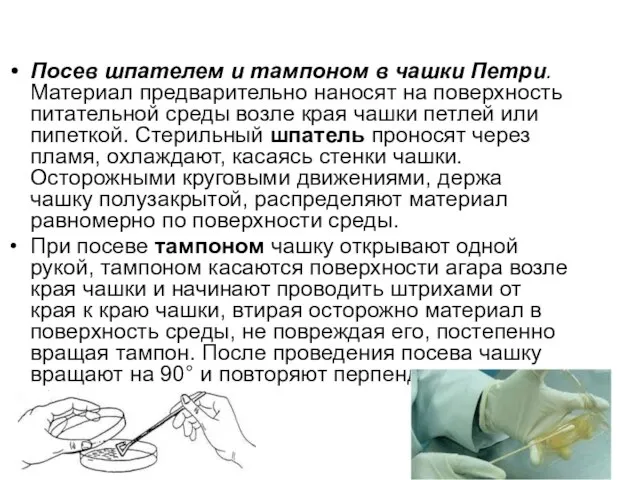
питательной среды возле края чашки петлей или пипеткой. Стерильный шпатель проносят через пламя, охлаждают, касаясь стенки чашки. Осторожными круговыми движениями, держа чашку полузакрытой, распределяют материал равномерно по поверхности среды.
При посеве тампоном чашку открывают одной рукой, тампоном касаются поверхности агара возле края чашки и начинают проводить штрихами от края к краю чашки, втирая осторожно материал в поверхность среды, не повреждая его, постепенно вращая тампон. После проведения посева чашку вращают на 90° и повторяют перпендикулярно к предыдущему.
Слайд 27Метод Дригальского
Сначала на поверхность среды в чашке Петри пипеткой или петлей
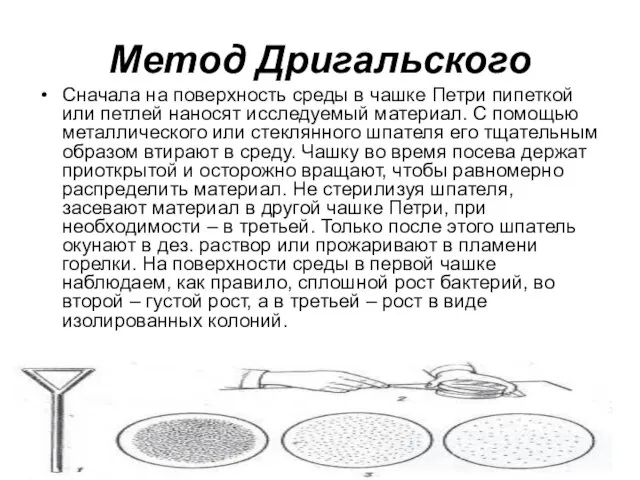
наносят исследуемый материал. С помощью металлического или стеклянного шпателя его тщательным образом втирают в среду. Чашку во время посева держат приоткрытой и осторожно вращают, чтобы равномерно распределить материал. Не стерилизуя шпателя, засевают материал в другой чашке Петри, при необходимости – в третьей. Только после этого шпатель окунают в дез. раствор или прожаривают в пламени горелки. На поверхности среды в первой чашке наблюдаем, как правило, сплошной рост бактерий, во второй – густой рост, а в третьей – рост в виде изолированных колоний.
Слайд 28Способы посева
1. Открытый
Для выделения возбудителей кишечных инфекций. Фекалии засевают стеклянной палочкой(петлей) открытым
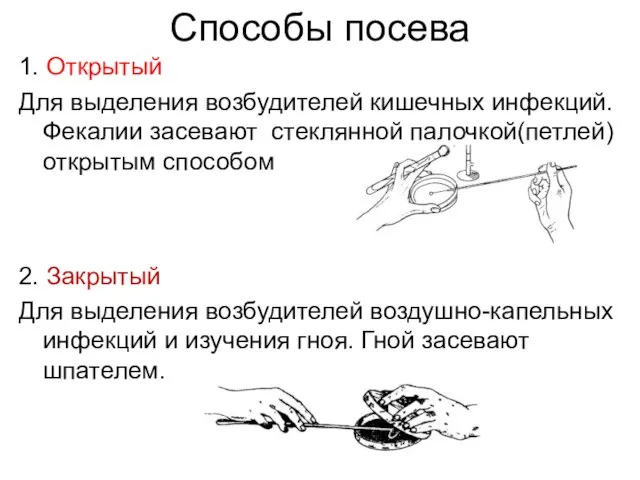
способом
2. Закрытый
Для выделения возбудителей воздушно-капельных инфекций и изучения гноя. Гной засевают шпателем.
Слайд 29Техника посевов в жидкие среды имеет свои особенности.
В левую руку берут две

пробирки. В одной находится питательная среда (плотная или жидкая), в другой – исследуемый материал. Пробирки зажимают большим и указательным пальцами. Для того, чтобы можно было наблюдать за содержанием пробирок, их держат сверху кисти руки.
Слайд 30Пробирки должны быть наклоненными. Нужно следить, чтобы при открытии их материал не

был инфицирован.
Пробки из пробирок вынимают, держа их 4 и 5 пальцами правой руки. Тремя другими пальцами правой руки, как карандаш, держат бак.петлю или пипетку, которыми распределяют исследуемый материал. Сначала стерилизуют петлю в верхней части пламени газовой горелки. Пробирки открывают и край их проносят через пламя горелки. Петлю опускают в пробирку, где есть исследуемый материал, и, осторожно касаясь стенки, охлаждают. В последующем петлю опускают в пробирку и набирают материал. Если он находится в жидком состоянии, для посева достаточно капли жидкости, которая задерживается в бактериологической петле. Петлю медленно вынимают из пробирки, не касаясь ее стенок, и переносят в пробирку со средой.
Слайд 31Хим. и физ. методы подготовки материала
Физ. метод разобщения микробных клеток :
При выделении

споровой культуры иссл. м-л. Нагревают до 80 20 мин.
Низкие t – выделение психофилов (это м/о,которые размножаются при низ t)
Хим. Факторы :
Применяются при выделении кислото- и щелочеустойчивых м/щ (туберкулез). Иссл.м-л обрабатывается 4-5% Н2SO4
Слайд 32Выбор иссл.м-ла для БАК метода зависит от :
1. Вида возбудителя
2. Периода заболевания
3.

Преимущественной локализации возбудителя
Культура, выделенная из крови – гемокультура
Культура, выделенная из фекалий - копрокультура































 Выяснение основных ароморфозов мекопитающих
Выяснение основных ароморфозов мекопитающих Красная книга
Красная книга Процессы анаэробного и аэробного дыхания
Процессы анаэробного и аэробного дыхания Физиология обмена веществ и энергии. Питание
Физиология обмена веществ и энергии. Питание Взаимосвязанные изменения органов и систем органов в онто- и филогенезе
Взаимосвязанные изменения органов и систем органов в онто- и филогенезе Морфология цветка
Морфология цветка Презентация на тему КЛАССИФИКАЦИЯ ЖИВОТНЫХ И ОСНОВНЫЕ СИСТЕМАТИЧЕСКИЕ ГРУППЫ
Презентация на тему КЛАССИФИКАЦИЯ ЖИВОТНЫХ И ОСНОВНЫЕ СИСТЕМАТИЧЕСКИЕ ГРУППЫ  Место человека в системе органического мира. Тесты
Место человека в системе органического мира. Тесты Морские гиганты. Акулы
Морские гиганты. Акулы Кровообращение. Урок-обобщение
Кровообращение. Урок-обобщение Нервная система. Лекция 12
Нервная система. Лекция 12 Лисица
Лисица Грибы. 2 класс
Грибы. 2 класс анатомия и особенности строения ребер
анатомия и особенности строения ребер Стилизация растительных форм
Стилизация растительных форм Презентация на тему Насекомые - переносчики возбудителей болезней и паразиты
Презентация на тему Насекомые - переносчики возбудителей болезней и паразиты  Почва как среда обитания животных
Почва как среда обитания животных Вітаміни. Існування і значення вітамінів для життя
Вітаміни. Існування і значення вітамінів для життя Домашние животные и их детеныши
Домашние животные и их детеныши Презентация на тему Лекарственные растения огорода
Презентация на тему Лекарственные растения огорода  Основы вирусологии. Бактериофагия
Основы вирусологии. Бактериофагия Жизнь пчел
Жизнь пчел Клеточное строение организма
Клеточное строение организма Нервная система: строение и значение
Нервная система: строение и значение Закономерности и виды изменчивости
Закономерности и виды изменчивости Простейшие заболевания. Таблица
Простейшие заболевания. Таблица Презентация на тему Викторина «Карнавал животных»
Презентация на тему Викторина «Карнавал животных»  Основные понятия генетики
Основные понятия генетики