Содержание
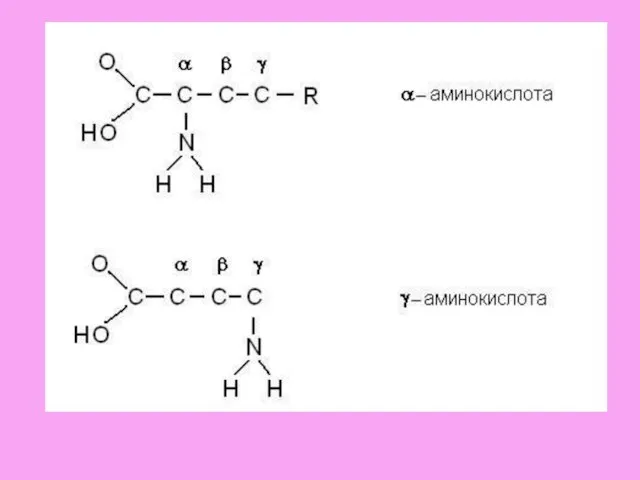
- 3. Карбоксильная группа имеет кислотный характер, она диссоциирует на ионы в водном растворе с образованием протона и
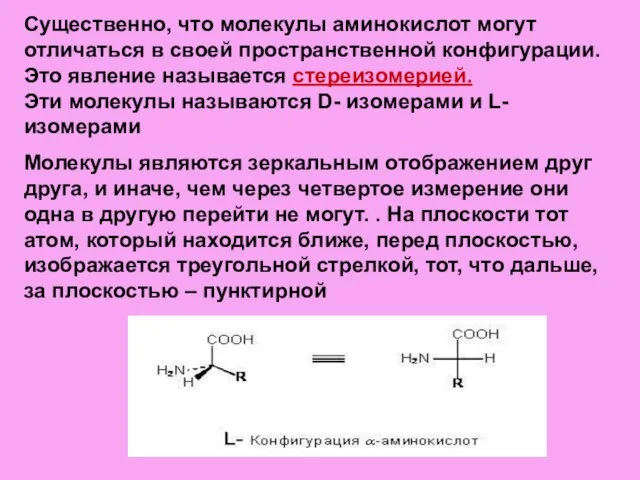
- 4. Существенно, что молекулы аминокислот могут отличаться в своей пространственной конфигурации. Это явление называется стереизомерией. Эти молекулы
- 5. В живом организме все аминокислоты – L–изомеры. D-изомеры встречаются довольно редко и имеют определенные функции, например,
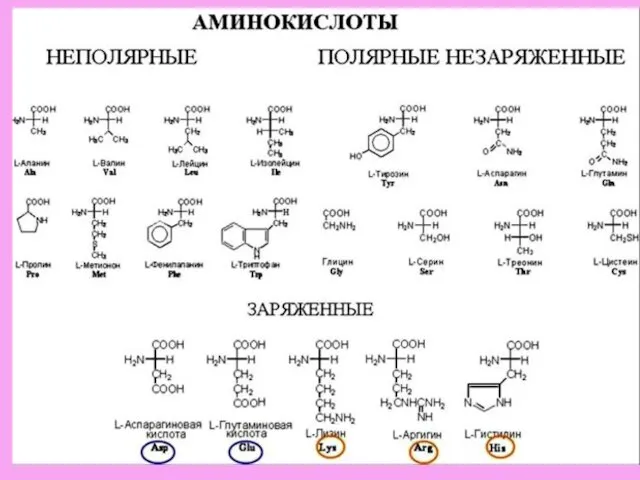
- 7. Последовательность аминокислот в белке составляет его первичную структуру. Как же они соединяются? Аминокислоты способны взаимодействовать друг
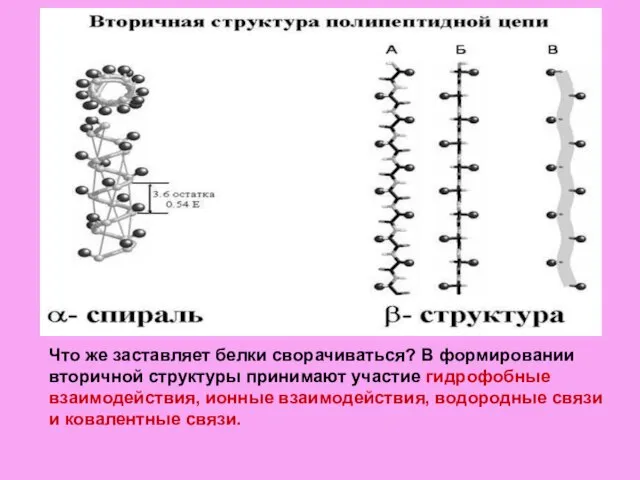
- 8. В зависимости от того, какие аминокислоты образовали цепочку, он может свернуться в пространстве и принять ту
- 9. Что же заставляет белки сворачиваться? В формировании вторичной структуры принимают участие гидрофобные взаимодействия, ионные взаимодействия, водородные
- 10. Расположение элементов вторичной структуры в пространстве относительно друг друга называется третичной структурой белка.
- 11. Но, в клетке еще есть белки, которые называются шапероны (от слова shape - форма), которые помогают
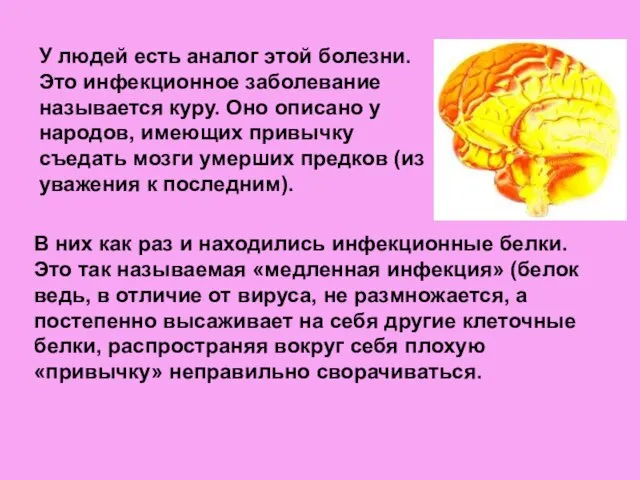
- 12. У людей есть аналог этой болезни. Это инфекционное заболевание называется куру. Оно описано у народов, имеющих
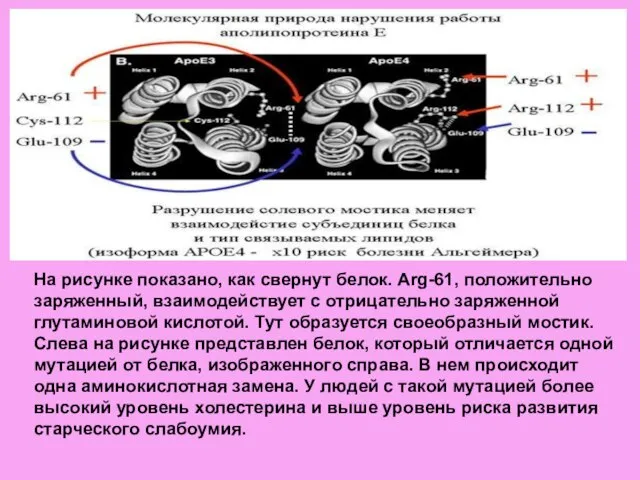
- 13. На рисунке показано, как свернут белок. Arg-61, положительно заряженный, взаимодействует с отрицательно заряженной глутаминовой кислотой. Тут
- 14. Существуют разные классификации белков: 1. По составу:
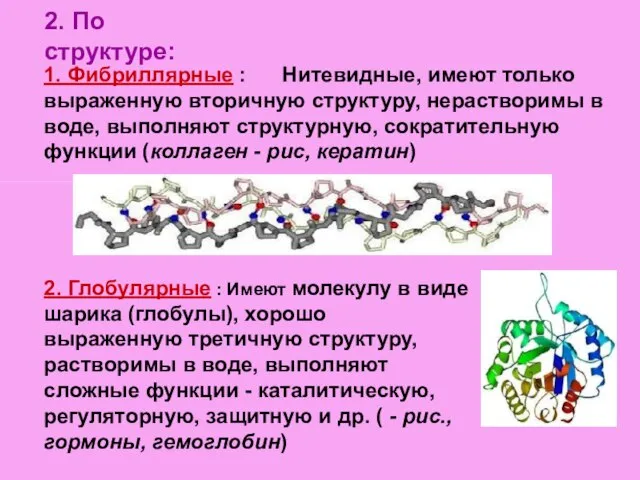
- 15. 2. По структуре: 1. Фибриллярные : Нитевидные, имеют только выраженную вторичную структуру, нерастворимы в воде, выполняют
- 16. 3. Мембранные : Также имеют молекулу в виде шарика (глобулы) и хорошо выраженную третичную структуру, но
- 17. 3. По функциям: 1. Каталитическая. Ферменты (энзимы) - увеличивают скорость протекания химических реакций (каталаза, пепсин, трипсин)
- 19. Скачать презентацию









 Выращивание сеянца дуба из желудя разными способами в комнатных условиях
Выращивание сеянца дуба из желудя разными способами в комнатных условиях Веселая биология. Загадки
Веселая биология. Загадки DNA evidence
DNA evidence Многообразие и значение водорослей
Многообразие и значение водорослей Презентация на тему Генная и клеточная инженерия
Презентация на тему Генная и клеточная инженерия  Путешествие с комнатными растениями
Путешествие с комнатными растениями Анатомия глазного яблока
Анатомия глазного яблока GRIBY
GRIBY Систематика растений
Систематика растений Жизнь пчел
Жизнь пчел Введение в биологию. Раздел 1. Клетка – единица живого
Введение в биологию. Раздел 1. Клетка – единица живого Презентация на тему Что такое кровь?
Презентация на тему Что такое кровь?  Проверочная работа Работа сердца тренированного и нетренированного человека
Проверочная работа Работа сердца тренированного и нетренированного человека Выполнила Ученица 9 а класса Школы № 953 Васильева Маргарита Научный руководитель: Гусева Наталья Геннадьевна
Выполнила Ученица 9 а класса Школы № 953 Васильева Маргарита Научный руководитель: Гусева Наталья Геннадьевна Культивирование клеток. Получение суспензионной культуры
Культивирование клеток. Получение суспензионной культуры Развитие дыхательной системы
Развитие дыхательной системы Строение нервной системы. Спинной мозг
Строение нервной системы. Спинной мозг Анатомия и физиология человека
Анатомия и физиология человека Царство Грибы часть 3
Царство Грибы часть 3 Что такое живое
Что такое живое Витамины. Часть I
Витамины. Часть I Отчет по практике на тему Ярусность растений пришкольного участка Муниципального бюджетного общеобразовательного учреждения
Отчет по практике на тему Ярусность растений пришкольного участка Муниципального бюджетного общеобразовательного учреждения Земноводные животные (или амфибии)
Земноводные животные (или амфибии) Анатомия центральной нервной системы
Анатомия центральной нервной системы Витамин H
Витамин H Электрофизиология
Электрофизиология Презентация на тему Типы экологических взаимоотношений организмов
Презентация на тему Типы экологических взаимоотношений организмов  Любимый огород
Любимый огород