Содержание
- 2. биополимеры Нуклеиновые кислоты белки углеводы липиды Всё!
- 3. белки строение структура функции аминокислоты классификация белков В начало
- 4. Строение белков Белки – это высокомолекулярные азотистые соединения, состоящие из аминокислот, связанных пептидными связями. Элементарный состав
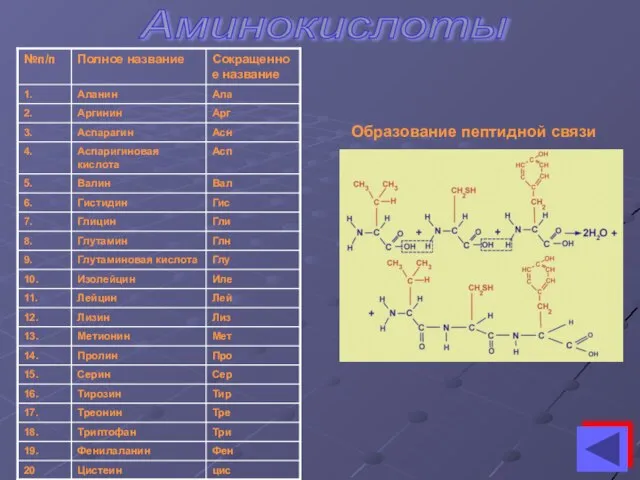
- 5. Аминокислоты Образование пептидной связи
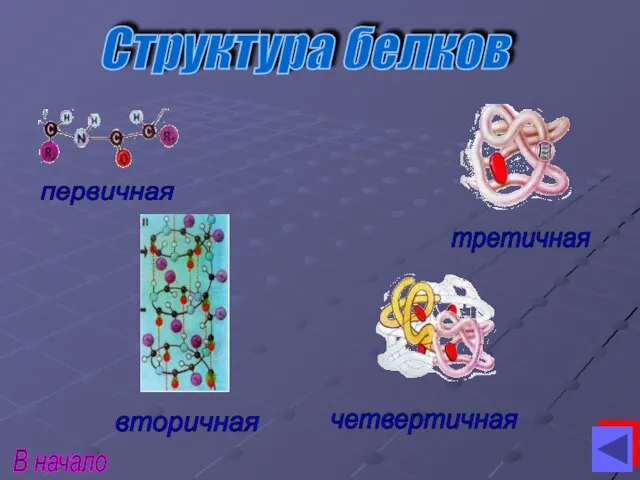
- 6. первичная вторичная третичная четвертичная Структура белков В начало
- 7. первичная стуртура белков Последовательное расположение аминокислотных остатков в полипептидной цепи. …- ала – лиз – вал
- 8. вторичная стуктура белков Происходит пространственное расположение полипептидной цепи. В зависимости от торсионных углов возможно образование 3
- 9. третичная стуктура белков Происходит общее пространственное расположение белковой молекулы. Третичная структура определяется формой «упаковки» доменов. (домен
- 10. четвертичная структура белков Четвертичную структуру имеют только белки, состоящие из нескольких субъединиц. Это сформировавшаяся часть белковой
- 11. Функции белков 1) Пластическая (строительная) функция. Белки участвуют в образовании всех клеточных мембран и органоидов клетки,
- 12. классификация белков I. По химическому составу выделяют белки: 1) Простые (протеины), состоящие только из аминокислот. 2)
- 13. Нуклеиновые кислоты ДНК РНК В начало
- 14. Д Н К Структура Функции Строение
- 15. Нуклеиновые кислоты – высокомолекулярные соединения, характеризующиеся определенным элементарным составом и состоящие из нуклеотидов (АГЦО, углевод, остаток
- 16. Структура ДНК первичная вторичная третичная четвертичная
- 17. Происходит последовательное расположение нуклеотидов в полинуклеотидной цепи. В ходе изучения первичной структуры были открыты некоторые закономерности.
- 18. Происходит определенное пространственное расположение полинуклеотидной цепи. Характерной особенность вторичной структуры является спирализация полинуклеотидной цепи. У ДНК
- 19. Происходит общее пространственное расположение молекулы ДНК. Благодаря третичной структуре происходит «плотная» упаковка молекулы ДНК в клетках
- 20. Происходит общее пространственное расположение отдельных молекул ДНК в хромосоме и взаимное расположение отдельных молекул ДНК и
- 21. Значение ДНК (как РНК) в клетке очень велико. Особенности их химического строения обеспечивают возможность хранения, переноса
- 22. Р Н К виды строение
- 23. Строение РНК РНК, как и ДНК представляет собой биополимер, мономерами которого являются нуклеотиды, состоящие из трех
- 24. р – РНК (рибосомная) Виды Р Н К т – РНК (транспортная) и – РНК (информационная,
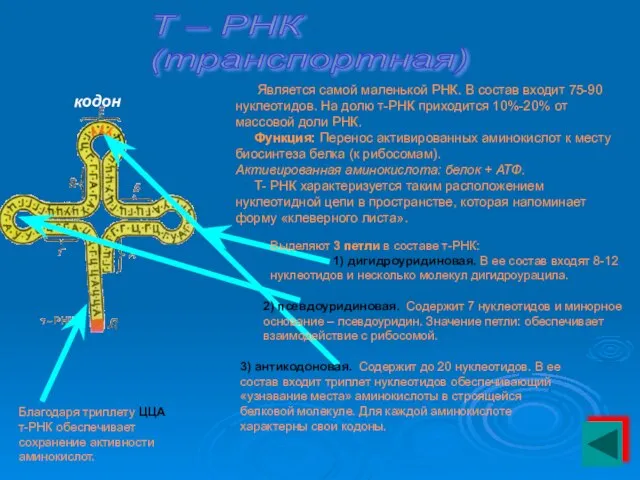
- 25. Т – РНК (транспортная) Является самой маленькой РНК. В состав входит 75-90 нуклеотидов. На долю т-РНК
- 26. и – РНК (информационная, матричная) И - РНК образуется в ходе транскрипции на молекуле ДНК, поэтому
- 27. р – РНК (рибосомная) Являются основным структурным компонентом рибосом. На долю р-РНК приходится до 75% от
- 28. углеводы виды функции В начало
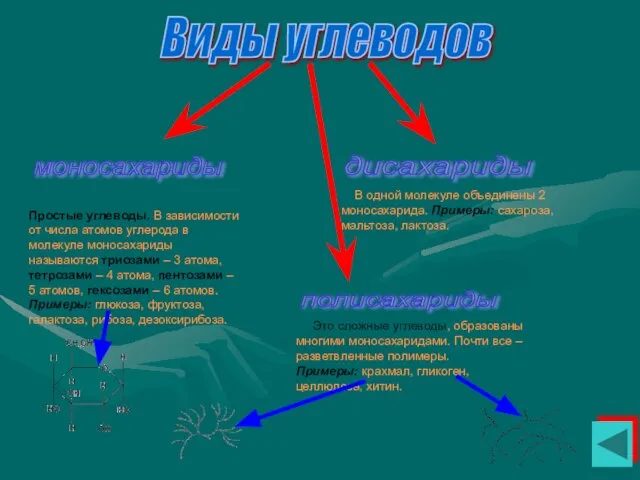
- 29. Виды углеводов моносахариды дисахариды полисахариды Простые углеводы. В зависимости от числа атомов углерода в молекуле моносахариды
- 30. Функции углеводов 1) Основная функция – энергетическая. При расщеплении и окислении выделяется энергия, которая обеспечивает жизнедеятельность
- 32. Скачать презентацию

























 Скелет совокупность всех костей организма
Скелет совокупность всех костей организма Нервная система. Лекция 12
Нервная система. Лекция 12 Строение сердца и кровеносных сосудов. Биология 8 класс
Строение сердца и кровеносных сосудов. Биология 8 класс Ромбовидный мозг человека. Продолговатый мозг. Мост
Ромбовидный мозг человека. Продолговатый мозг. Мост Протисты. Общая характеристика
Протисты. Общая характеристика Почва как среда обитания микроорганизмов
Почва как среда обитания микроорганизмов Переход от одноклеточных к многоклеточным
Переход от одноклеточных к многоклеточным Игра Конкурс знатоков. Природоведение
Игра Конкурс знатоков. Природоведение Презентация на тему Транспорт веществ в организме
Презентация на тему Транспорт веществ в организме  Физиологические основы психики
Физиологические основы психики Возр. особенности скелета (2)
Возр. особенности скелета (2) Энто 9 Салтанат
Энто 9 Салтанат Список редких и изчезающих видов растений внесеных в Красную книгу Оренбургской области
Список редких и изчезающих видов растений внесеных в Красную книгу Оренбургской области Неклеточные формы жизни: В И Р У С Ы
Неклеточные формы жизни: В И Р У С Ы Республиканский экологический урок Птицы
Республиканский экологический урок Птицы Болезни комнатных растений
Болезни комнатных растений Модификационная и мутационная изменчивость. Часть 1. Лекция 11
Модификационная и мутационная изменчивость. Часть 1. Лекция 11 Презентация на тему Строение легких человека. Анатомия
Презентация на тему Строение легких человека. Анатомия  Растительный и животный мир Тамбовской области
Растительный и животный мир Тамбовской области Животные левши или правши?
Животные левши или правши? Биохимическое исследование и доказательство наличия полезных химических веществ в ламинарии
Биохимическое исследование и доказательство наличия полезных химических веществ в ламинарии Ядовитые цветы
Ядовитые цветы Белки состав,строение
Белки состав,строение Интересные факты про органы чувств человека
Интересные факты про органы чувств человека Эволюция пищеварительной системы
Эволюция пищеварительной системы Генная инженерия дрожжей
Генная инженерия дрожжей Ствол мозга
Ствол мозга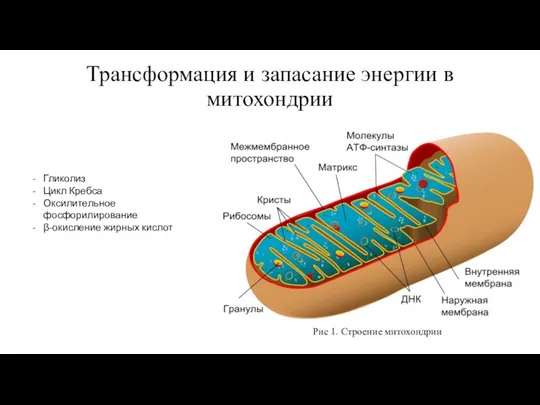 Трансформация и запасание энергии в митохондрии
Трансформация и запасание энергии в митохондрии