Содержание
- 2. Ферменты Ферменты - это белковые вещества, играющие очень важную роль в различных биохимических процессах в организме.
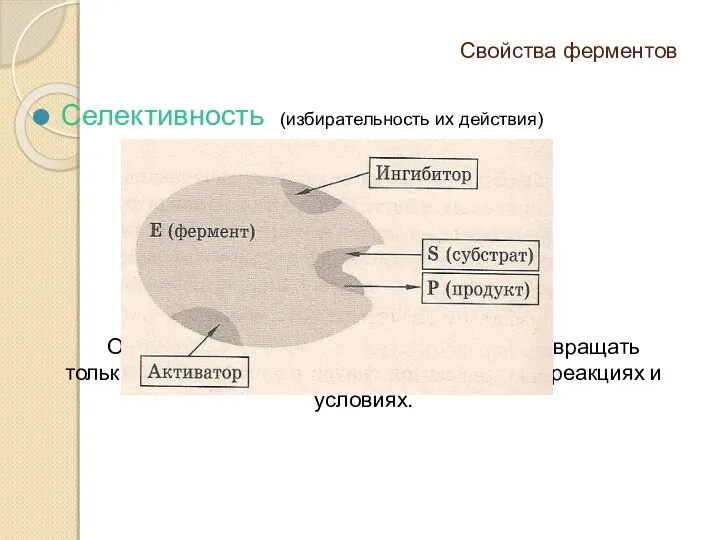
- 3. Свойства ферментов Селективность (избирательность их действия) Определяется способностью фермента превращать только данный тип субстратов в определенных
- 4. Высокая каталитическая активность Добавка незначительной концентрации фермента ускоряет превращение субстрата в 10 8 - 1012 раз.
- 5. Зависимость от температуры Многие ферменты обладают наибольшей эффективностью при температуре человеческого тела, т.е. приблизительно при Человек
- 6. Следующим важным свойством является то, что ферменты находятся в тканях и клетках в неактивной форме (проферменте).
- 7. Ферменты В зависимости от того, какие виды реакций организма катализируют ферменты, они выполняют различные функции. Чаще
- 8. Пищеварительные ферменты Различают три основные категории таких ферментов: амилаза, протеазы, липаза. Амилаза расщепляет углеводы и находится
- 9. Классификация ферментов На Международном биохимическом съезде было принято, что ферменты должны классифицироваться по типу реакции, катализируемой
- 10. Классификация ферментов 1.Оксидоредуктазы - ферменты, катализирующие окислительно-восстановительные реакции, например каталаза: 2 H2O2-->O2+2 H2O 2.Трансферазы - ферменты,
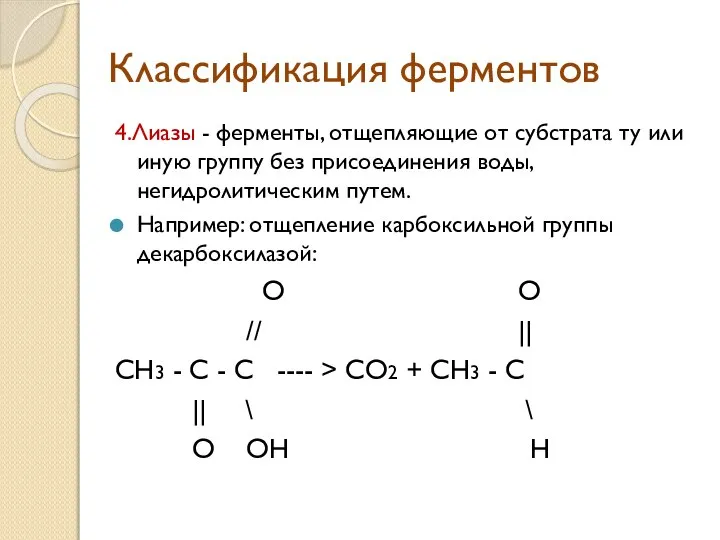
- 11. Классификация ферментов 4.Лиазы - ферменты, отщепляющие от субстрата ту или иную группу без присоединения воды, негидролитическим
- 12. 5.Изомеразы - ферменты, катализирующие превращение одного изомера в другой: глюкозо-6-фосфат --> глюкозо-1-фосфат 6.Синтетазы - ферменты, катализирующие
- 13. Амилаза
- 14. Амилаза, расщепляя крахмал и другие углеводы, обеспечивает переваривание углеводов пищи. Из организма амилазу выводят почки вместе
- 15. С диагностической точки зрения наиболее информативным является определение панкреатической амилазы, на активность, которой в крови приходится
- 16. В клинической лабораторной практике распространены две группы методов исследования активности альфа-амилазы в биологических жидкостях: 1.Сахарифицирующие, основанные
- 17. Увеличение активности амилазы более чем в 10 раз: При остром панкреатите активность амилазы в крови и
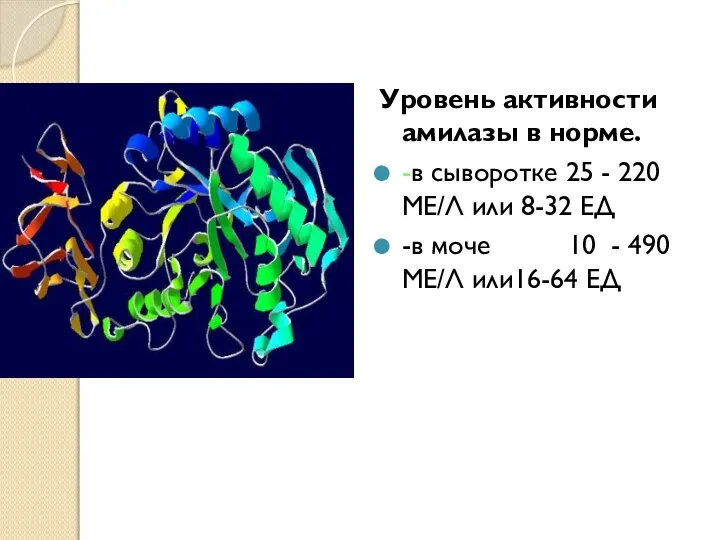
- 18. Уровень активности амилазы в норме. -в сыворотке 25 - 220 МЕ/Л или 8-32 ЕД -в моче
- 19. Применение ферментов Ферменты используют для смягчения кожи в кожевенной промышленности. Ферменты входят в состав стиральных порошков,
- 20. Применение ферментов Ферменты получили широкое применение в легкой, пищевой и химической промышленности, а также в медицине.
- 22. Скачать презентацию















 Бактерии и их формы
Бактерии и их формы Эволюция человека
Эволюция человека Как устроено наше зрение
Как устроено наше зрение Что происходит с растениями зимой?
Что происходит с растениями зимой? Экспрессия генов
Экспрессия генов Ядро и деление клетки
Ядро и деление клетки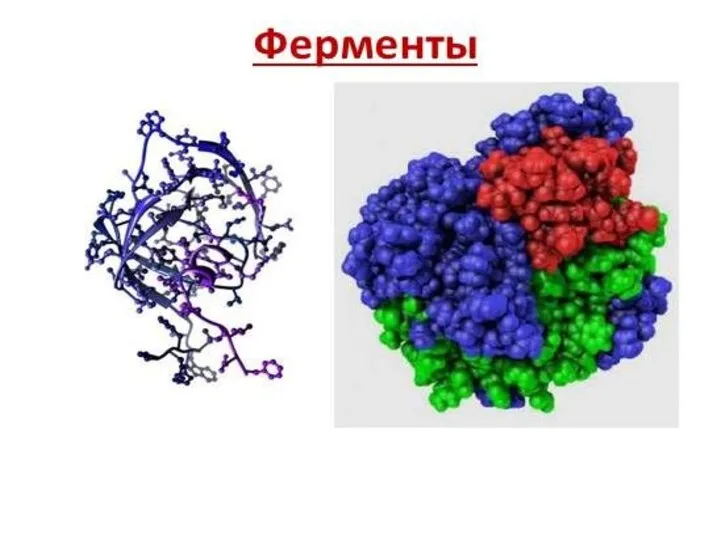 Ферменты. Строение фермента
Ферменты. Строение фермента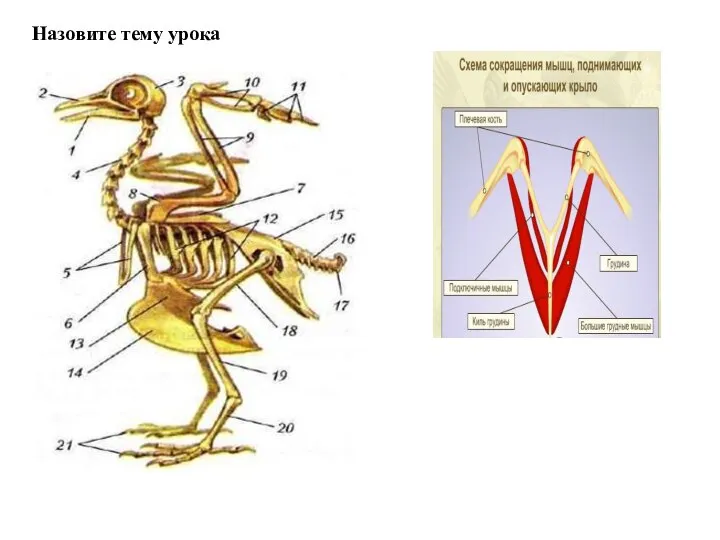 Опорно-двигательная система птиц
Опорно-двигательная система птиц Определение химических свойств пигментов листьев
Определение химических свойств пигментов листьев Микробиология как наука, предмет ее изучения, исторические этапы развития, задачи медицинской микробиологии
Микробиология как наука, предмет ее изучения, исторические этапы развития, задачи медицинской микробиологии lektsia_4_Molekulyarnaya_genetika (1)
lektsia_4_Molekulyarnaya_genetika (1) Коневодство. Искусственный отбор
Коневодство. Искусственный отбор Новейшие данные об участии генов и генетических ансамблей в морфогенезах
Новейшие данные об участии генов и генетических ансамблей в морфогенезах Органические вещества клетки. Углеводы. 4 часть, 10 класс
Органические вещества клетки. Углеводы. 4 часть, 10 класс Кто такие звери
Кто такие звери Периферическая нервная система. Черепные нервы человека
Периферическая нервная система. Черепные нервы человека Фотосинтез
Фотосинтез Игра Зимующие птицы нашего края
Игра Зимующие птицы нашего края Ядовитые растения
Ядовитые растения Мова тварин
Мова тварин Жиры. Пищевые продукты
Жиры. Пищевые продукты Типы соединений костей
Типы соединений костей Тварини прісної водойми
Тварини прісної водойми Динамические показатели популяций
Динамические показатели популяций Декоративная крыса
Декоративная крыса Царство грибов
Царство грибов Фотосинтез
Фотосинтез Мир кораллового рифа
Мир кораллового рифа