Содержание
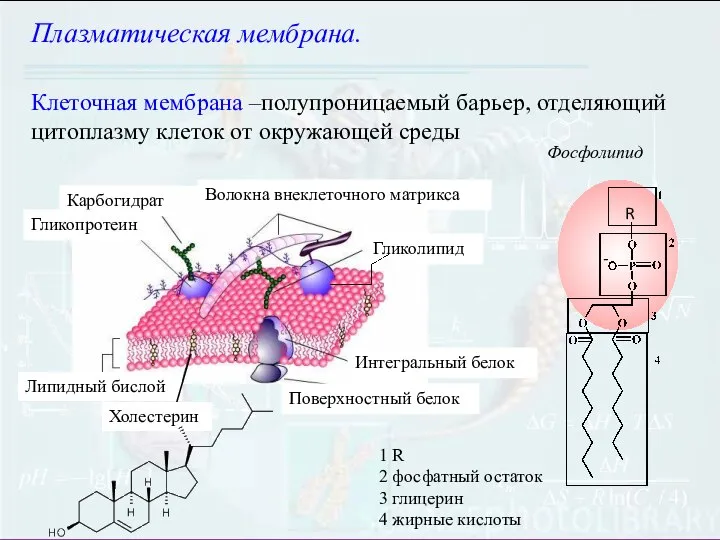
- 2. Клеточная мембрана –полупроницаемый барьер, отделяющий цитоплазму клеток от окружающей среды Плазматическая мембрана. Фосфолипид 1 R 2
- 3. Биофизика мембран. Основные задачи биофизики мембран: Строение мембран, динамические свойства мембранной структуры, определяющие ее функциональность Мембранный
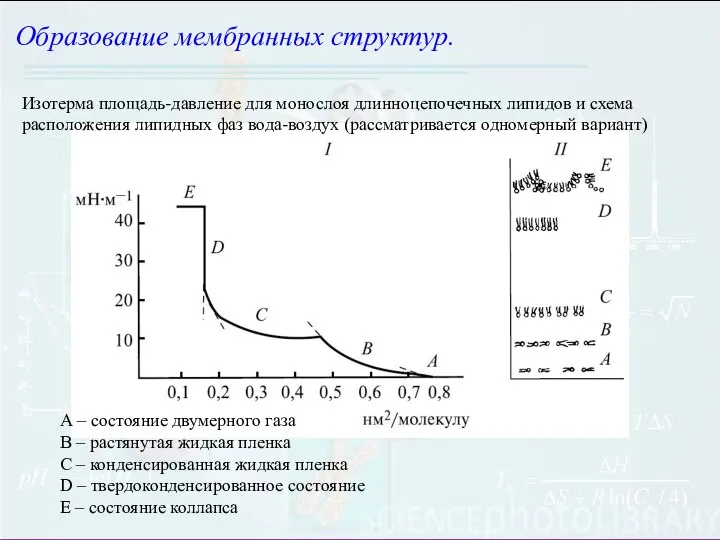
- 4. Образование мембранных структур. Изотерма площадь-давление для монослоя длинноцепочечных липидов и схема расположения липидных фаз вода-воздух (рассматривается
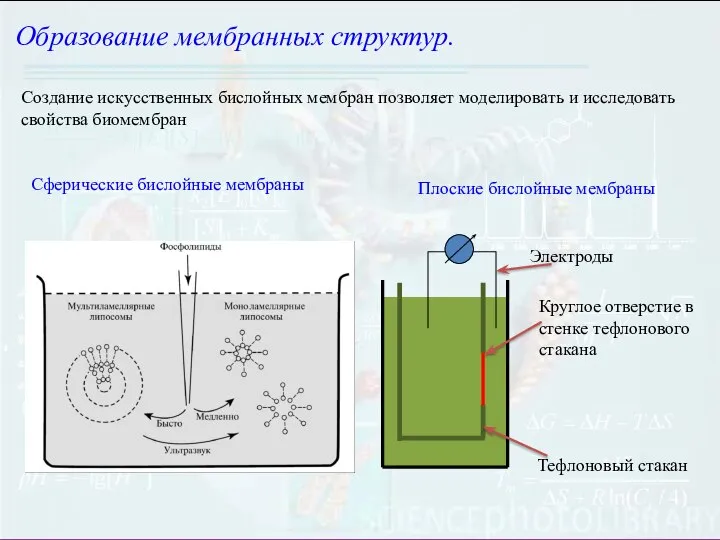
- 5. Образование мембранных структур. Создание искусственных бислойных мембран позволяет моделировать и исследовать свойства биомембран Сферические бислойные мембраны
- 6. Образование мембранных структур. Этапы формирования бислойной мембраны: 1 2 3 Толстая многослойная мембрана (~ > 100
- 7. Образование мембранных структур. Поведение различных веществ в растворах подчиняется адсорбционному уравнению Гиббса: где σ – поверхностное
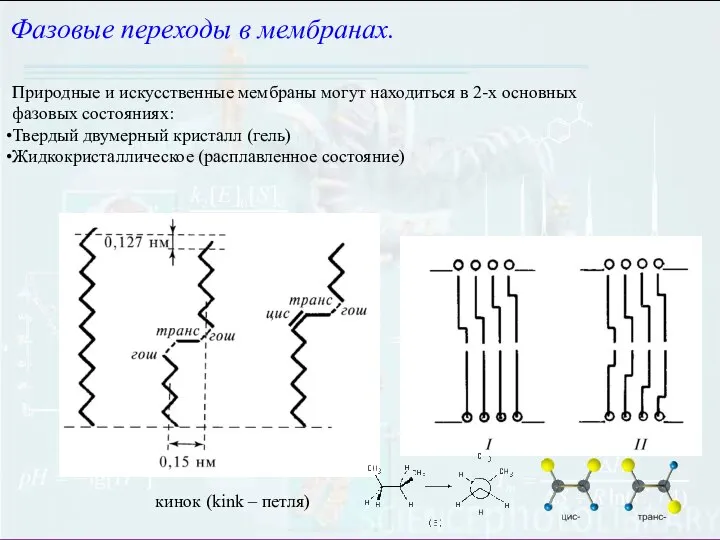
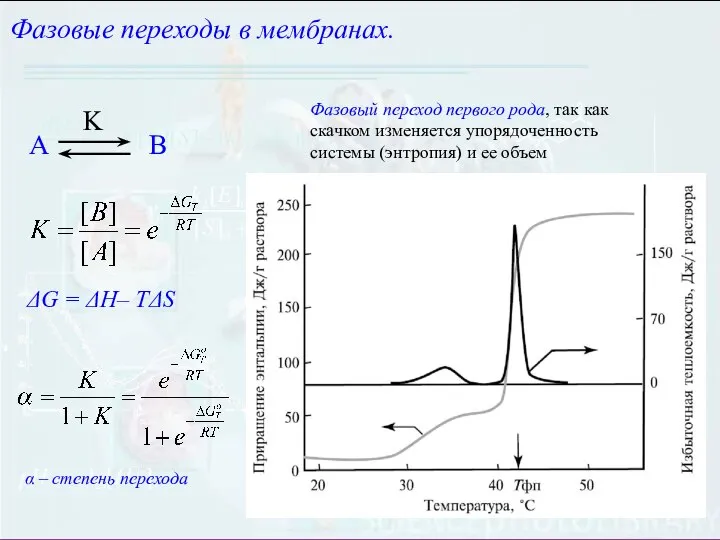
- 8. Фазовые переходы в мембранах. Природные и искусственные мембраны могут находиться в 2-х основных фазовых состояниях: Твердый
- 9. ΔG = ΔH– TΔS Фазовые переходы в мембранах. Фазовый переход первого рода, так как скачком изменяется
- 10. Кооперативность фазовых переходов в мембранах. Для оценки степени кооперативности сравнивают изменение внутренней энергии (ΔH) и измеряемую
- 11. Мембранный транспорт Мембранный транспорт Пассивный - транспорт веществ по градиенту концентрации, осуществляющийся за счет диффузии не
- 12. Классификация видов мембранного транспорта
- 13. Энергия пассивного транспорта создается различными градиентами: концентрационным осмотическим электрическим градиентом гидростатического давления жидкости электрохимическим (совокупность концентрационного
- 14. Диффузия – это самопроизвольный процесс проникновения вещества из области большей в область меньшей его концентрации в
- 15. Пассивный мембранный транспорт. Диффузия. Первый закон Фика: (поток вещества пропорционален градиенту концентрации) В случае стационарного потока
- 16. Уравнение Коллендера-Бернульда где С1 и С2 – концентрации вещества по разные стороны мембраны Р – коэффициент
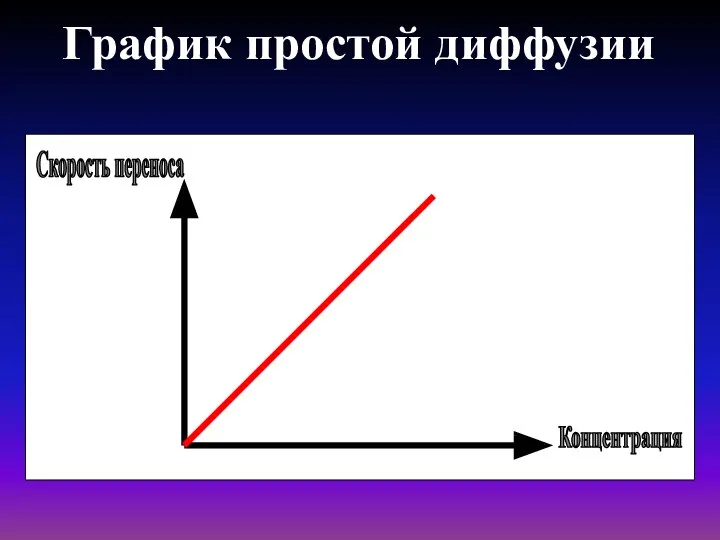
- 17. График простой диффузии Скорость переноса Концентрация
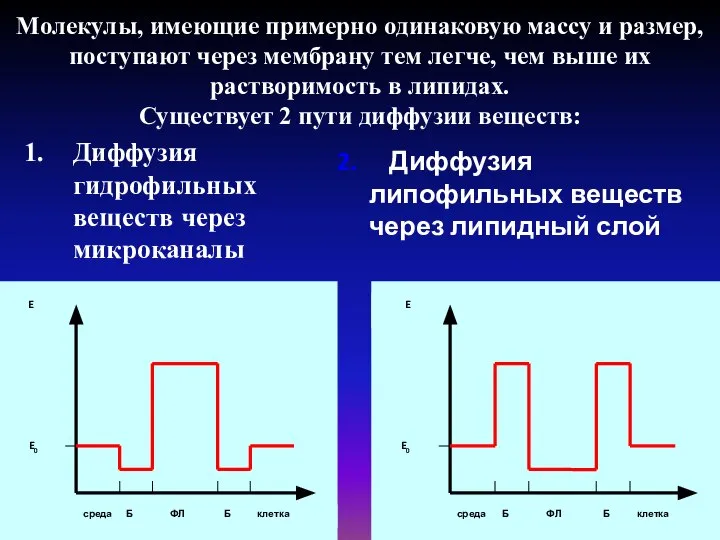
- 18. Молекулы, имеющие примерно одинаковую массу и размер, поступают через мембрану тем легче, чем выше их растворимость
- 19. В ряде случаев скорость диффузии некоторых водорастворимых веществ во много раз выше, чем скорость диффузии этих
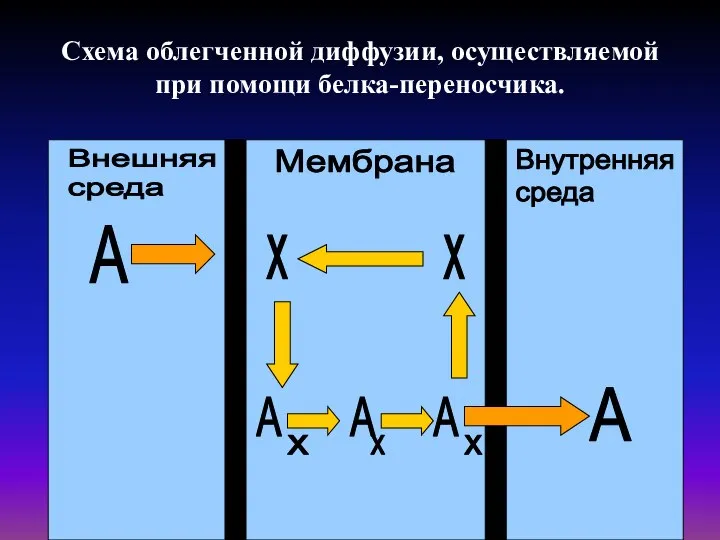
- 20. Схема облегченной диффузии, осуществляемой при помощи белка-переносчика.
- 21. Транспорт ионов. Движущей силой диффузии служит разность химических потенциалов данного вещества в двух областях. Стандартный химический
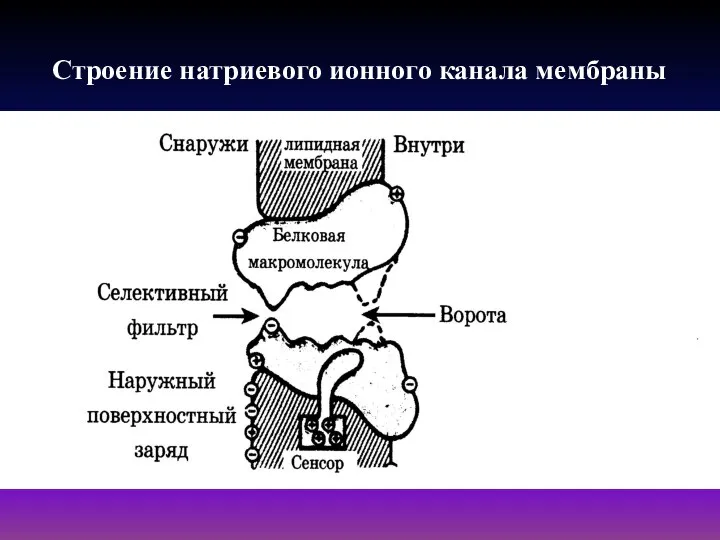
- 22. Ионные каналы биомембраны Ионные каналы биомембраны - это специализированные селективные поры, образованные белковыми молекулами, предназначенными для
- 23. Строение натриевого ионного канала мембраны
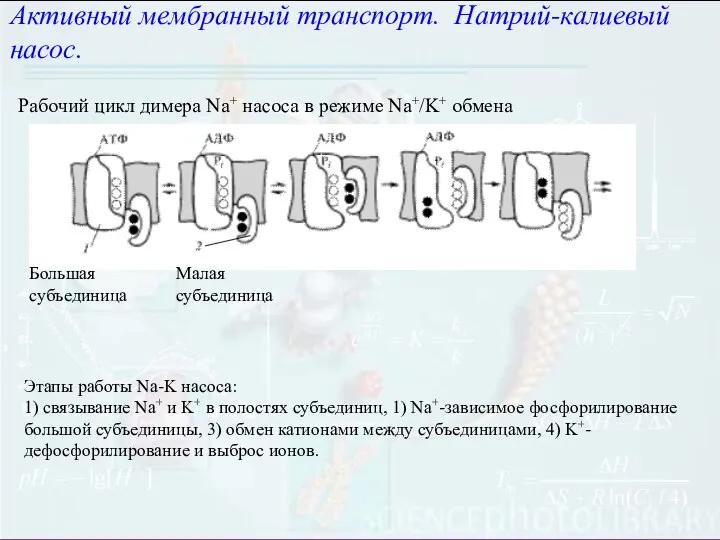
- 24. Активный мембранный транспорт. Натрий-калиевый насос. Рабочий цикл димера Na+ насоса в режиме Na+/K+ обмена Большая субъединица
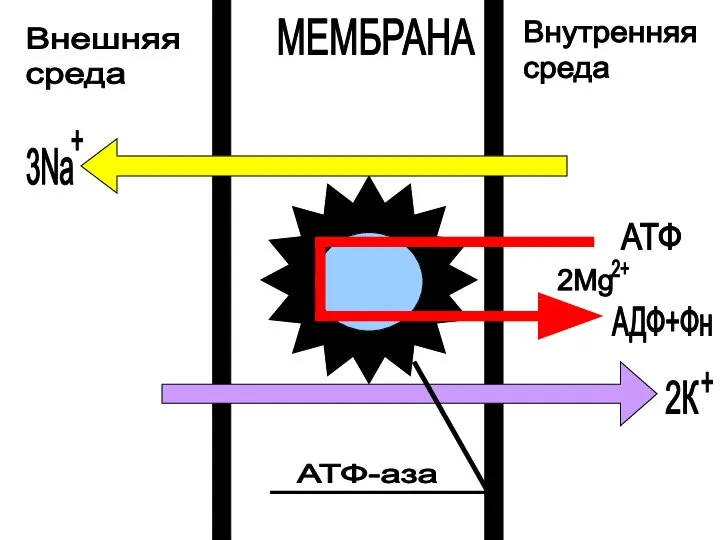
- 25. E- фермент, Х – АТФ, Z- АДФ, Y(Ф)- фосфат, i- внутренняя сторона мембраны, e – внешняя
- 26. Активный мембранный транспорт. Натрий-калиевый насос.
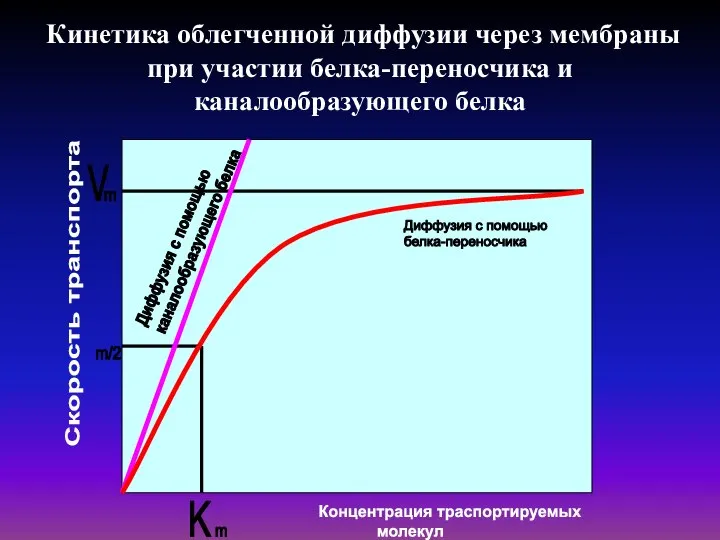
- 27. Кинетика облегченной диффузии через мембраны при участии белка-переносчика и каналообразующего белка Скорость транспорта
- 28. Ферментативный перенос описывается уравнением Михаэлиса-Ментен . Поток вещества М равен возможной максимальной скорости Vmax реакции в
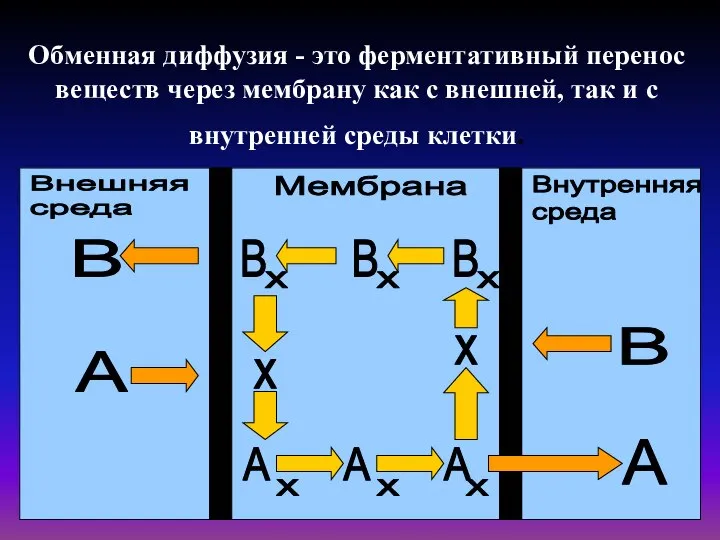
- 29. Обменная диффузия - это ферментативный перенос веществ через мембрану как с внешней, так и с внутренней
- 30. Уравнение, описывающее осмотический перенос воды. Где - количество воды, проходящей через мембрану площадью S за единицу
- 31. Где r – радиус поры l – длина поры η – вязкость жидкости Р1-Р2 – разность
- 32. Основные этапы Na+ - K+-насоса : образование комплекса фермента с АТФ на внутренней поверхности мембраны (эта
- 33. Внешняя среда Внутренняя среда МЕМБРАНА АТФ АДФ+Фн 2К + 3Na + 2Mg 2+ АТФ-аза
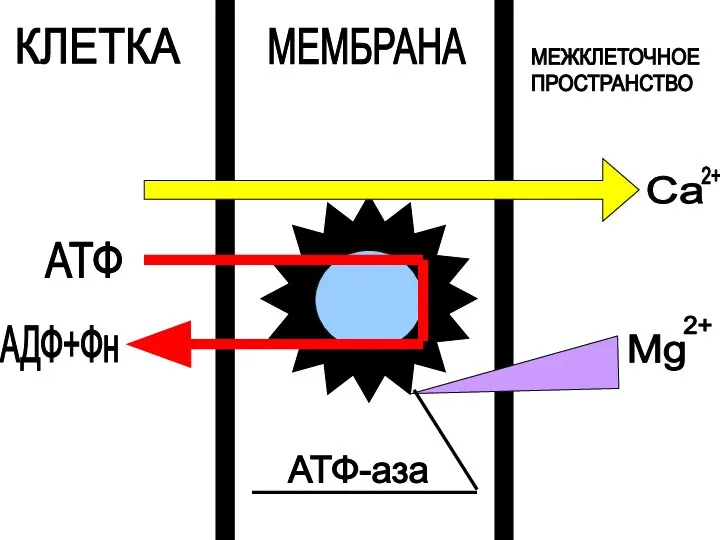
- 34. Основные этапы Са2+-насоса : Первый этап: связывание Са2+ с комплексом Mg-АТФазы на наружной поверхности саркоплазматической мембраны.
- 35. КЛЕТКА МЕМБРАНА МЕЖКЛЕТОЧНОЕ ПРОСТРАНСТВО АТФ АДФ+Фн Са 2+ Mg 2+ АТФ-аза
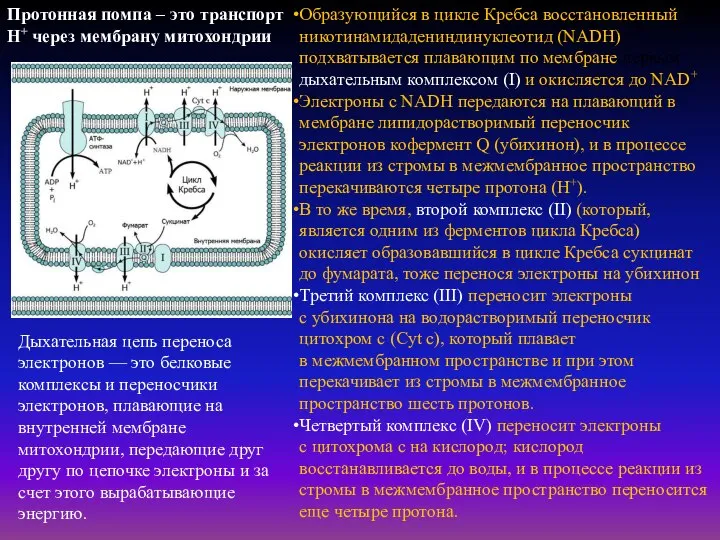
- 36. Образующийся в цикле Кребса восстановленный никотинамидадениндинуклеотид (NADH) подхватывается плавающим по мембране первым дыхательным комплексом (I) и
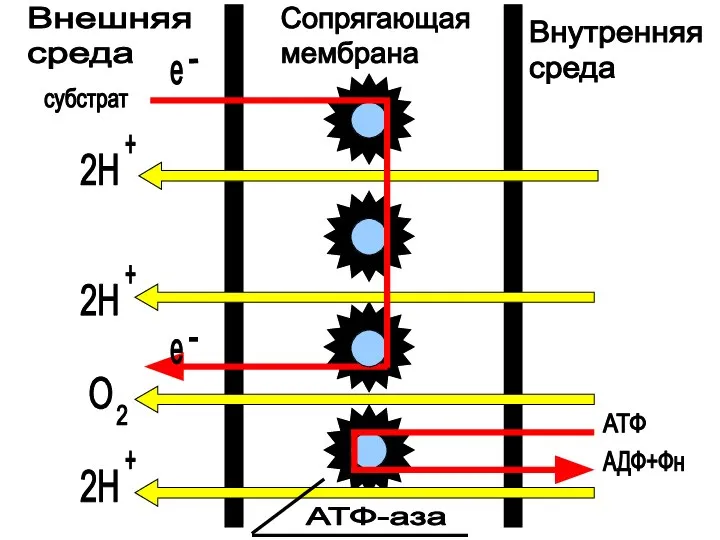
- 37. Внешняя среда Сопрягающая мембрана Внутренняя среда субстрат АТФ АДФ+Фн е е 2Н 2Н 2Н + +
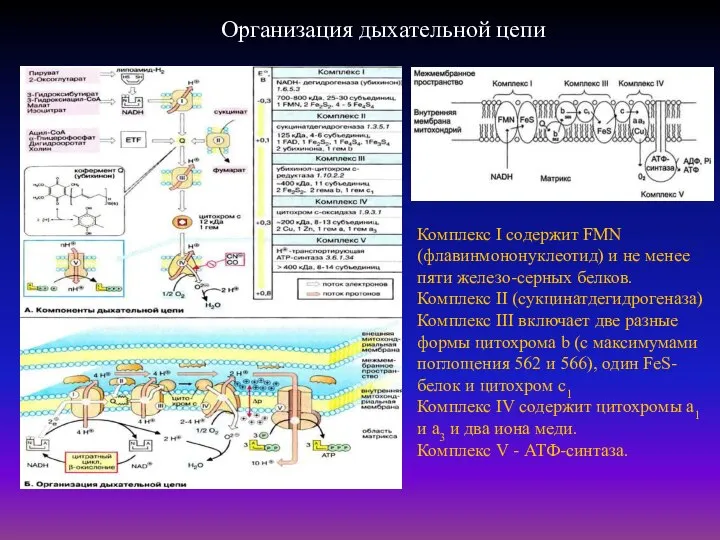
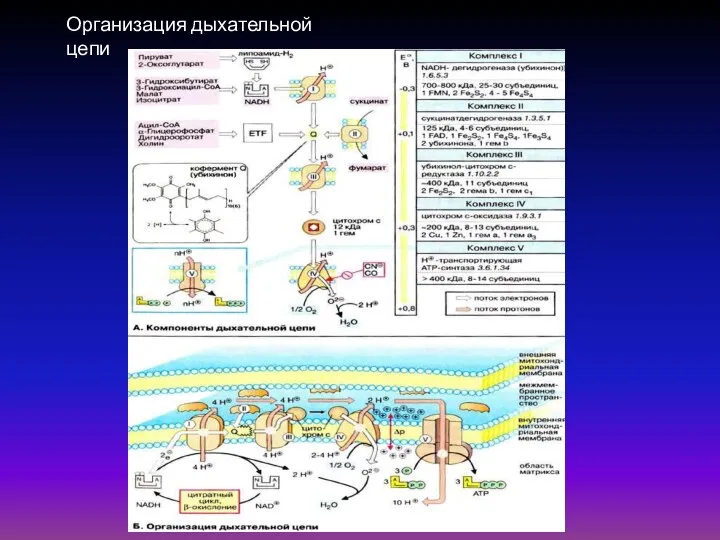
- 38. Организация дыхательной цепи Комплекс I содержит FMN (флавинмононуклеотид) и не менее пяти железо-серных белков. Комплекс II
- 39. Организация дыхательной цепи
- 40. Физические основы преобразования и аккумуляции энергии в биологических системах Таблица 1. Компоненты дыхательной цепи В дыхательной
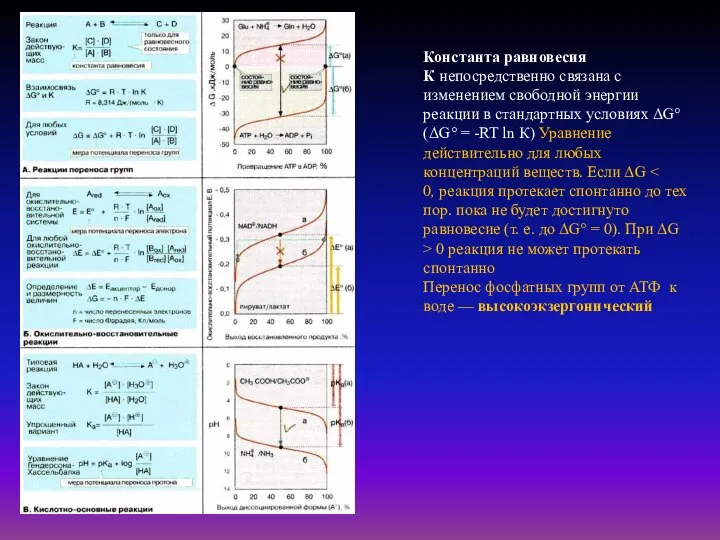
- 41. Константа равновесия К непосредственно связана с изменением свободной энергии реакции в стандартных условиях ΔG° (ΔG° =
- 42. Причины высоко экзоэргического характера гидролиза АТФ: сильное отталкивание отрицательно заряженных атомов кислорода, которое ослабевает при гидролитическом
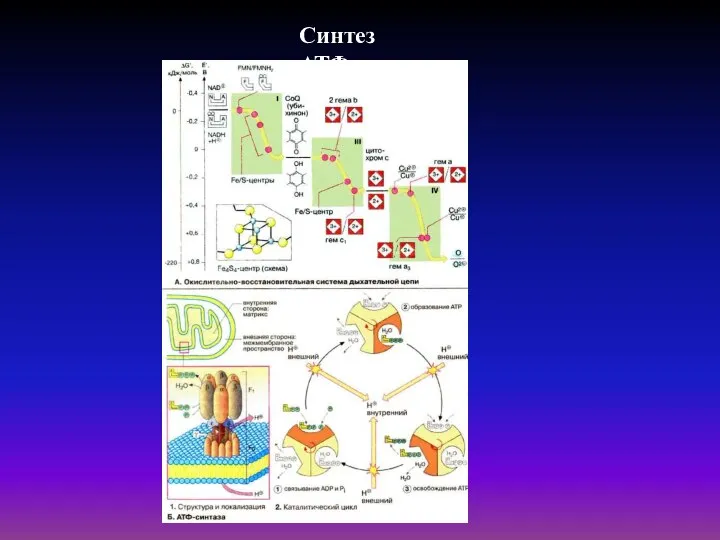
- 43. Механизм синтеза АТФ АТФ-синтаза состоит из двух частей: встроенного в мембрану протонного канала и каталитической белковой
- 44. Синтез АТФ
- 45. Митохондрии, перенос электронов Митохондриальная цепь переноса электронов. Комплекс I содержит FMN и не менее пяти железо-серных
- 46. Направление процесса и сопряженные реакции Направление химической реакции определяется значением ΔG. Если эта величина отрицательна, то
- 47. Механизмы, обеспечивающие протекание сопряженных реакций. Реакция фосфорилирования глюкозы свободным фосфатом с образованием глюкозо-6-фосфата является эндергонической: (1)
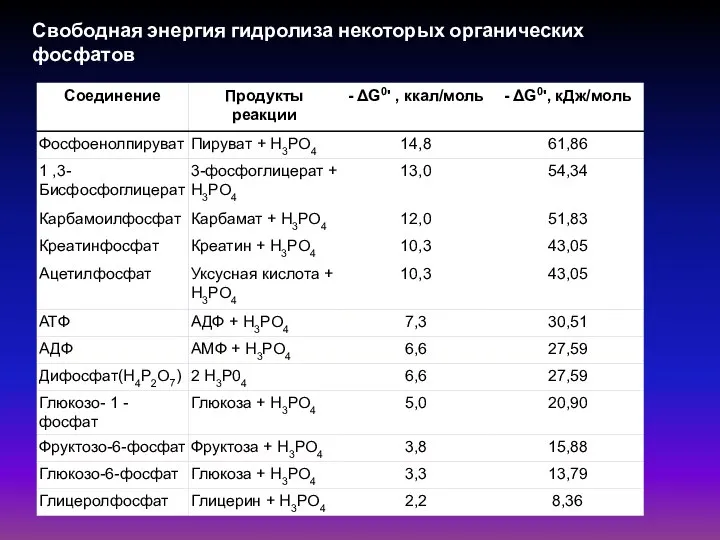
- 48. Свободная энергия гидролиза некоторых органических фосфатов
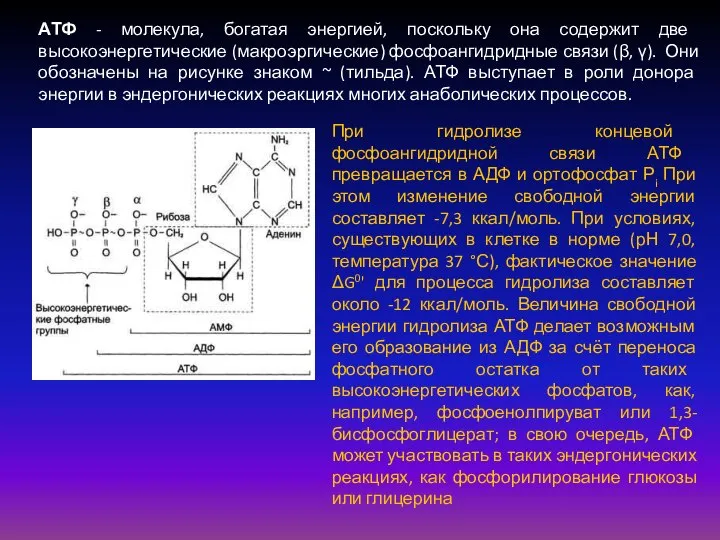
- 49. АТФ - молекула, богатая энергией, поскольку она содержит две высокоэнергетические (макроэргические) фосфоангидридные связи (β, γ). Они
- 50. Некоторые биосинтетические реакции в организме могут протекать при участии других нуклеозидтрифосфатов, аналогов АТФ; к ним относят
- 51. Биологическое окисление Под окислением понимают отщепление электронов, а под восстановлением - присоединение электронов. Окисление донора электронов
- 52. Стандартные окислительно-восстановительные потенциалы некоторых сопряжённых пар Величину Еº' выражают в вольтах; чем она меньше (отрицательнее), тем
- 54. Скачать презентацию





























 Презентация на тему СТЕБЕЛЬ
Презентация на тему СТЕБЕЛЬ  Определение окаменелостей животных
Определение окаменелостей животных Вельвичия удивительная
Вельвичия удивительная Закономерность наследственных признаков
Закономерность наследственных признаков Обмен углеводов. Глюконеогенез. Регуляция углеводного обмена
Обмен углеводов. Глюконеогенез. Регуляция углеводного обмена Общая физиология сенсорных систем. Слуховой анализатор
Общая физиология сенсорных систем. Слуховой анализатор Синдром верхнего мотонейрона. Спастичность: терминология, этиология, патогенез
Синдром верхнего мотонейрона. Спастичность: терминология, этиология, патогенез Вторичные половые признаки. Половое созревание юношей и девушек. Биологическая и социальная зрелость
Вторичные половые признаки. Половое созревание юношей и девушек. Биологическая и социальная зрелость Мхи
Мхи 2Тканини людини
2Тканини людини Презентация о здоровом питании (2) (1)
Презентация о здоровом питании (2) (1) Спинной мозг. Функции и их характеристика
Спинной мозг. Функции и их характеристика Настой крапивы для подкормки растений
Настой крапивы для подкормки растений Строение и функции цитоплазматической мембраны
Строение и функции цитоплазматической мембраны Энергетический обмен и питание
Энергетический обмен и питание Пищеварение в ротовой полости и в желудке
Пищеварение в ротовой полости и в желудке Структура и динамика популяции
Структура и динамика популяции Внешнее строение моллюсков
Внешнее строение моллюсков Презентация на тему Передвижение организмов в водной среде
Презентация на тему Передвижение организмов в водной среде  Сенсорные системы организма животных
Сенсорные системы организма животных Презентация на тему Биология - наука о жизни
Презентация на тему Биология - наука о жизни  Что такое природа
Что такое природа Bölüp çykarys sistemasy
Bölüp çykarys sistemasy Нуклеиновые кислоты
Нуклеиновые кислоты Презентация на тему Ч. Дарвин и происхождение видов
Презентация на тему Ч. Дарвин и происхождение видов  Животные Австралии. Кенгугу
Животные Австралии. Кенгугу Показатели обилия унитарных организмов
Показатели обилия унитарных организмов Уголок природы - осень
Уголок природы - осень