Содержание
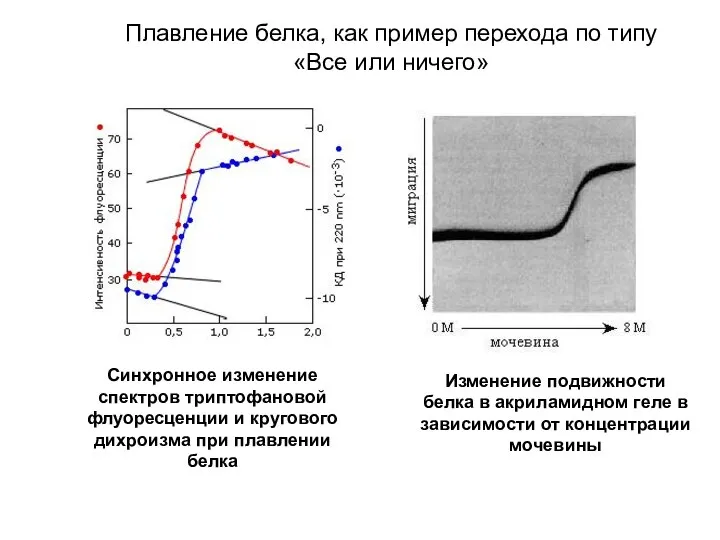
- 2. Синхронное изменение спектров триптофановой флуоресценции и кругового дихроизма при плавлении белка Изменение подвижности белка в акриламидном
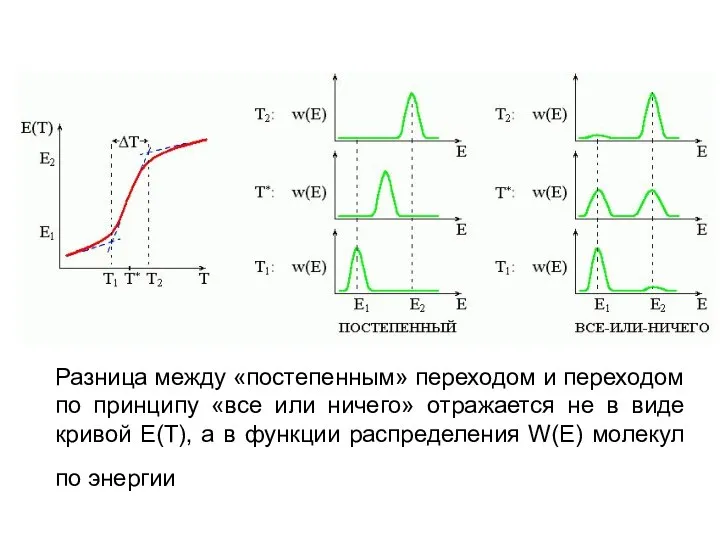
- 3. Разница между «постепенным» переходом и переходом по принципу «все или ничего» отражается не в виде кривой
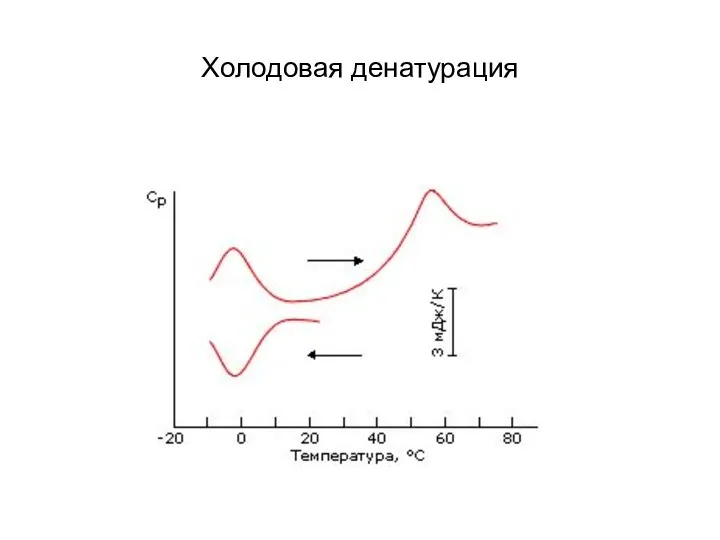
- 4. Холодовая денатурация
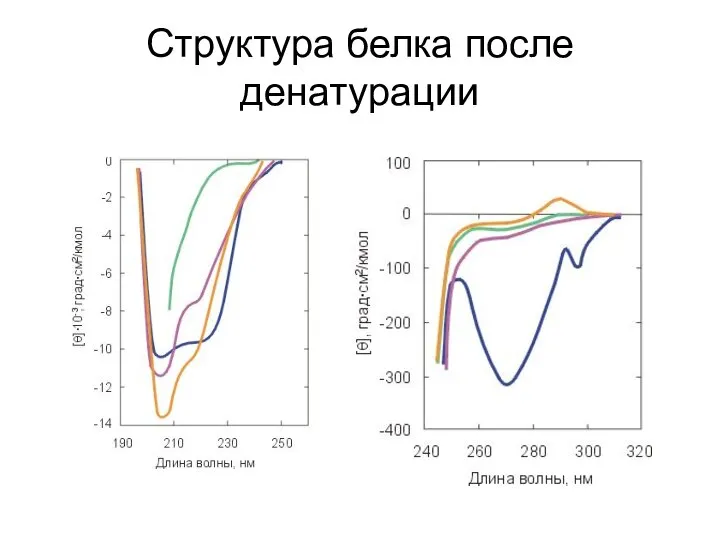
- 5. Структура белка после денатурации
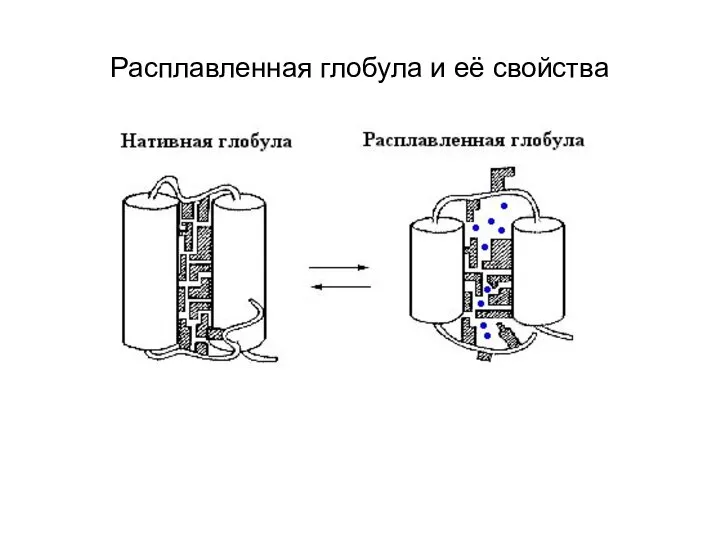
- 6. Расплавленная глобула и её свойства
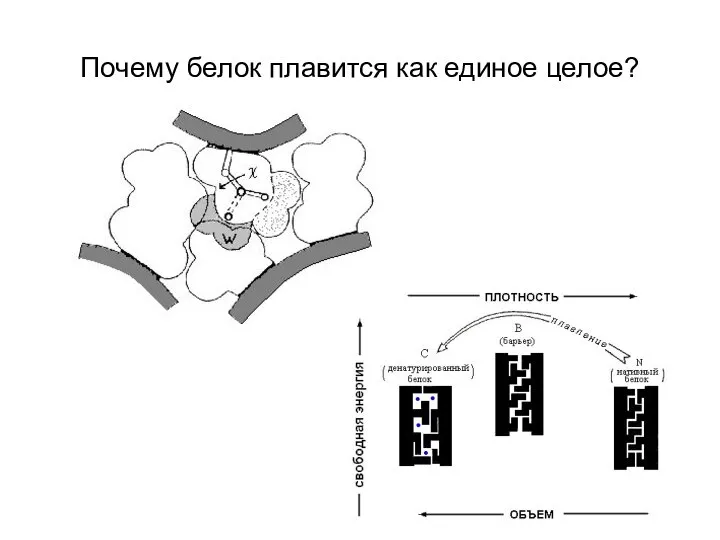
- 8. Почему белок плавится как единое целое?
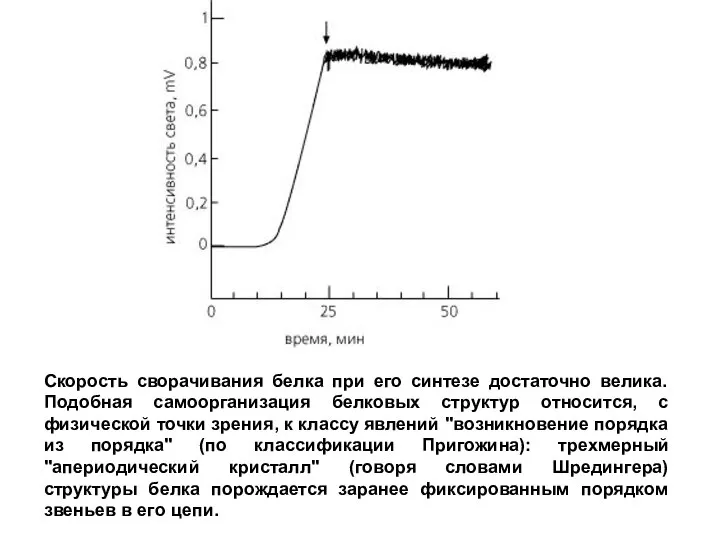
- 9. Скорость сворачивания белка при его синтезе достаточно велика. Подобная самоорганизация белковых структур относится, с физической точки
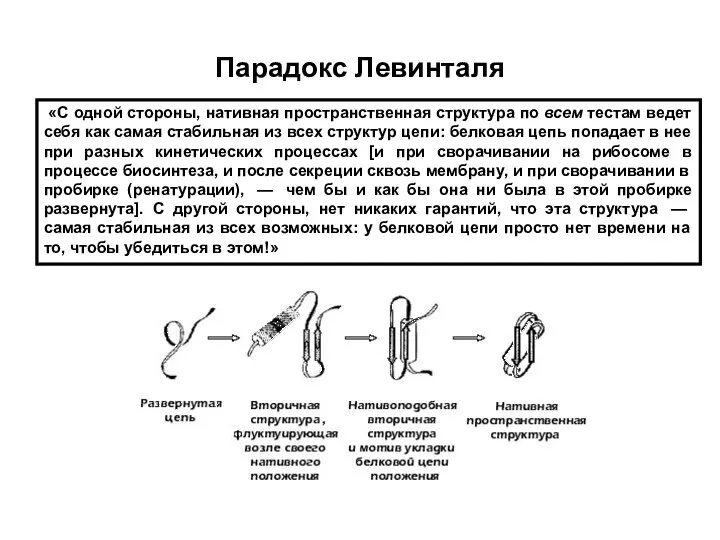
- 10. Парадокс Левинталя «С одной стороны, нативная пространственная структура по всем тестам ведет себя как самая стабильная
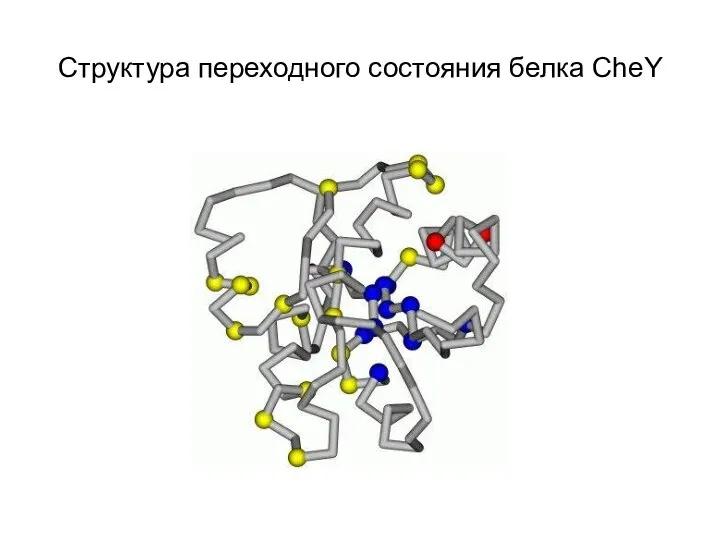
- 11. Структура переходного состояния белка CheY
- 12. Клеточная машинерия, способствующая правильному сворачиванию белка Шапероны Пролилизомераза Дисульфидизомераза
- 13. Шапероны Бывают двух типов: Фолдазы (GroEL/GroES, DnaK/DnaG) Холдазы (HsP 33) Примеры эукариотических шаперонов: GRP78/BiP, GRP94, GRP170,
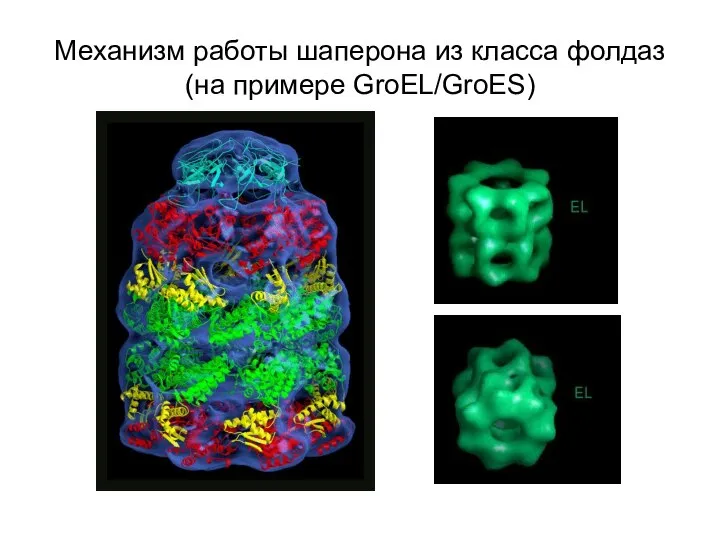
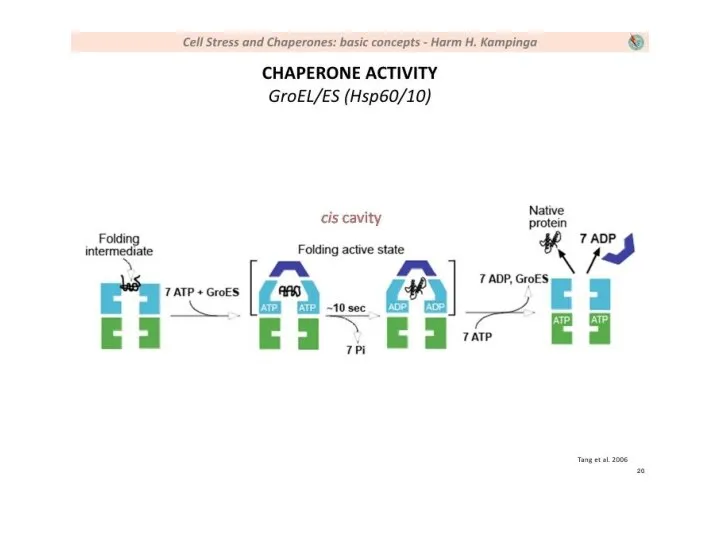
- 14. Механизм работы шаперона из класса фолдаз (на примере GroEL/GroES)
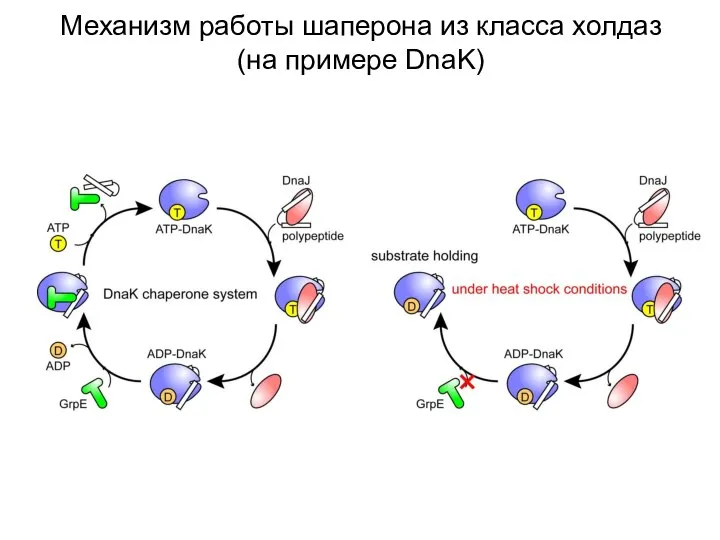
- 16. Механизм работы шаперона из класса холдаз (на примере DnaK)
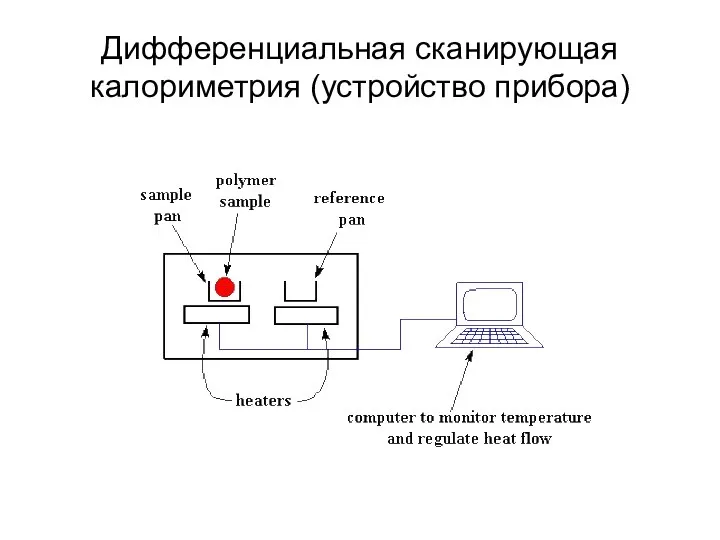
- 17. Дифференциальная сканирующая калориметрия (устройство прибора)
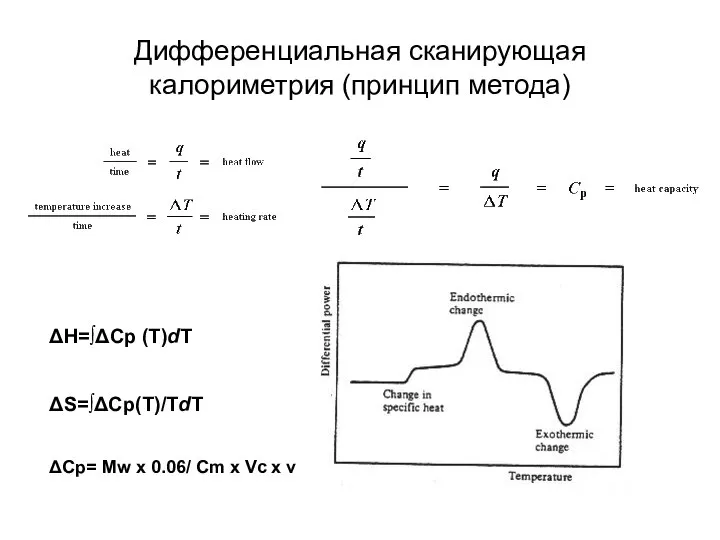
- 18. Дифференциальная сканирующая калориметрия (принцип метода) ΔH=∫ΔCp (T)dT ΔS=∫ΔCp(T)/TdT ΔCp= Mw x 0.06/ Cm x Vc x
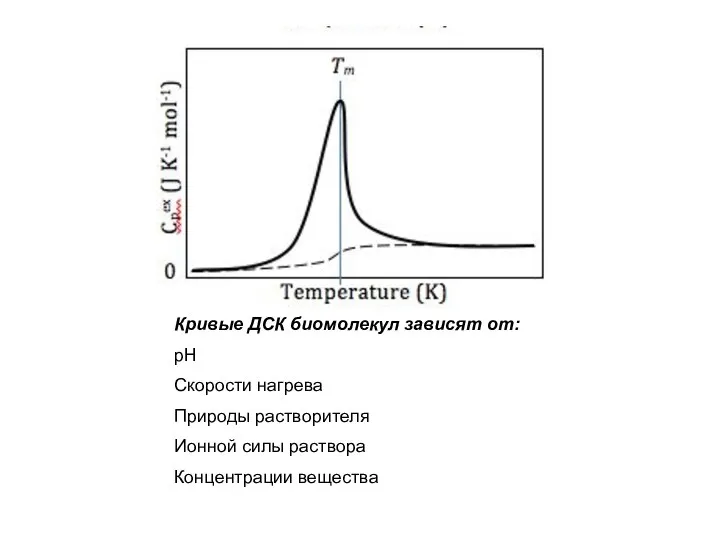
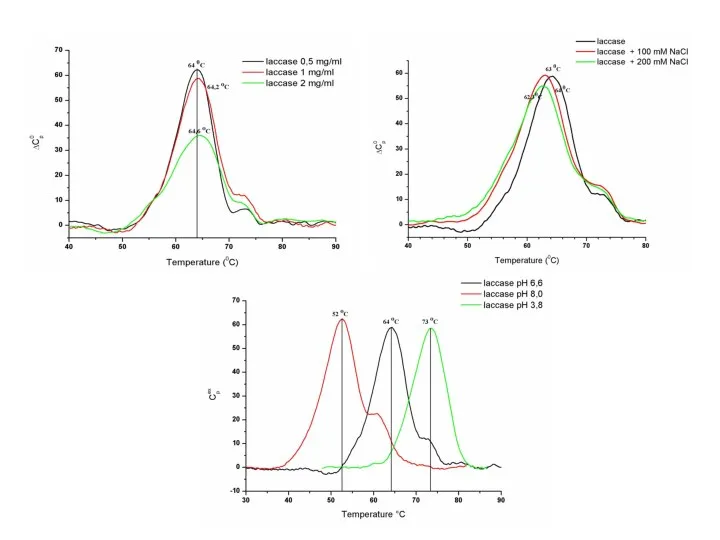
- 19. Кривые ДСК биомолекул зависят от: рН Скорости нагрева Природы растворителя Ионной силы раствора Концентрации вещества
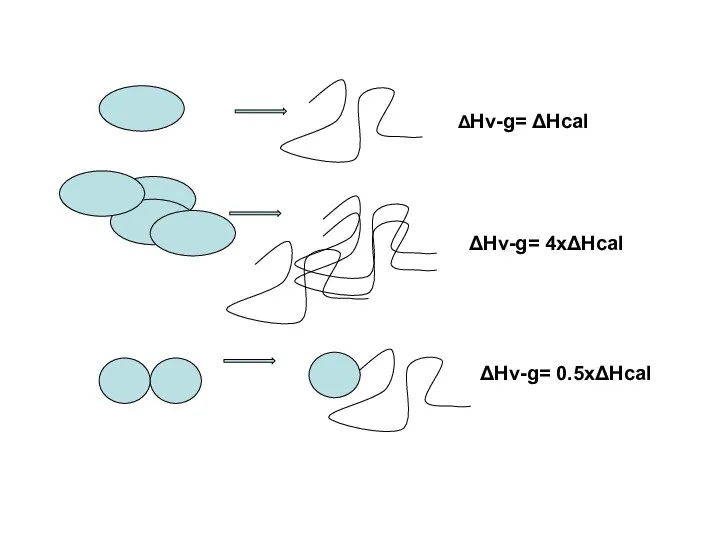
- 21. Критерий Вант-Гоффа «Эффективная теплота" перехода, вычисляемая из его ширины совпадает с "калориметрической теплотой" этого перехода, т.е.
- 22. ΔHv-g= ΔHcal
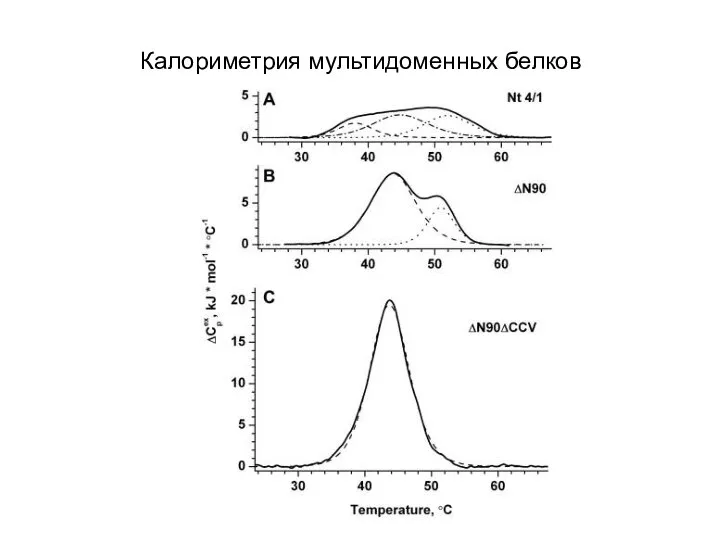
- 23. Калориметрия мультидоменных белков
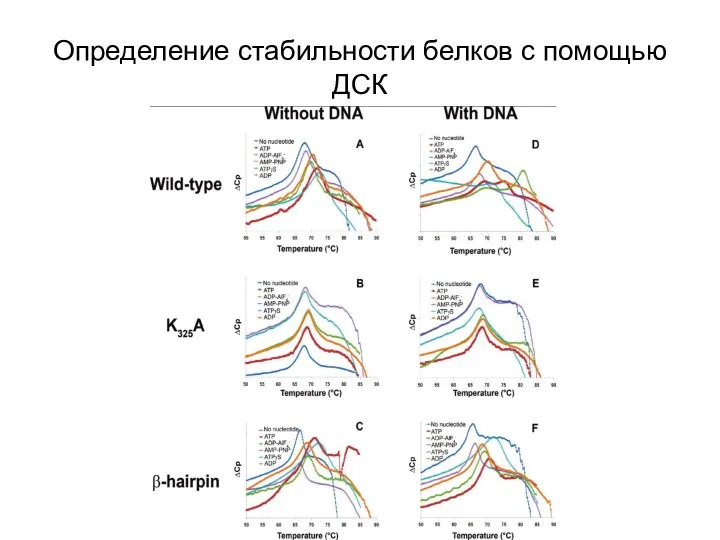
- 24. Определение стабильности белков с помощью ДСК
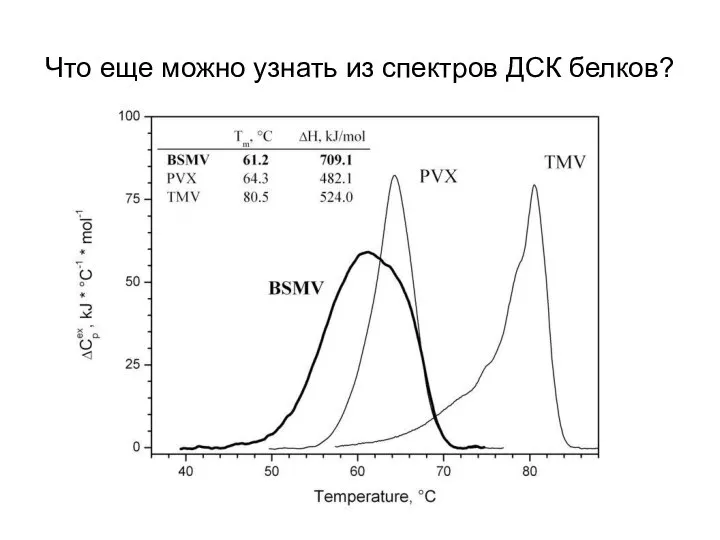
- 25. Что еще можно узнать из спектров ДСК белков?
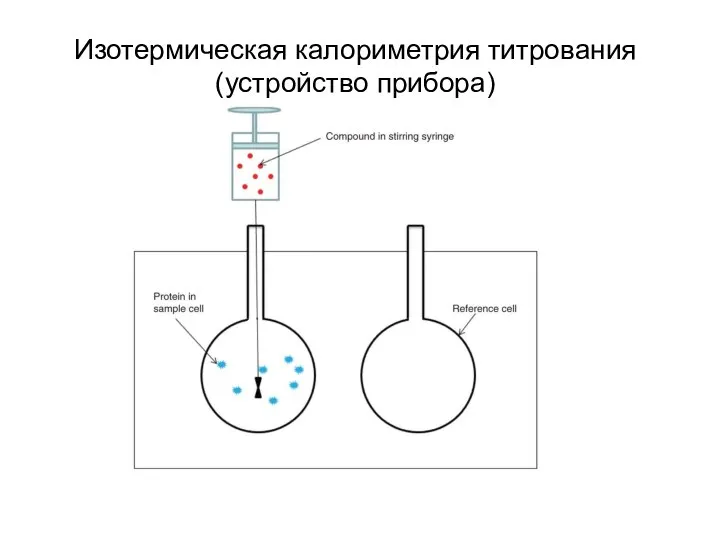
- 26. Изотермическая калориметрия титрования (устройство прибора)
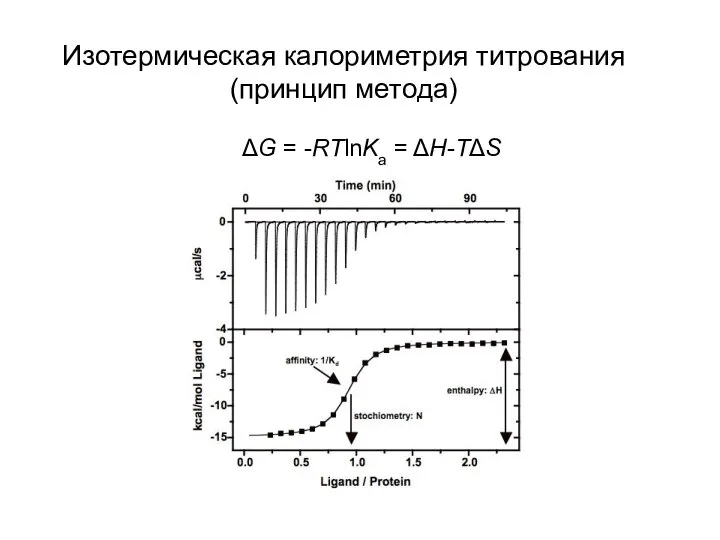
- 27. Изотермическая калориметрия титрования (принцип метода) ΔG = -RTlnKa = ΔH-TΔS
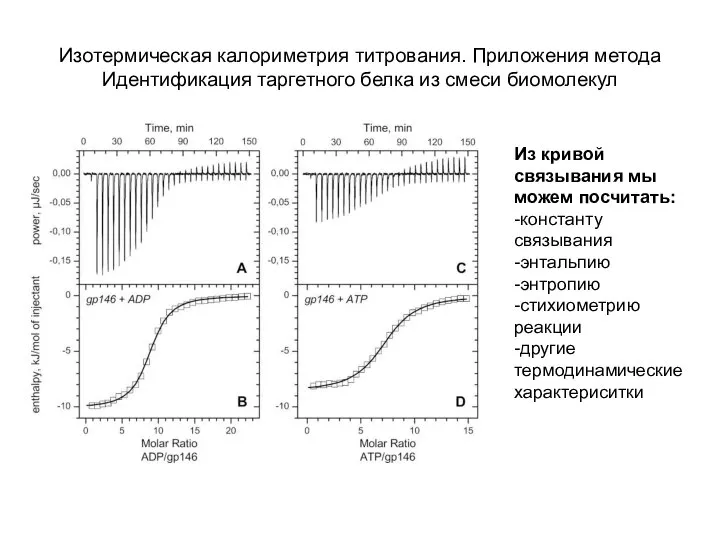
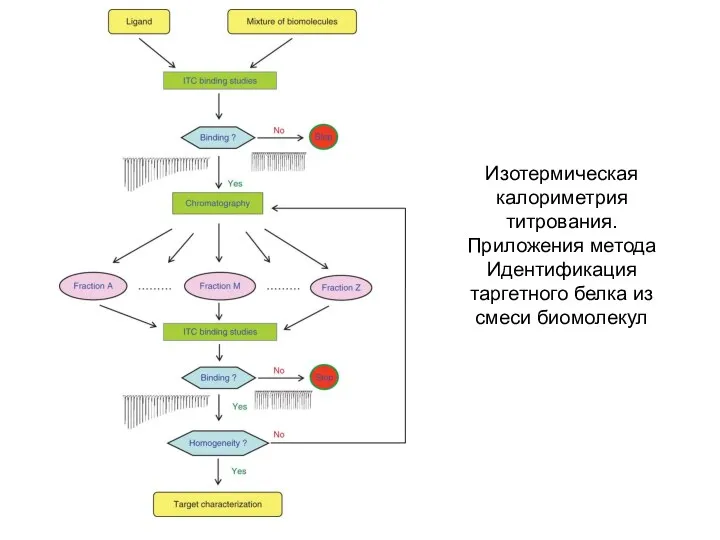
- 28. Изотермическая калориметрия титрования. Приложения метода Идентификация таргетного белка из смеси биомолекул Из кривой связывания мы можем
- 29. Изотермическая калориметрия титрования. Приложения метода Идентификация таргетного белка из смеси биомолекул
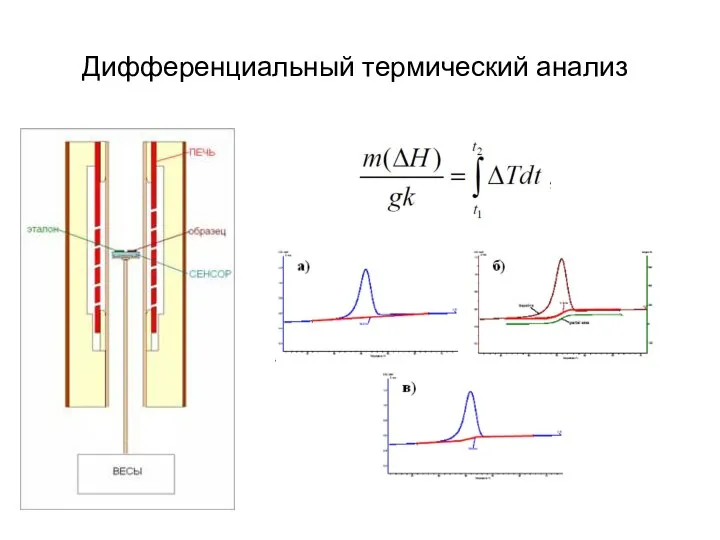
- 30. Дифференциальный термический анализ
- 32. Скачать презентацию




 Презентация на тему "Жизнь земноводных весной" - презентации по Биологии
Презентация на тему "Жизнь земноводных весной" - презентации по Биологии Западносибирский речной бобр
Западносибирский речной бобр bf9c797d6665ca36da02d2ec9ab78d9a
bf9c797d6665ca36da02d2ec9ab78d9a черепно-мозговые нервы
черепно-мозговые нервы Вид, критерии вида
Вид, критерии вида Приготовление микропрепарата кожицы чешуи лука
Приготовление микропрепарата кожицы чешуи лука Тілдің табиғаты мен қоғамдық қызметі
Тілдің табиғаты мен қоғамдық қызметі Отдел Голосеменные. Строение, развитие и значение хвойных растений
Отдел Голосеменные. Строение, развитие и значение хвойных растений Селекция (часть 1)
Селекция (часть 1) Вірус Зіка
Вірус Зіка Викторина Птицы Калужской области
Викторина Птицы Калужской области Кровоносна система
Кровоносна система Вiруси
Вiруси Цветковые растения
Цветковые растения Эпифиз – төрт төмпешіктің алдыңғы төмпешіктернінің арасында орналасқан
Эпифиз – төрт төмпешіктің алдыңғы төмпешіктернінің арасында орналасқан Строение клетки. Клеточная мембрана. Цитоплазма
Строение клетки. Клеточная мембрана. Цитоплазма Биология – наука о живой природе
Биология – наука о живой природе Принцип доминанты по А.А. Ухтомскому
Принцип доминанты по А.А. Ухтомскому 14-1 Органы чувств
14-1 Органы чувств Надкласс Рыбы
Надкласс Рыбы Насекомые. Интересные факты
Насекомые. Интересные факты Вода в клетках живых организмов
Вода в клетках живых организмов Уход за комнатными растениями
Уход за комнатными растениями Рассказы о животных
Рассказы о животных Творческое объединение Природ и фантазия
Творческое объединение Природ и фантазия Lekcija_8 (1)
Lekcija_8 (1) Молочные железы и нарушения их развития
Молочные железы и нарушения их развития Peas as an object of research
Peas as an object of research