Содержание
- 2. Аминокислоты – предшественники для синтеза, в первую оче- редь, белка, а также для синтеза других биоактивных
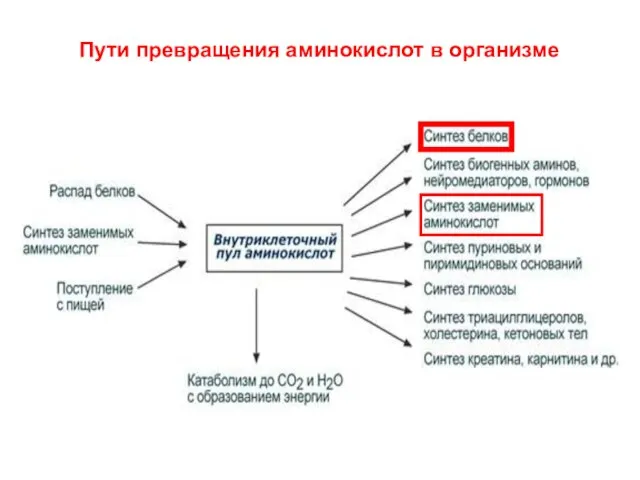
- 3. Пути превращения аминокислот в организме
- 4. Участие аминокислот в обмене Помимо участия в синтезе пептидов и белков, большинство аминокислот участвуют во многих
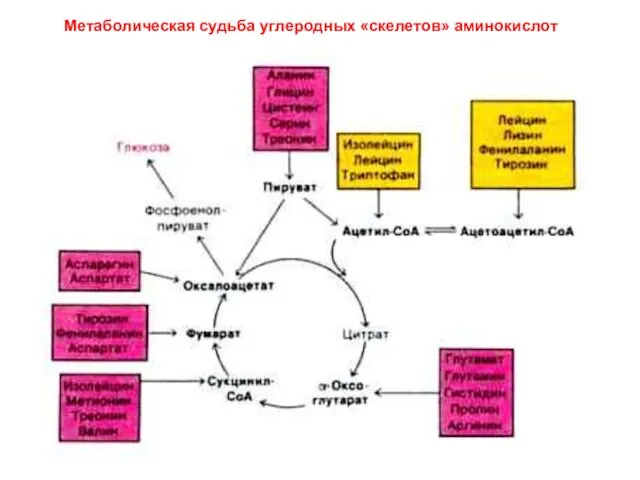
- 5. Метаболическая судьба углеродных «скелетов» аминокислот
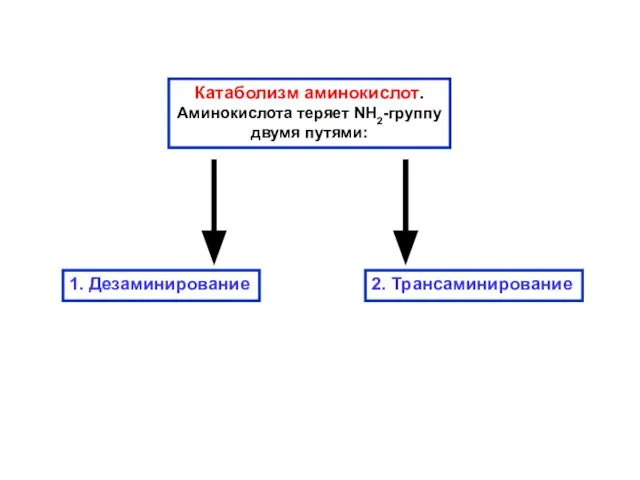
- 6. Катаболизм аминокислот. Аминокислота теряет NH2-группу двумя путями: 1. Дезаминирование 2. Трансаминирование
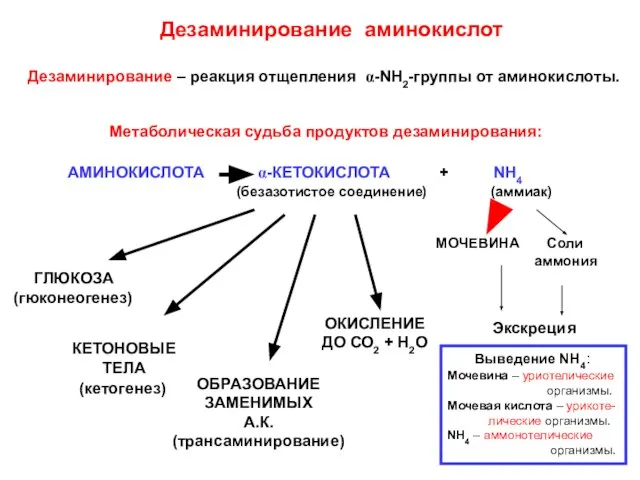
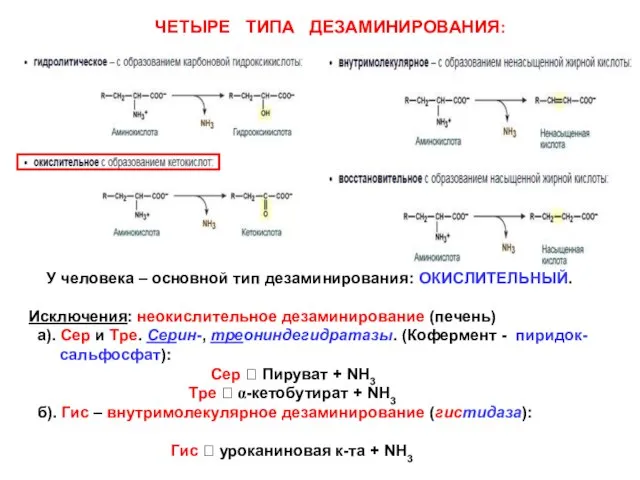
- 7. Дезаминирование аминокислот Дезаминирование – реакция отщепления α-NH2-группы от аминокислоты. АМИНОКИСЛОТА α-КЕТОКИСЛОТА + NH4 (безазотистое соединение) (аммиак)
- 8. ЧЕТЫРЕ ТИПА ДЕЗАМИНИРОВАНИЯ: У человека – основной тип дезаминирования: ОКИСЛИТЕЛЬНЫЙ. Исключения: неокислительное дезаминирование (печень) а). Сер
- 9. ОКИСЛИТЕЛЬНОЕ ДЕЗАМИНИРОВАНИЕ Реакция обратима: при повышении [NH4] идёт в обратном направле- нии – восстановительное аминирование α-КГ.
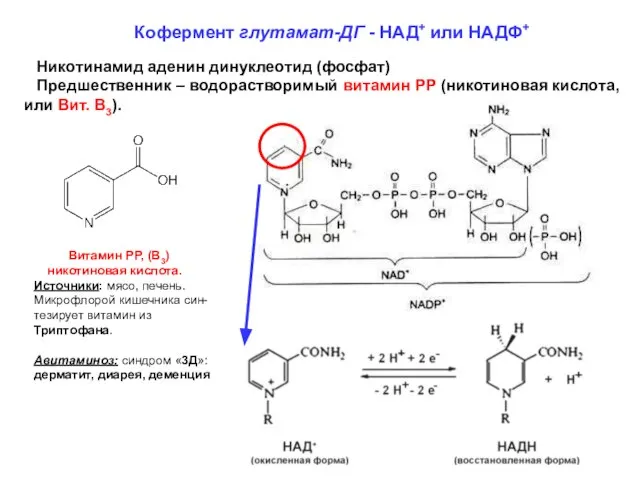
- 10. Кофермент глутамат-ДГ - НАД+ или НАДФ+ Никотинамид аденин динуклеотид (фосфат) Предшественник – водорастворимый витамин РР (никотиновая
- 11. НЕПРЯМОЕ ДЕЗАМИНИОВАНИЕ (ТРАНСДЕЗАМИНИРОВАНИЕ) Большинство аминокислот дезаминируется в две стадии: I стадия: Трансаминирование аминотрансфераза (кофермент ПФ) аминокислота
- 12. ОКСИДАЗЫ L- и D-АМИНОКИСЛОТ Оксидазы присутствуют в печени и почках – дезаминируют неко- торые аминокислоты: Оксидаза
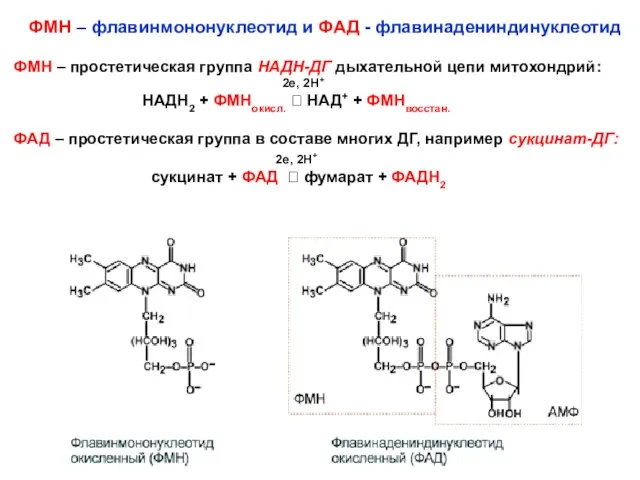
- 13. ФМН – флавинмононуклеотид и ФАД - флавинадениндинуклеотид ФМН – простетическая группа НАДН-ДГ дыхательной цепи митохондрий: 2e,
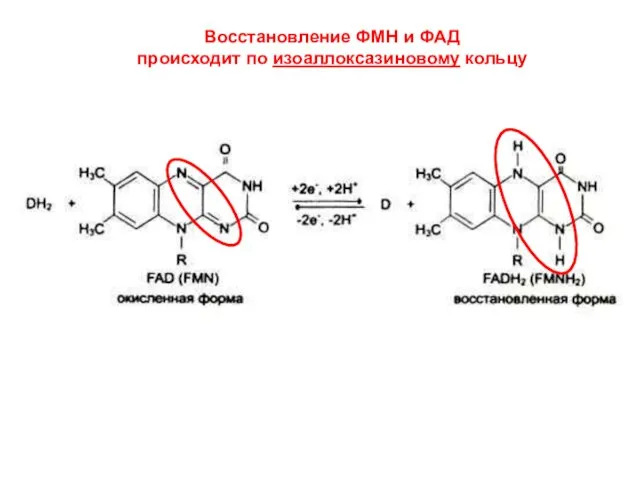
- 14. Восстановление ФМН и ФАД происходит по изоаллоксазиновому кольцу
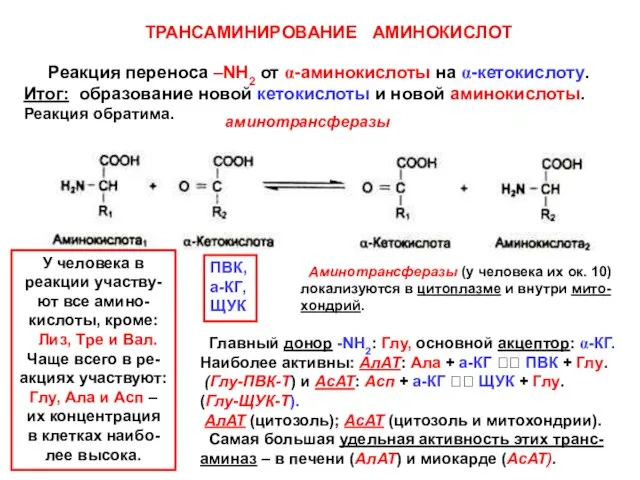
- 15. ТРАНСАМИНИРОВАНИЕ АМИНОКИСЛОТ Реакция переноса –NH2 от α-аминокислоты на α-кетокислоту. Итог: образование новой кетокислоты и новой аминокислоты.
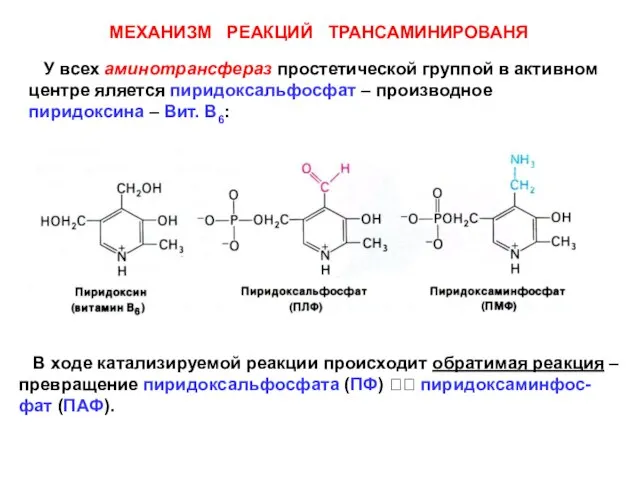
- 16. МЕХАНИЗМ РЕАКЦИЙ ТРАНСАМИНИРОВАНЯ У всех аминотрансфераз простетической группой в активном центре яляется пиридоксальфосфат – производное пиридоксина
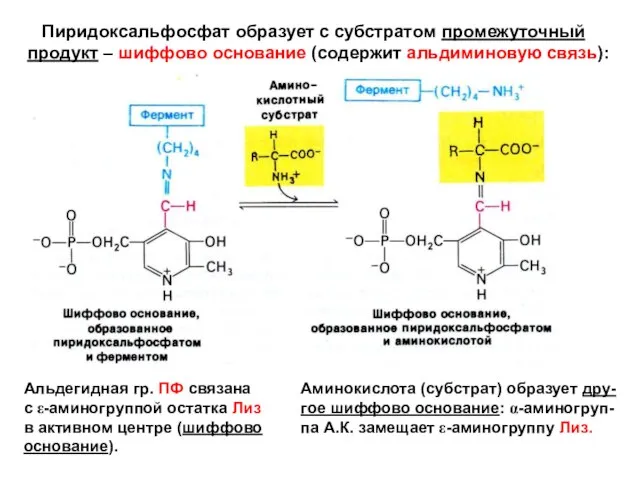
- 17. Пиридоксальфосфат образует с субстратом промежуточный продукт – шиффово основание (содержит альдиминовую связь): Альдегидная гр. ПФ связана
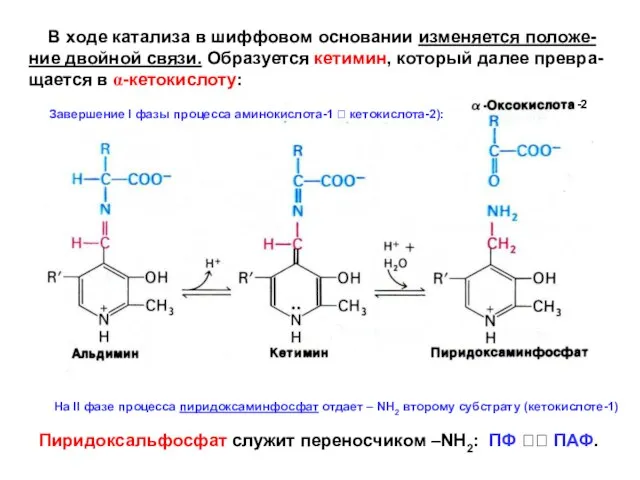
- 18. В ходе катализа в шиффовом основании изменяется положе- ние двойной связи. Образуется кетимин, который далее превра-
- 19. В результате работы аминотрансфераз азот аминогрупп многих А.К. переходит в состав аминогруппы Глу. Эти реакции проходят
- 20. ДЕКАРБОКСИЛИРОВАНИЕ АМИНОКИСЛОТ Реакция отщепления карбоксильной группы с образованем ами- нов: пиридоксальфосфат Реакции декарбоксилирования А.К., в отличие
- 22. Скачать презентацию


![ОКИСЛИТЕЛЬНОЕ ДЕЗАМИНИРОВАНИЕ Реакция обратима: при повышении [NH4] идёт в обратном направле- нии](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/905409/slide-8.jpg)




 Окружающий мир (1 класс)
Окружающий мир (1 класс) Udlewodlar
Udlewodlar Физиологические механизмы зрения
Физиологические механизмы зрения Полилактид. Молочная кислота
Полилактид. Молочная кислота Фотосинтез. Значение фотосинтеза
Фотосинтез. Значение фотосинтеза Наследственность и изменчивость. Сорта растений и породы животных. 8 класс
Наследственность и изменчивость. Сорта растений и породы животных. 8 класс Почвенные бактерии
Почвенные бактерии Пищеварительная система - III. Кишечник
Пищеварительная система - III. Кишечник Механизмы и роль внимания в поведении. (Лекция 6)
Механизмы и роль внимания в поведении. (Лекция 6) Признаки животных
Признаки животных Становление эндокринного аппарата в онтогенезе
Становление эндокринного аппарата в онтогенезе Ферменты. Механизм работы фермента
Ферменты. Механизм работы фермента Презентация на тему Генетические опыты Менделя (9 класс)
Презентация на тему Генетические опыты Менделя (9 класс)  § 49. Человек как житель биосферы и его влияние на природу Земли 9 класс биология
§ 49. Человек как житель биосферы и его влияние на природу Земли 9 класс биология Развитие жизни на Земле. 9 класс
Развитие жизни на Земле. 9 класс В царстве грибов
В царстве грибов Цитология. Не мембранные органеллы
Цитология. Не мембранные органеллы Метаболизм и питание микроорганизмов
Метаболизм и питание микроорганизмов Генетические и химические основы наследственности и формы изменчивости микроорганизмов
Генетические и химические основы наследственности и формы изменчивости микроорганизмов Мышцы груди и живота
Мышцы груди и живота Презентация на тему Как устроен организм человека
Презентация на тему Как устроен организм человека  Презентация на тему Тип инфузории
Презентация на тему Тип инфузории  14-1 Органы чувств
14-1 Органы чувств Праздник у Фифы
Праздник у Фифы Пищеварительная система. (Лекция 8)
Пищеварительная система. (Лекция 8) Презентация на тему Осанка человека
Презентация на тему Осанка человека  Презентация на тему История представлений о развитии жизни на Земле
Презентация на тему История представлений о развитии жизни на Земле  Продуктивность сообщества. Сукцессии
Продуктивность сообщества. Сукцессии