Содержание
- 2. Клеточная организация ферментативной активности Ферменты располагаются в субклеточных структурах (органеллах) соответственно их функциям. Например: а) в
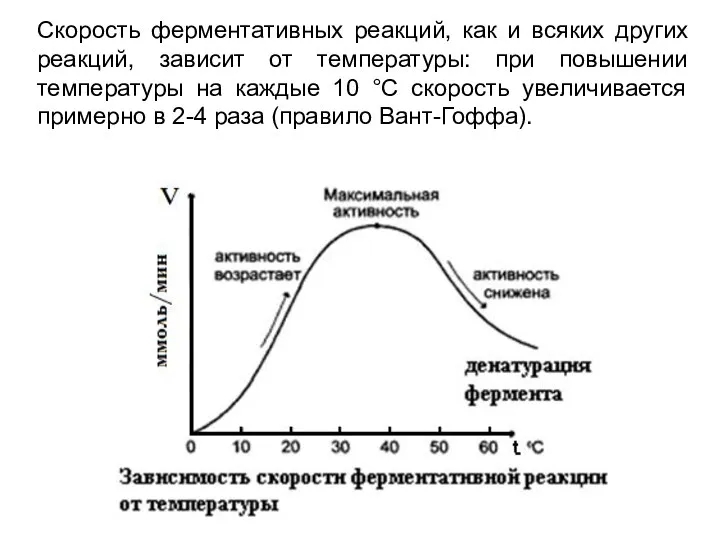
- 3. Скорость ферментативных реакций, как и всяких других реакций, зависит от температуры: при повышении температуры на каждые
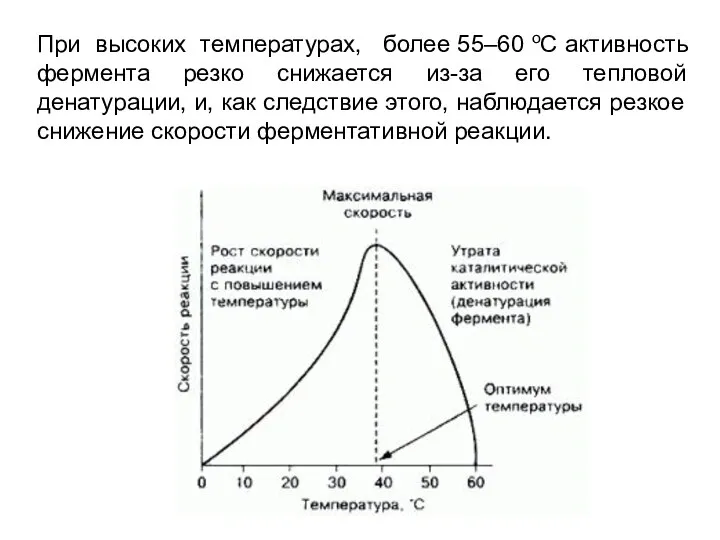
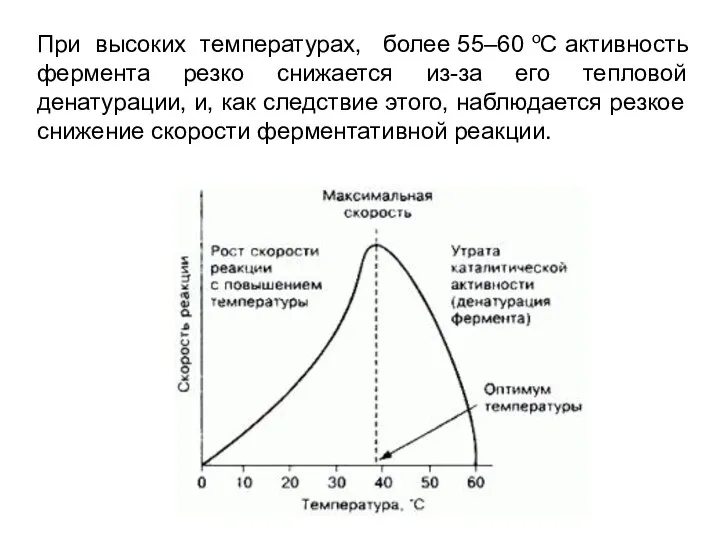
- 4. При высоких температурах, более 55–60 оС активность фермента резко снижается из-за его тепловой денатурации, и, как
- 5. При высоких температурах, более 55–60 оС активность фермента резко снижается из-за его тепловой денатурации, и, как
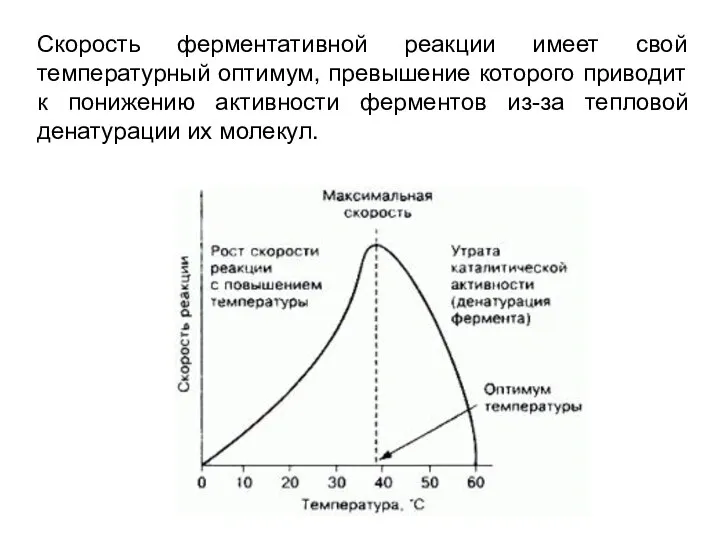
- 6. Скорость ферментативной реакции имеет свой температурный оптимум, превышение которого приводит к понижению активности ферментов из-за тепловой
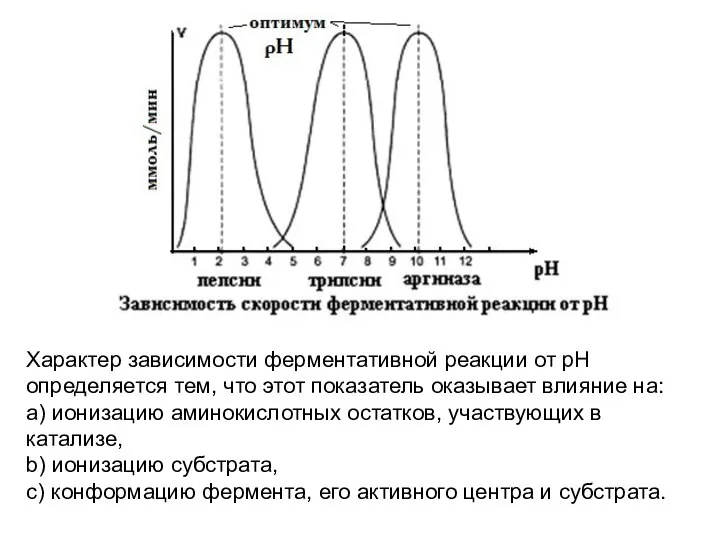
- 7. Характер зависимости ферментативной реакции от рН определяется тем, что этот показатель оказывает влияние на: a) ионизацию
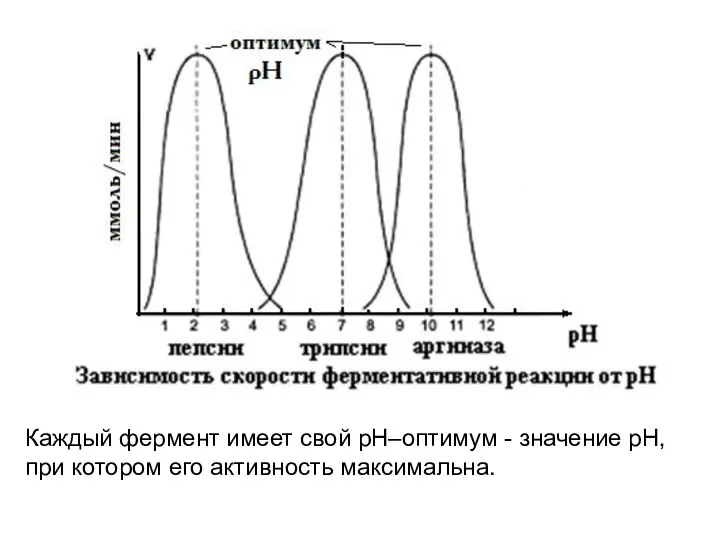
- 8. Каждый фермент имеет свой рН–оптимум - значение рН, при котором его активность максимальна.
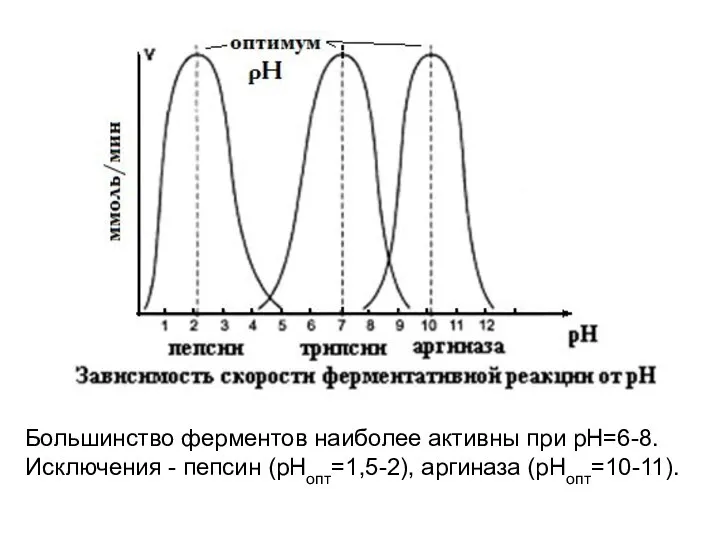
- 9. Большинство ферментов наиболее активны при рН=6-8. Исключения - пепсин (рНопт=1,5-2), аргиназа (рНопт=10-11).
- 10. Простейшая кинетическая схема взаимодействия фермента (Е) и субстрата (S). Во время реакции молекула фермента, E, и
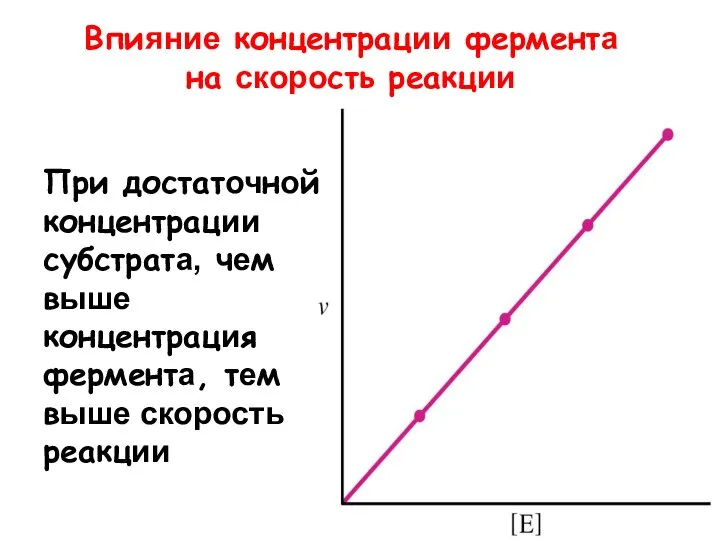
- 11. Впияние концентрации фермента на скорость реакции При достаточной концентрации субстрата, чем выше концентрация фермента, тем выше
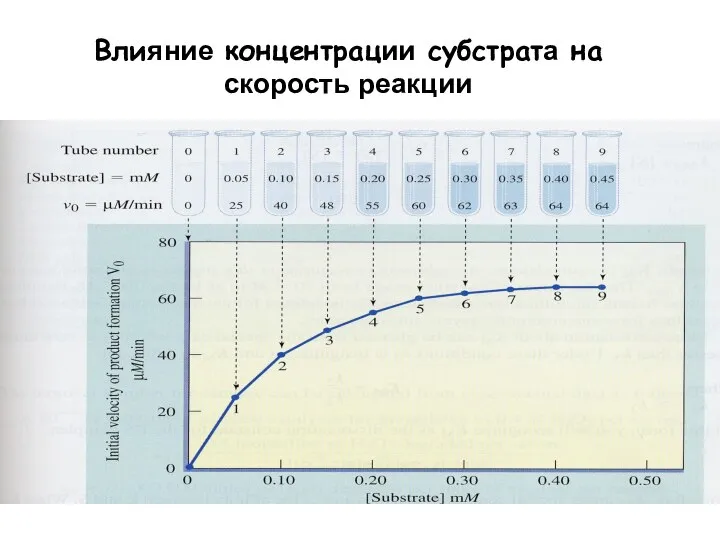
- 12. Влияние концентрации субстрата на скорость реакции
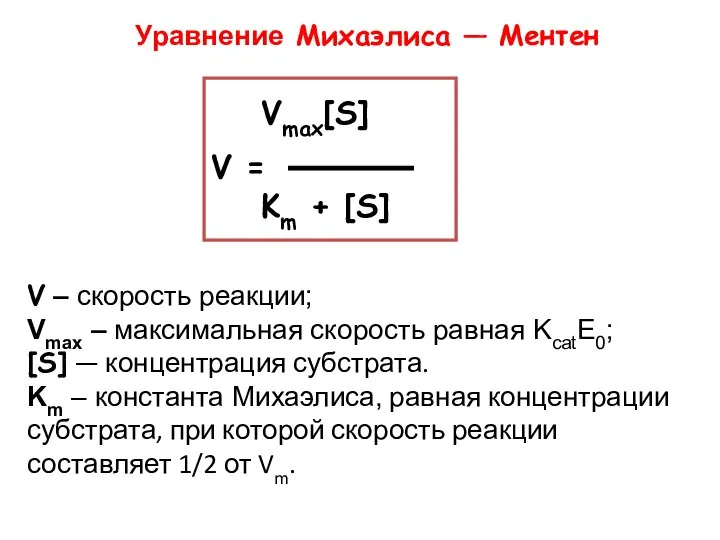
- 13. V – скорость реакции; Vmax – максимальная скорость равная KcatE0; [S] — концентрация субстрата. Km –
- 14. При фиксированной концентрации фермента начальная скорость реакции линейно пропорциональна концентрации субстрата, если последняя маленькая, но не
- 15. Уравнение Михаэлиса — Ментен V – скорость реакции; Vmax – максимальная скорость равная KcatE0; [S] —
- 16. Скорость катализа Уравнение Михаэлиса—Ментен — основное уравнение ферментативной кинетики, описывает зависимость скорости реакции, катализируемой ферментом, от
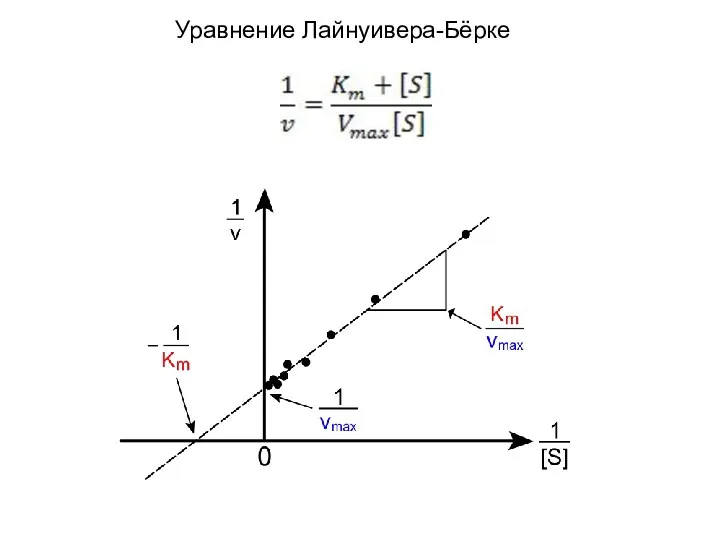
- 17. Уравнение Лайнуивера-Бёрке
- 18. Когда [S] много больше чем Km скорость реакции не зависит от [S] что соответствует нулевому порядку
- 19. Ингибирование ферментов Разные химические агенты (метаболиты, аналоги субстратов, токсины, лекарственные средства, металлы) могут ингибировать ферменты, понижая
- 20. Обратимые и необратимые ингибиторы Обратимые, с образованием EI комплекса, который быстро диссоциирует. Фермент угнетен только когда
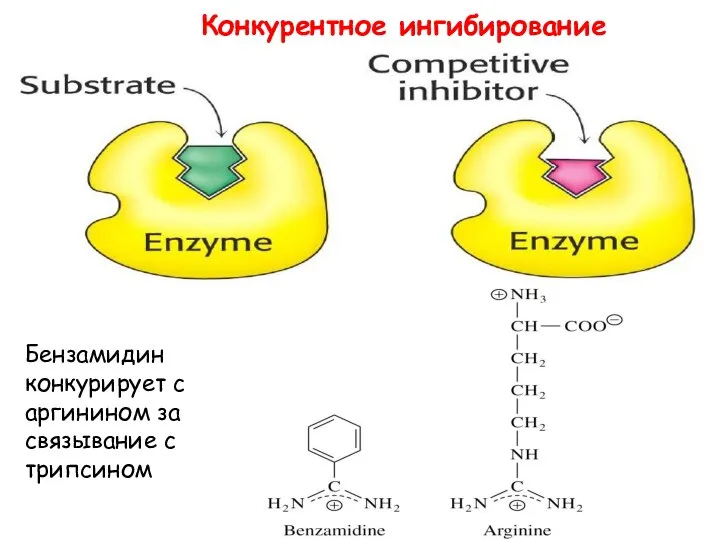
- 21. Конкурентное •Ингибитор имеет схожую с субстратом структуру, поэтому связывается с тем же активным центром •Фермент не
- 22. Конкурентное ингибирование Бензамидин конкурирует с аргинином за связывание с трипсином
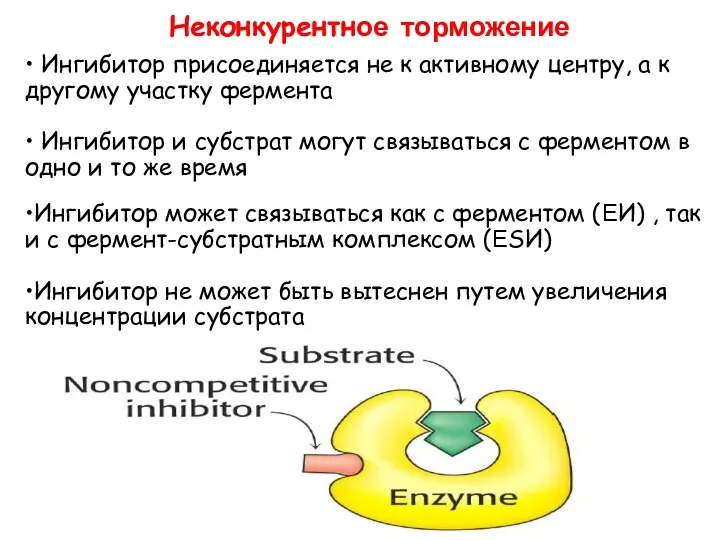
- 23. • Ингибитор присоединяется не к активному центру, а к другому участку фермента • Ингибитор и субстрат
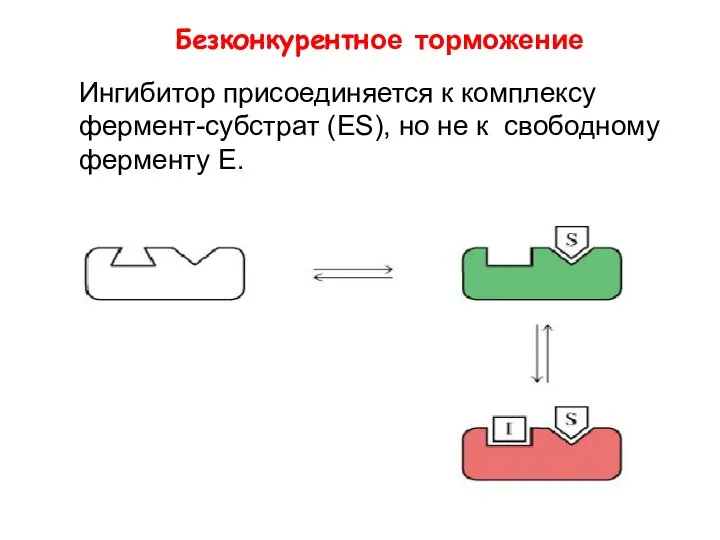
- 24. Безконкурентное торможение Ингибитор присоединяется к комплексу фермент-субстрат (ЕS), но не к свободному ферменту Е.
- 25. Необратимое ингибирование Очень медленная дисоциация комплекса EI Связываются ковалентными связями с ферментом. Необратимые ингибиторы •ингибиторы специфические
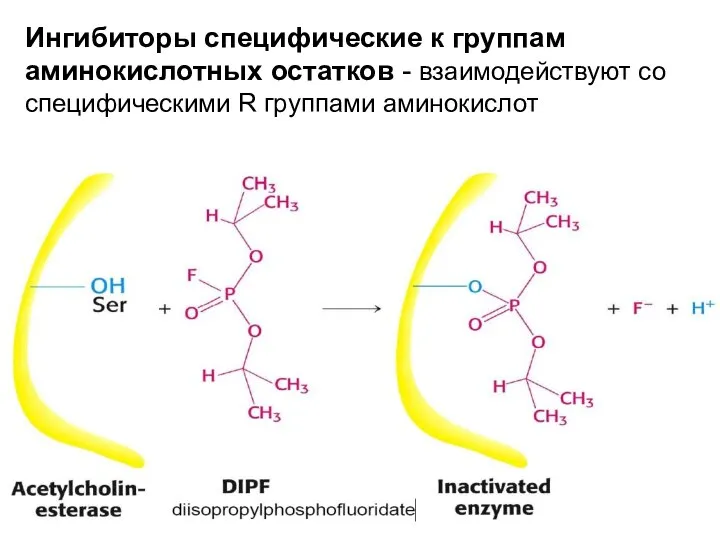
- 26. Ингибиторы специфические к группам аминокислотных остатков - взаимодействуют со специфическими R группами аминокислот
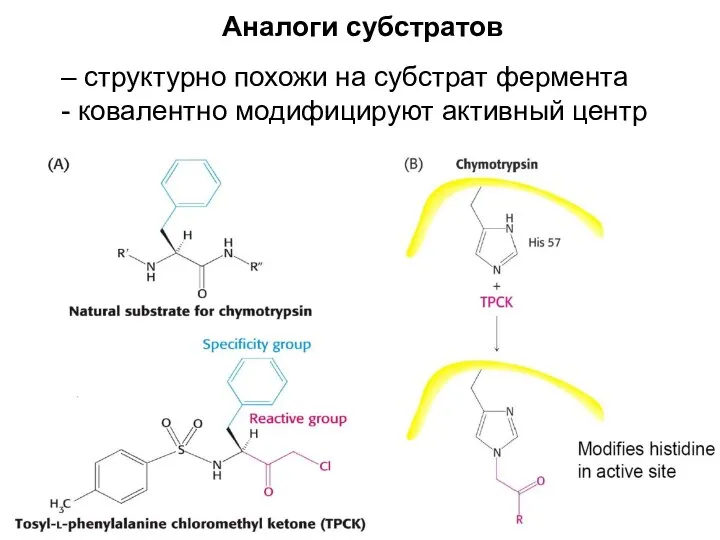
- 27. Аналоги субстратов – структурно похожи на субстрат фермента - ковалентно модифицируют активный центр
- 28. •Ингибитор связывается как субстрат и сначала инициирует нормальный каталитический механизм •Потом образуются химически реактивные соединения, которые
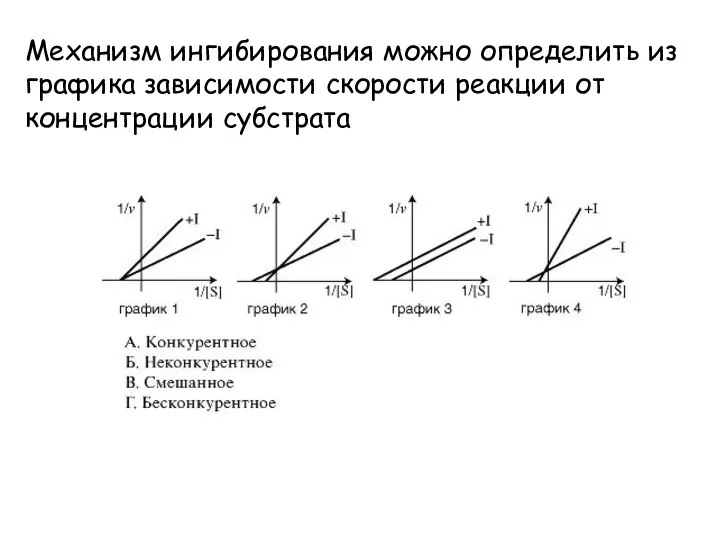
- 29. Механизм ингибирования можно определить из графика зависимости скорости реакции от концентрации субстрата
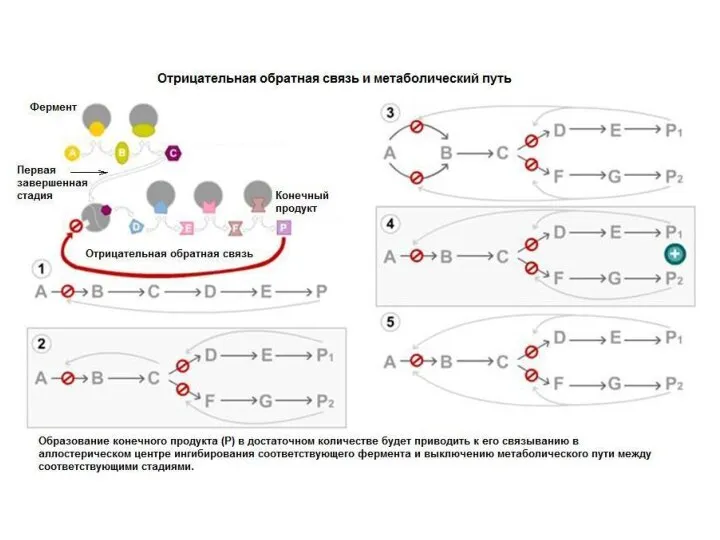
- 30. Термин «аллостерический» происходит от греческих слов allo – другой, stereo – твердый (относящийся к трехмерной структуре,
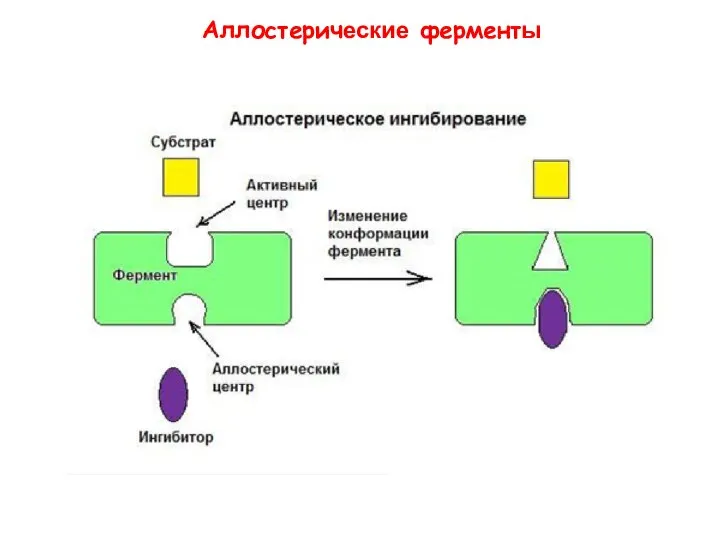
- 31. Аллостерические ферменты
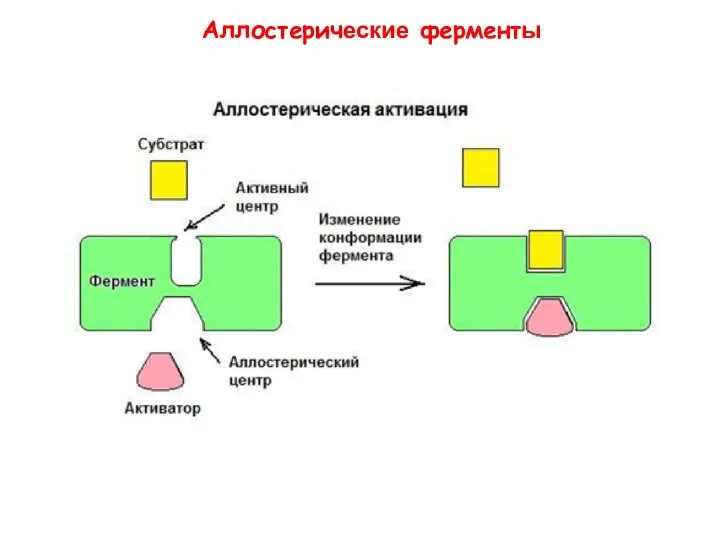
- 32. Аллостерические ферменты
- 33. Регуляция Активности Ферментов • Аллостерическая регуляция • Обратимая ковалентная модификация • Изоферменты • Протеолитическая активация Методы
- 34. Аллостерические модуляторы связываются нековалентно с аллостерическим центром. - регулируют активность фермента изменяя его конформацию. Аллостерические ферменты
- 35. Регуляция активности ферментов путем ковалентной модификации Ковалентное присоединение молекулы к аминокислотному остатку фермента может модифицировать активность
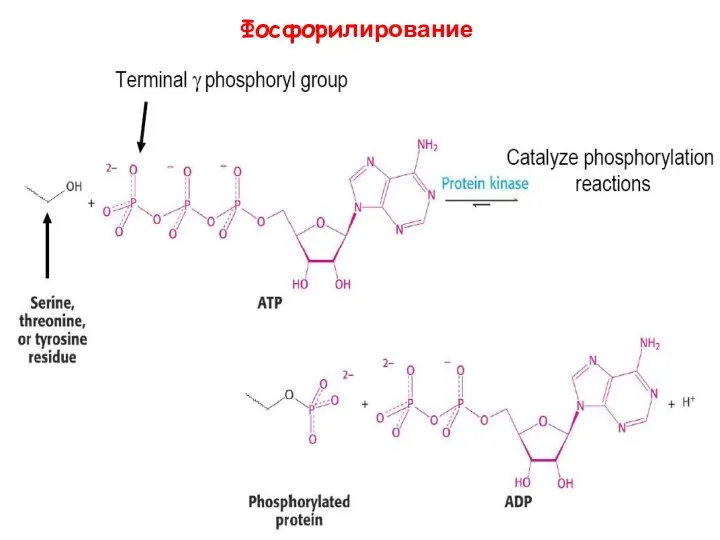
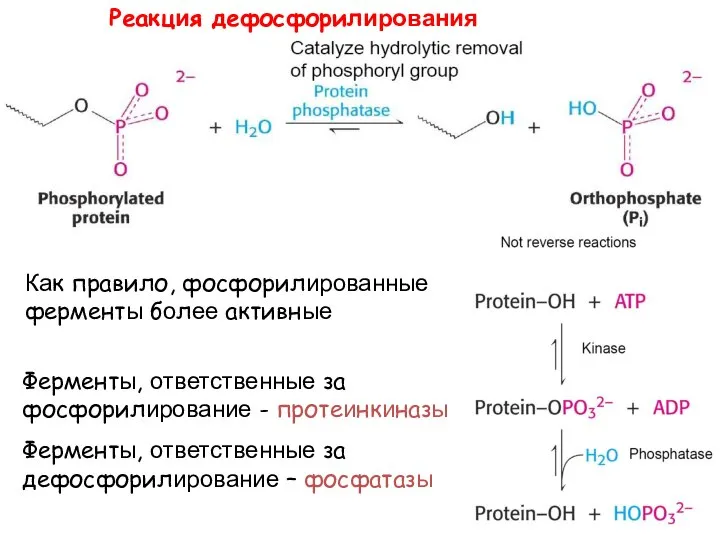
- 36. Фосфорилирование
- 37. Реакция дефосфорилирования Как правило, фосфорилированные ферменты более активные Ферменты, ответственные за фосфорилирование - протеинкиназы Ферменты, ответственные
- 38. множесственные формы фермента, которые отличаются аминокислотной последовательностью, но катализируют ту же реакцию. Изоферменты могут отличаться: кинетической
- 39. Анализ концентрации изоферментов в крови важен для диагностики различных болезней. Есть 5 изоферментов ЛДГ: H4 –
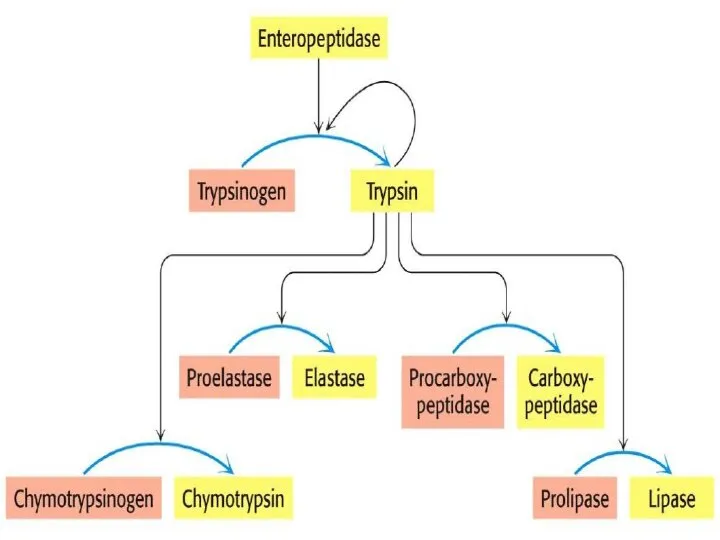
- 40. Протеолитическая активация • Много ферментов синтезируются как неактивные предшественники (зимогены) и активируются протеолитическим расщеплением Примеры специфического
- 42. Полиферментные комплексы - разные ферменты, которые катализируют последовательные реакции одного процесса и пространственно размещаются в одном
- 44. Введение в обмен веществ. Специфические и общие пути превращения углеводов, липидов и белков (окислительное декарбоксилирование ПВК,
- 45. Метаболизм – химические реакции, которые проходят в организме Метаболиты – маленькие промежуточные молекулы, которые образуются в
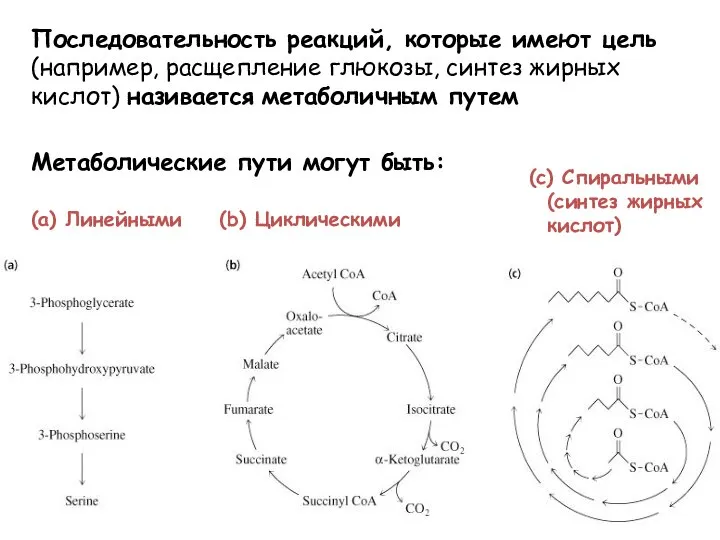
- 46. (a) Линейными (b) Циклическими (c) Спиральными (синтез жирных кислот) Последовательность реакций, которые имеют цель (например, расщепление
- 47. Катаболические реакции – деградация больших молекул с образованиемм меньших и энергии Анаболические реакции – синтез макромолекул
- 48. Регуляция метаболических путей Уровни регуляции метаболизма Нервная система Эндокринная система Взаимодействие между органами Клеточный (мембранный) уровень
- 49. Стадии метаболизма Катаболизм Стадия I (специфическая). Деградация макромолекул (белков, углеводов, липидов) к мономерам Стадия II (специфическая).
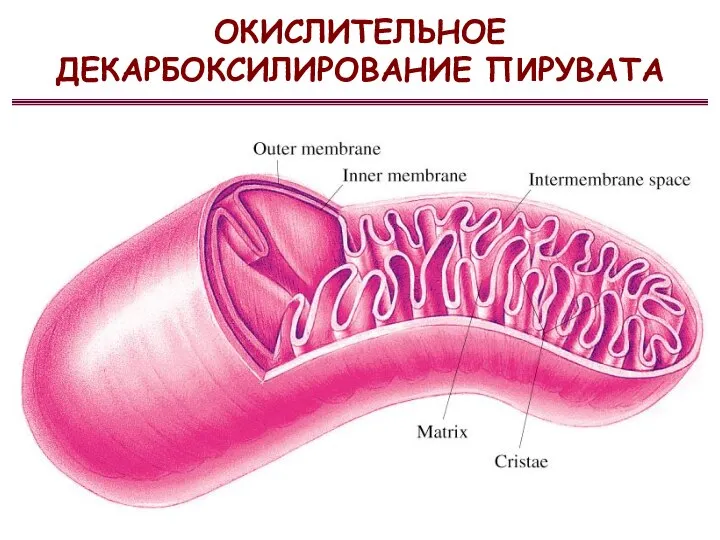
- 50. ОКИСЛИТЕЛЬНОЕ ДЕКАРБОКСИЛИРОВАНИЕ ПИРУВАТА
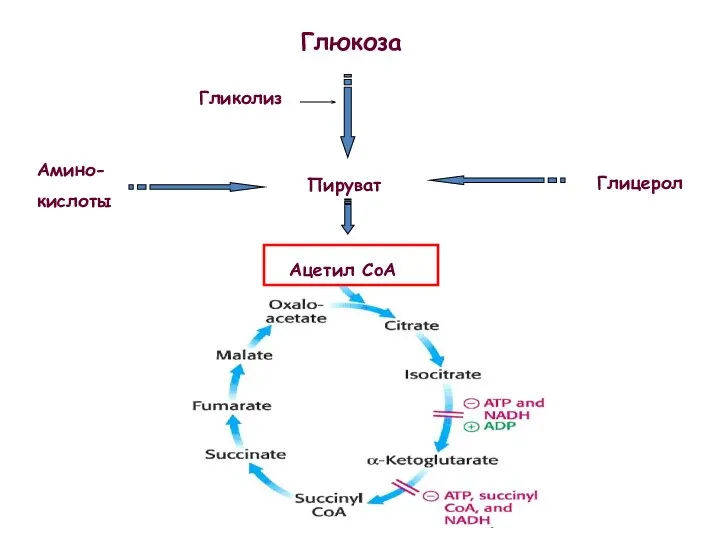
- 51. Глюкоза Пируват Гликолиз Глицерол Амино- кислоты Ацетил CoA
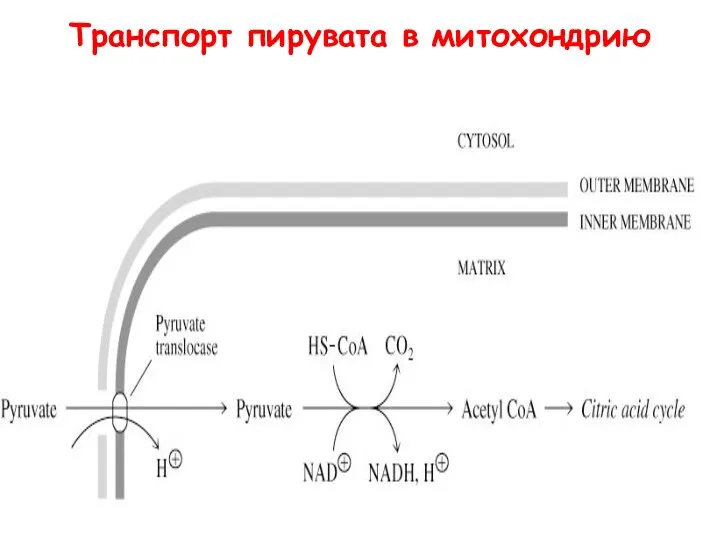
- 52. Транспорт пирувата в митохондрию
- 53. Пируватдегидрогеназный комплекс - поли-ферментный комплекс, который состоит с 3 ферментов, 5 коферментов Превращение пирувата в ацетил
- 54. Ферменты: E1 = пируватдегидрогеназа E2 = дигидролипоил ацетилтрансфераза E3 = дигидролипоил дегидрогеназа Коферменты: ТПФ (тиамин пирофосфат),
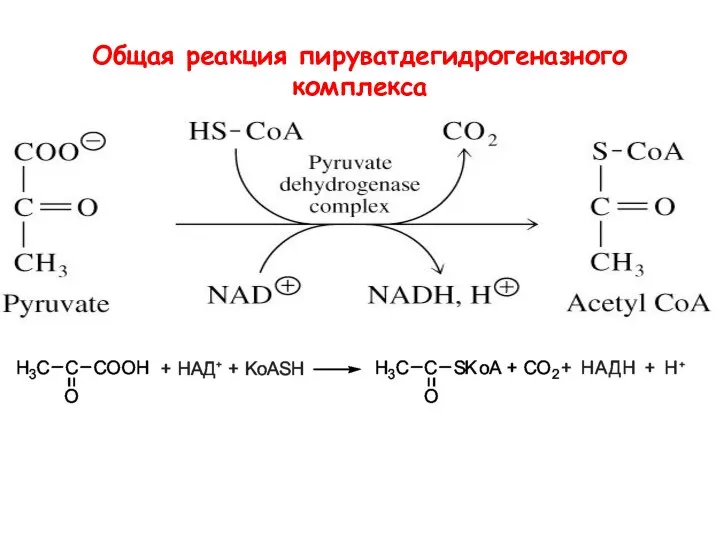
- 55. Общая реакция пируватдегидрогеназного комплекса
- 56. Названия: Цикл трикарбоновых кислот Цикл лимонной кислоты Цикл Кребса Ганс Адольф Кребс, выдающийся биохимик, родился в
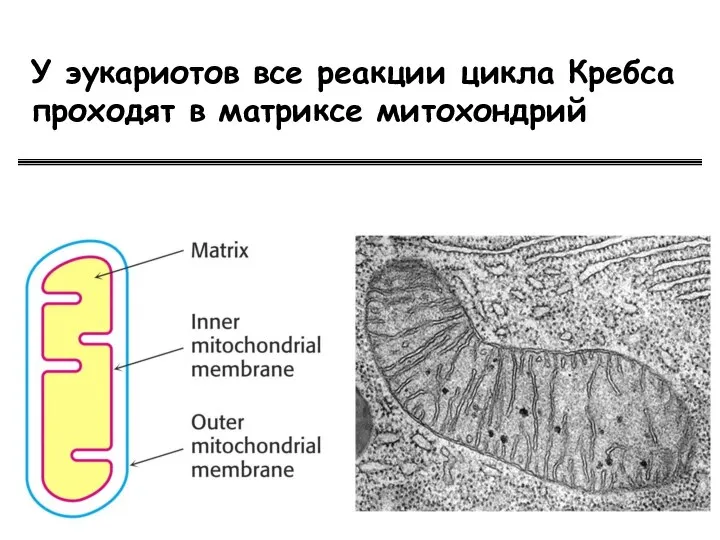
- 57. У эукариотов все реакции цикла Кребса проходят в матриксе митохондрий
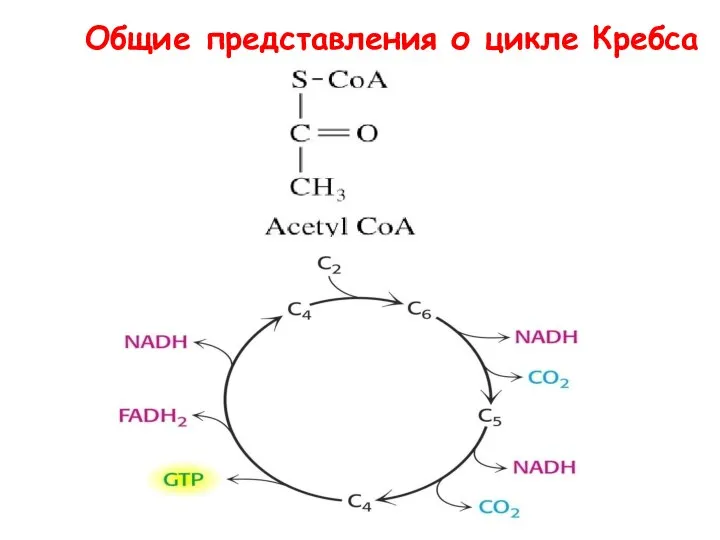
- 58. Общие представления о цикле Кребса
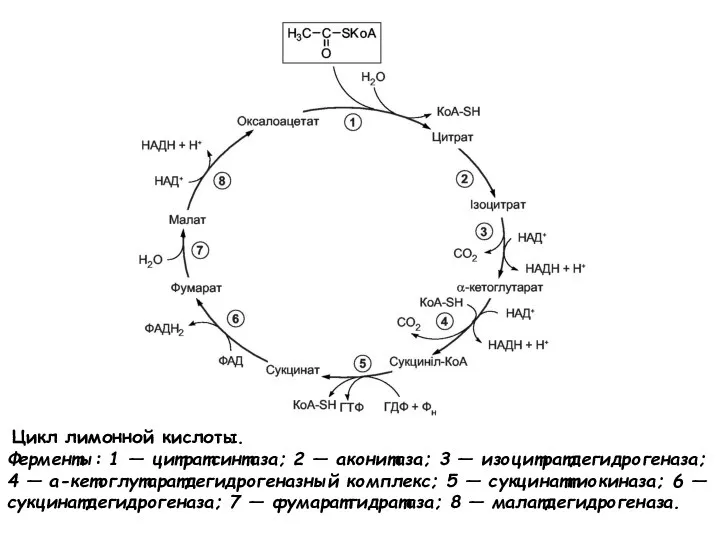
- 59. Цикл лимонной кислоты. Ферменты: 1 — цитратсинтаза; 2 — аконитаза; 3 — изоцитратдегидрогеназа; 4 — а-кетоглутаратдегидрогеназный
- 61. Скачать презентацию


![V – скорость реакции; Vmax – максимальная скорость равная KcatE0; [S] —](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/959185/slide-12.jpg)


![Когда [S] много больше чем Km скорость реакции не зависит от [S]](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/959185/slide-17.jpg)



















 Презентация на тему Надкласса рыб (Pisces)
Презентация на тему Надкласса рыб (Pisces)  Презентация на тему Передвижение организмов в водной среде
Презентация на тему Передвижение организмов в водной среде  Членистоногие
Членистоногие Презентация на тему СЕМЕЙСТВО ЗОНТИЧНЫЕ
Презентация на тему СЕМЕЙСТВО ЗОНТИЧНЫЕ  Морфофункциональная характеристика вегетативной нервной системы
Морфофункциональная характеристика вегетативной нервной системы Отрочество - особая пора жизни
Отрочество - особая пора жизни Организменная среда обитания
Организменная среда обитания Интероцептивные ощущения
Интероцептивные ощущения Ствол мозга. Строение и кровоснабжение
Ствол мозга. Строение и кровоснабжение Витамины и коферменты
Витамины и коферменты Овощные культуры
Овощные культуры Презентация на тему Плоские черви
Презентация на тему Плоские черви  Сравнительная анатомия Беспозвоночных
Сравнительная анатомия Беспозвоночных Тест по теме «Цветок» 6 класс
Тест по теме «Цветок» 6 класс Альтернативный адаптивный иммунитет Круглоротых
Альтернативный адаптивный иммунитет Круглоротых 11.4 Закономерности наследования признаков. Моногибридное скрещивание
11.4 Закономерности наследования признаков. Моногибридное скрещивание Презентация на тему Растительность средиземноморской области
Презентация на тему Растительность средиземноморской области  Отчет по практике на тему Ярусность растений пришкольного участка Муниципального бюджетного общеобразовательного учреждения
Отчет по практике на тему Ярусность растений пришкольного участка Муниципального бюджетного общеобразовательного учреждения What makes our blood different from others
What makes our blood different from others Динамика макромолекул
Динамика макромолекул Неповрежденные клетки семени подсолнечника
Неповрежденные клетки семени подсолнечника Cost: chemical synthesis with in vitro 1st step experiments
Cost: chemical synthesis with in vitro 1st step experiments Физиологические основы психики
Физиологические основы психики Рыбы. Задания
Рыбы. Задания Строение и функции нервной системы
Строение и функции нервной системы Презентация на тему ОБЩАЯ ХАРАКТЕРИСТИКА ЦАРСТВА РАСТЕНИЯ
Презентация на тему ОБЩАЯ ХАРАКТЕРИСТИКА ЦАРСТВА РАСТЕНИЯ  Экосистема луга в Ярославской области
Экосистема луга в Ярославской области Пшеница и рожь. Сравнение зерновых культур
Пшеница и рожь. Сравнение зерновых культур