Содержание
- 2. План лекции: Общие закономерности метаболизма. Этапы катаболизма. Цепь переноса электронов (ЦПЭ), состав, строение компонентов дыхательной цепи.
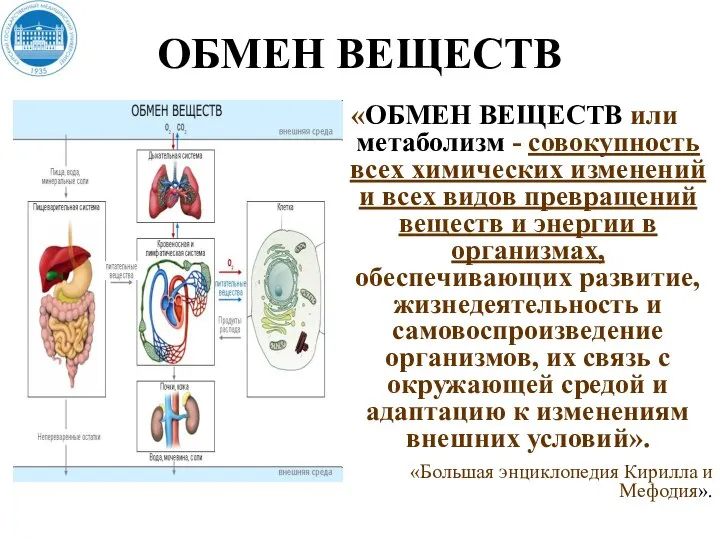
- 3. ОБМЕН ВЕЩЕСТВ «ОБМЕН ВЕЩЕСТВ или метаболизм - совокупность всех химических изменений и всех видов превращений веществ
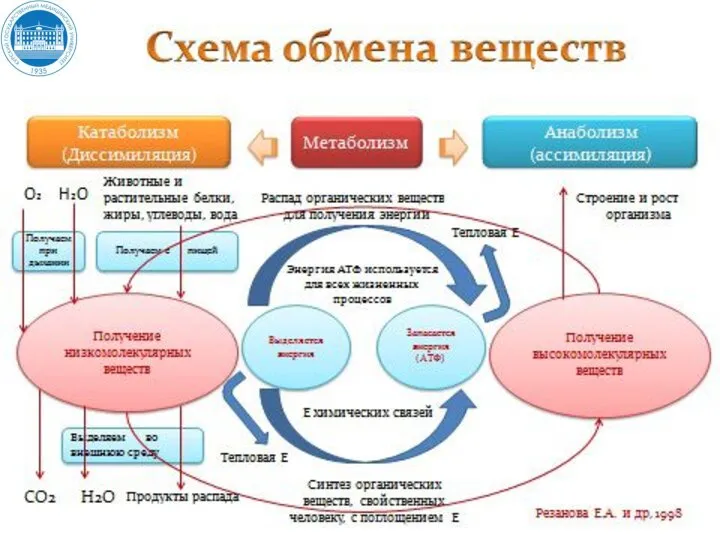
- 4. Промежуточный обмен (внутриклеточный метаболизм) включает два типа реакций: Катаболизм – биосинтетические процессы расщепления органических молекул до
- 5. Промежуточный обмен (внутриклеточный метаболизм) включает два типа реакций: Анаболизм - биосинтетические процессы, в которых простые строительные
- 7. Процессы окисления протекают в организме и вне организма. Эти процессы имеют сходства и различия. Биологическое окисление
- 8. Сходство между окислением в организме и вне организма. В результате окисления образуются одинаковые конечные продукты СО2
- 9. Различия между окислением в организме и вне организма. Вне организма энергия выделяется за счет окисления атомов
- 10. Различия между окислением в организме и вне организма. Вне организма энергия выделяется одномоментно и не аккумулируется,
- 11. Различия между окислением в организме и вне организма. Основной реакцией окисления в организме является реакция дегидрирования,
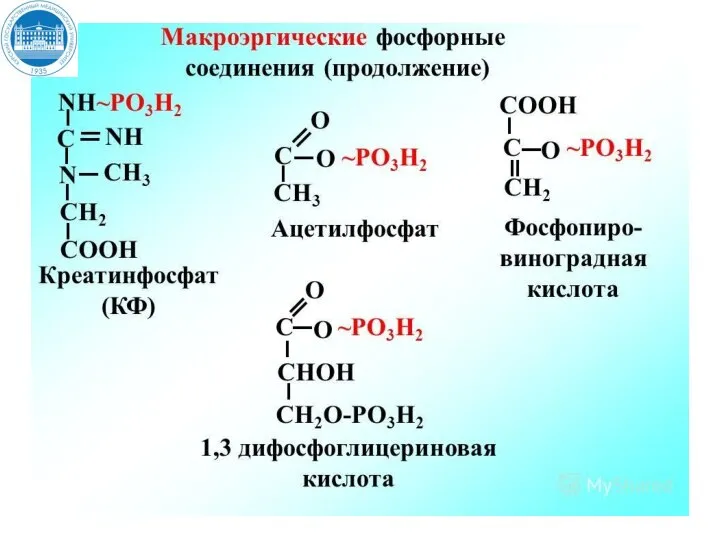
- 12. Утилизация энергии в виде макроэргических связей При разрыве макроэргической связи образуется более 30 кДж/моль свободной энергии
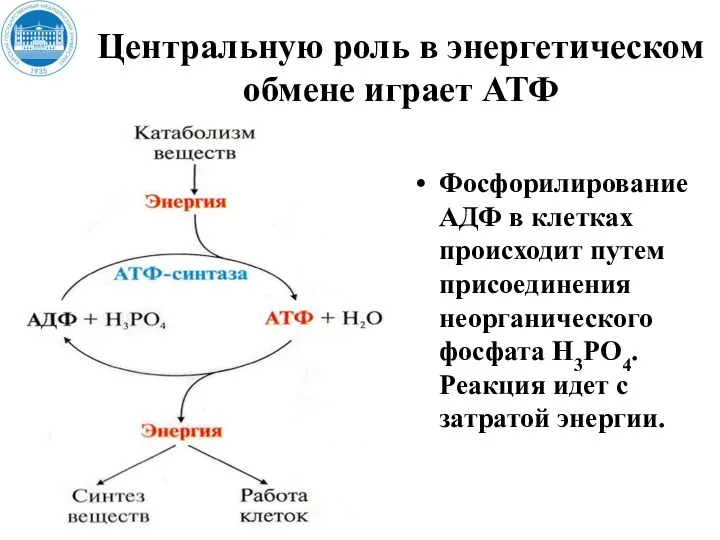
- 13. Центральную роль в энергетическом обмене играет АТФ Фосфорилирование АДФ в клетках происходит путем присоединения неорганического фосфата
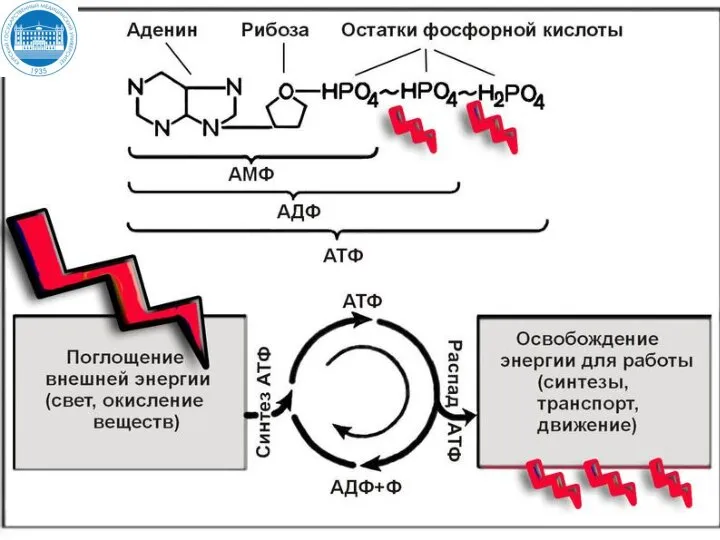
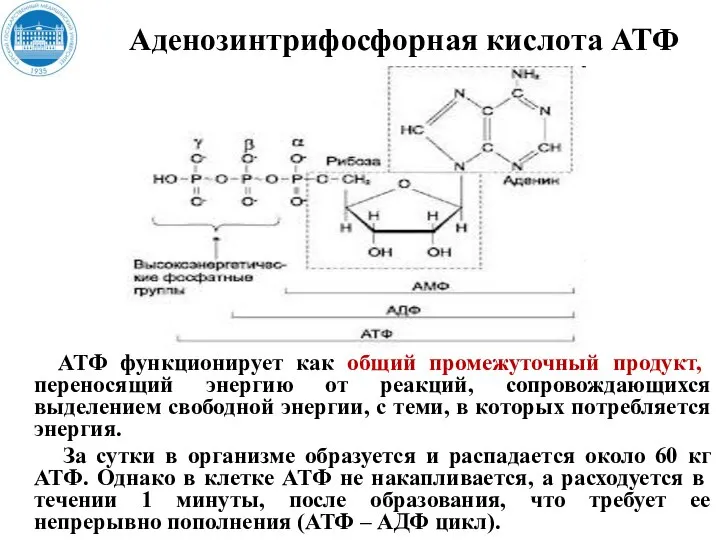
- 15. Аденозинтрифосфорная кислота АТФ АТФ функционирует как общий промежуточный продукт, переносящий энергию от реакций, сопровождающихся выделением свободной
- 16. Типы фосфорилирования АДФ В зависимости от источника энергии, обеспечивающего присоединение фосфатного участка, выделяют два типа фосфорилирования
- 17. Субстратное фосфорилирование - это процесс синтез АТФ из АДФ и неорганического фосфата за счет энергии, выделившийся
- 19. Окислительное фосфорилирование АДФ - синтез АТФ из АДФ и Н3РО4 за счет переноса электронов по ЦПЭ
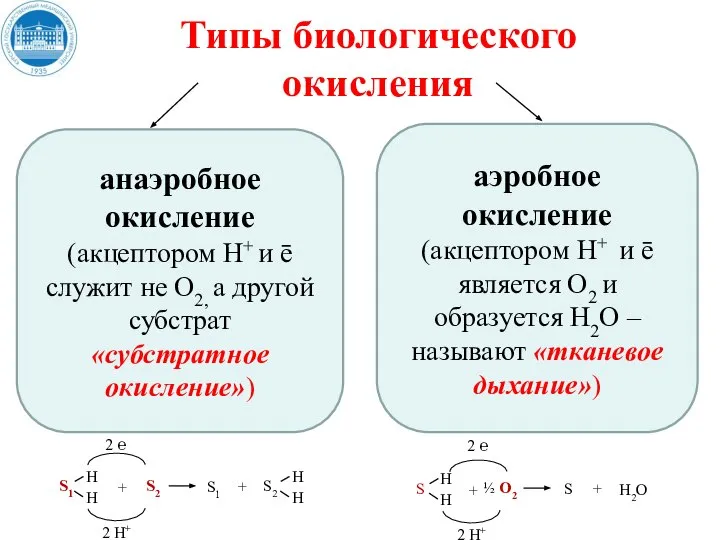
- 20. Типы биологического окисления анаэробное окисление (акцептором Н+ и ē служит не О2, а другой субстрат «субстратное
- 21. Тканевое дыхание Тканевым дыханием являются реакции окисления органических веществ, в которых используется кислород и образуется вода
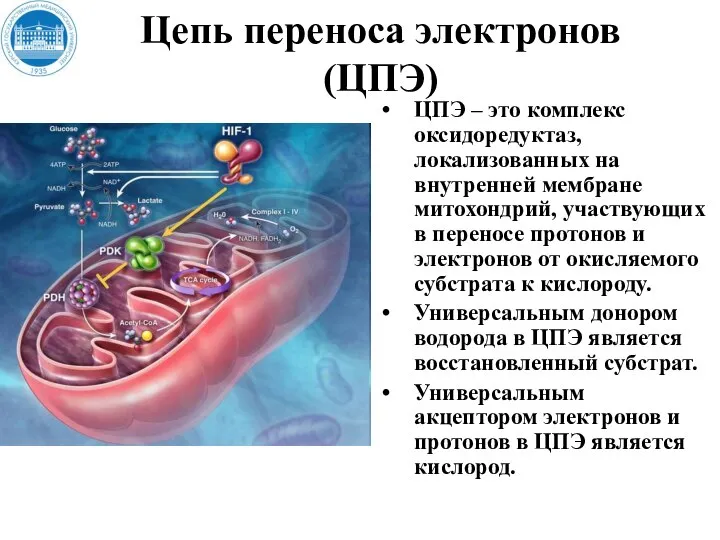
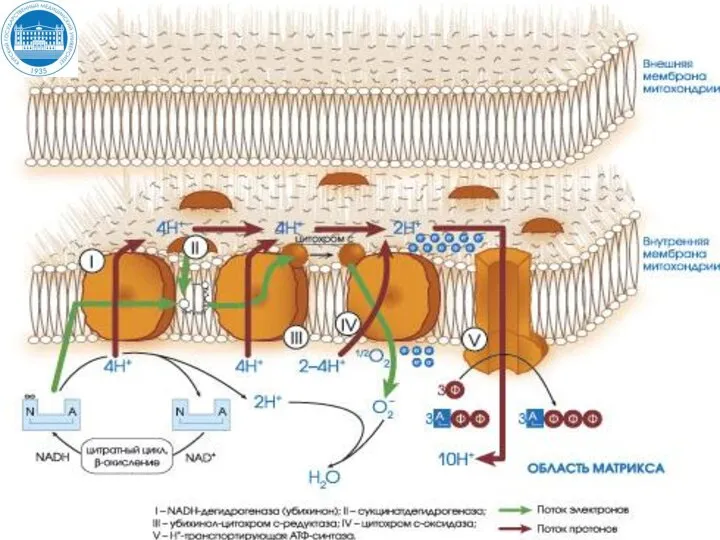
- 22. Цепь переноса электронов (ЦПЭ) ЦПЭ – это комплекс оксидоредуктаз, локализованных на внутренней мембране митохондрий, участвующих в
- 23. Первичные акцепторы водорода Никотинамидзависимые дегидрогеназы (NAD, NADР) (находятся в матриксе митохондрий или в цитозоле) NAD (NADР)
- 24. Первичные акцепторы водорода Флавинзависимые дегидрогеназы (FAD, FMN) В отличие от NAD FAD соединен прочно с белковой
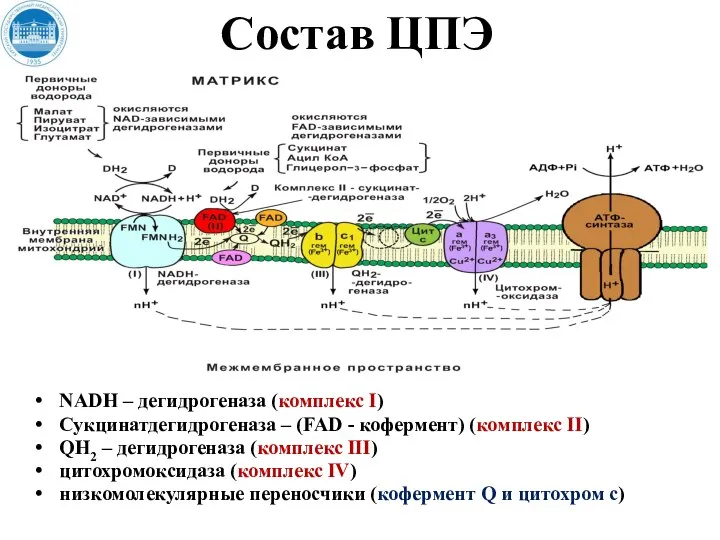
- 26. Состав ЦПЭ NADH – дегидрогеназа (комплекс I) Сукцинатдегидрогеназа – (FAD - кофермент) (комплекс II) QH2 –
- 27. NADH – дегидрогеназа (комплекс I) Комплекс I ЦПЭ содержит ФМН и 5 железосерных белков. NADН-дегидрогеназа (комплекс
- 28. Сукцинатдегидрогеназа – (FAD - кофермент) (комплекс II) Сукцинатдегидрогеназа - СДГ (FAD – зависимая дегидрогеназа) (комплекс II)
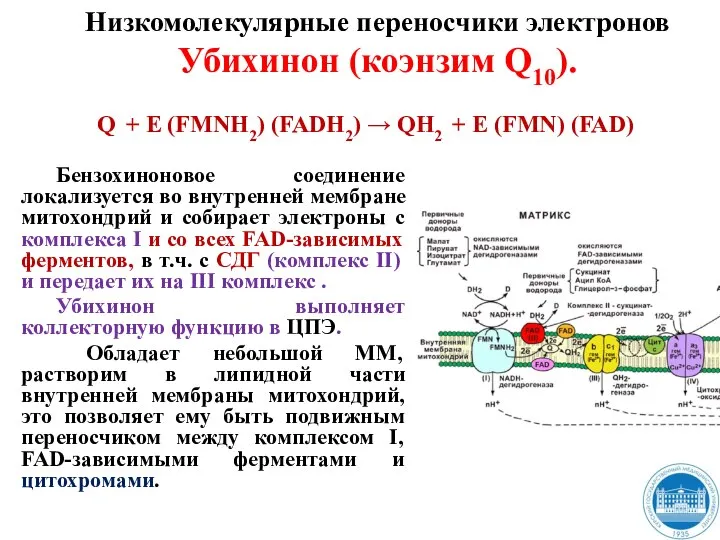
- 29. Бензохиноновое соединение локализуется во внутренней мембране митохондрий и собирает электроны с комплекса I и со всех
- 30. QH2 (коэнзим Q –дегидрогеназа) (комплекс III) Состоит из 2-типов цитохромов (b и с1) и железосерного белка
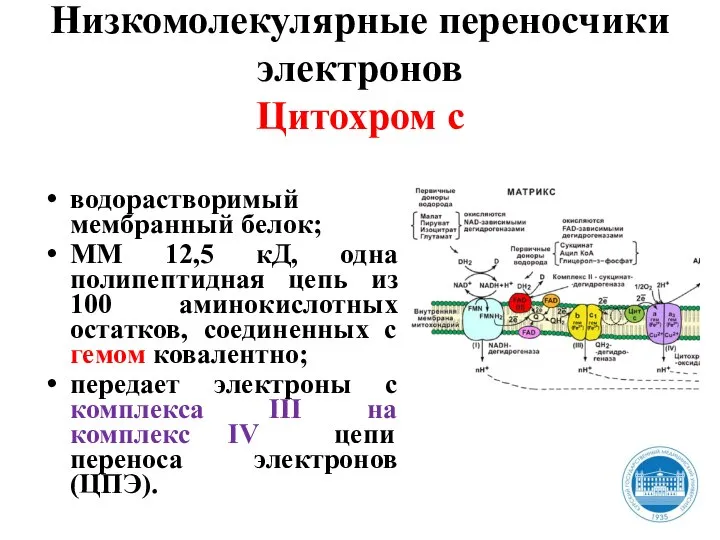
- 31. Низкомолекулярные переносчики электронов Цитохром с водорастворимый мембранный белок; ММ 12,5 кД, одна полипептидная цепь из 100
- 32. Цитохром-c-оксидаза (цит а/а3) (комплекс IV) Комплекс IV ЦПЭ содержит цитохромы а, а3, два иона меди. Это
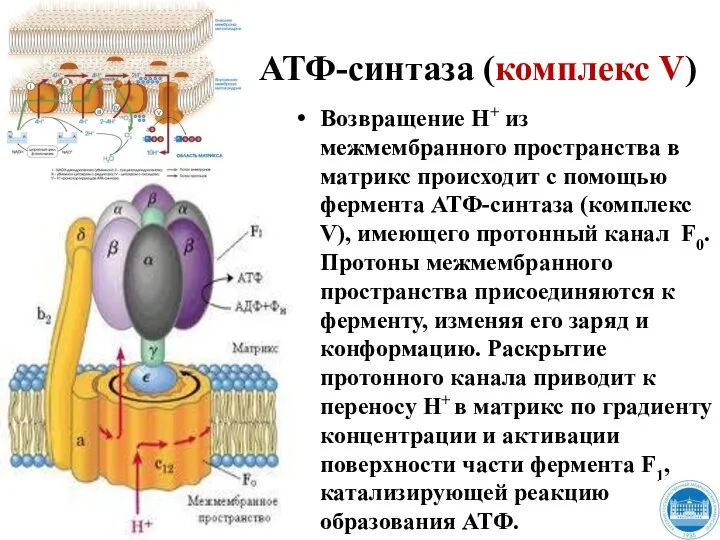
- 33. АТФ-синтаза (комплекс V) Возвращение Н+ из межмембранного пространства в матрикс происходит с помощью фермента АТФ-синтаза (комплекс
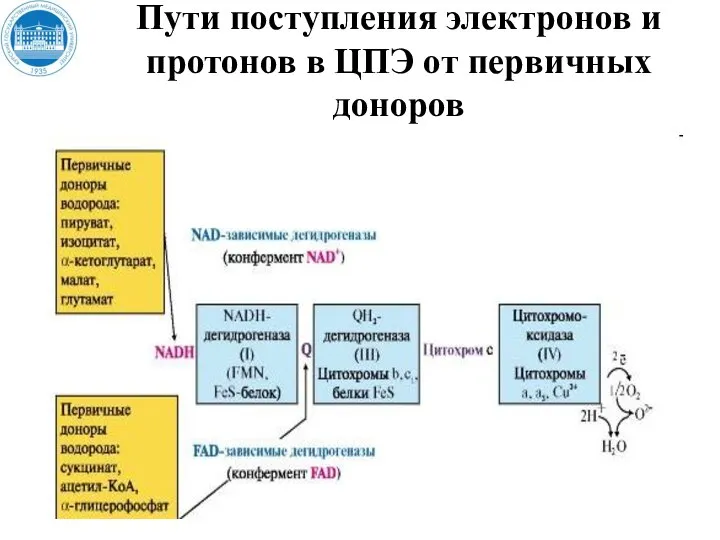
- 34. (II) Пути поступления электронов и протонов в ЦПЭ от первичных доноров
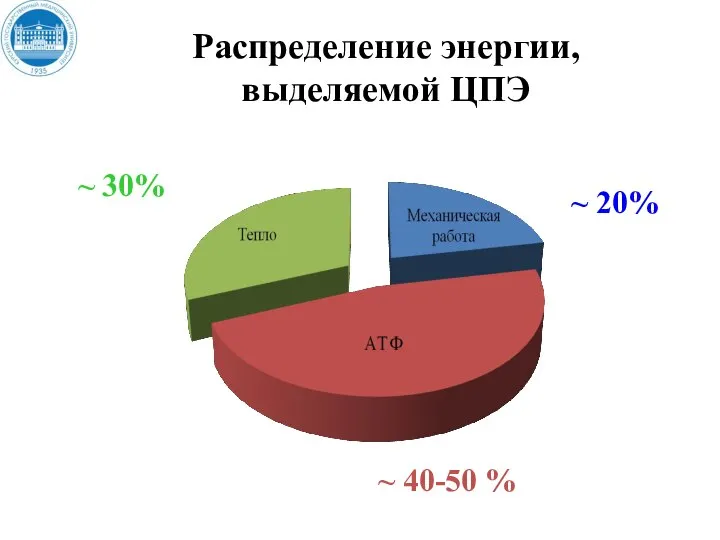
- 35. Распределение энергии, выделяемой ЦПЭ ~ 20% ~ 40-50 % ~ 30%
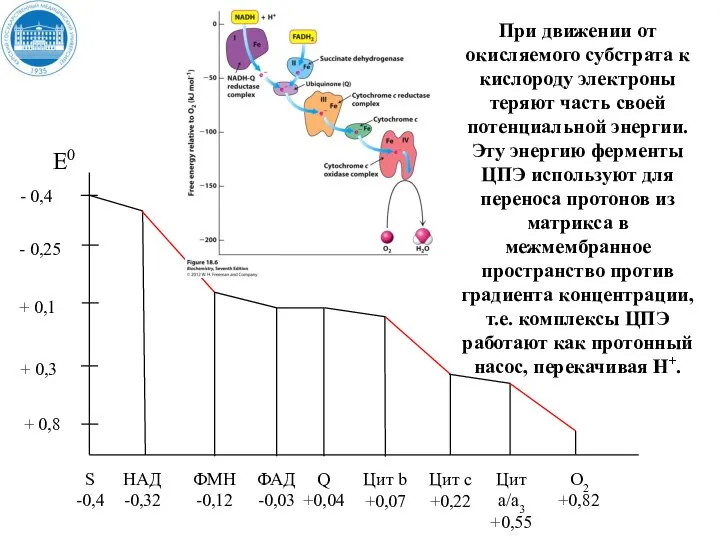
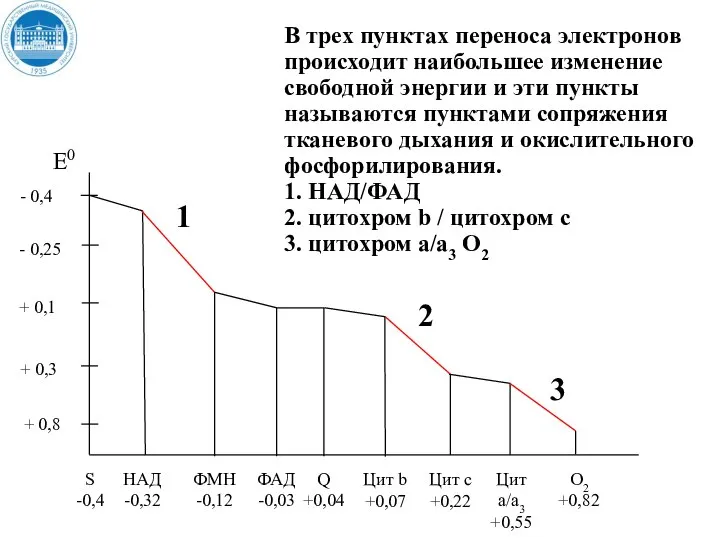
- 36. + 0,8 При движении от окисляемого субстрата к кислороду электроны теряют часть своей потенциальной энергии. Эту
- 37. + 0,8 В трех пунктах переноса электронов происходит наибольшее изменение свободной энергии и эти пункты называются
- 38. Пункты сопряжения постоянны, но их количество зависит от природы окисляемого субстрата. При окисления НАД – зависимых
- 39. Коэффициент окислительного фосфорилирование Р/О показывает, какое количество неорганического фосфата затрачивается для фосфорилирования АДФ при использовании 1
- 40. Коэффициент окислительного фосфорилирования НАД-Н+ + ½О2 →НАД+ + Н2О 3 АДФ + 3 Н3РО4→ 3 АТФ
- 41. Причины нарушения биологического окисления Недостаток субстрата (голодание, пищева-рение, межуточное нарушение обменов белков, углеводов, липидов); Недостаток О2
- 42. Вещества, понижающие интенсивность окислительного фосфолирирования АДФ. Ингибиторы ферментов ЦПЭ подавляют активность ферментных комплексов I, II и
- 43. Примеры веществ, понижающие интенсивность окислительного фосфолирирования АДФ. ингибиторы NADH-дегидрогиназы - лекарственные препараты со снотворным действием –
- 44. Вещество, способное полностью блокировать тканевое дыхание, синильная кислота Синильная кислота является веществом, вызывающим кислородное голодание тканевого
- 45. Вещество, способное полностью блокировать тканевое дыхание, синильная кислота Соединившись с цианидом, цитохромоксидаза теряет способность переносить электроны
- 46. Вещества, понижающие интенсивность окислительного фосфолирирования АДФ. Ингибиторы АТФ-синтазы снижают активность фермента, скорость фосфорилирования АДФ и коэффициент
- 48. Скачать презентацию




























 Животные в зоопарке
Животные в зоопарке Генетическая информация в клетке
Генетическая информация в клетке Процессы жизнедеятельности. Обмен веществ
Процессы жизнедеятельности. Обмен веществ Растение это живой организм
Растение это живой организм Защита виноградника
Защита виноградника Цитологическое изучение растений
Цитологическое изучение растений Насекомые вредители. Своя игра
Насекомые вредители. Своя игра Ткани, органы, аппараты и системы органов. Периоды онтогенеза у животных и растений
Ткани, органы, аппараты и системы органов. Периоды онтогенеза у животных и растений На лесных тропинках. Игра-викторина
На лесных тропинках. Игра-викторина Общая миология
Общая миология Размножение, как механизм обеспечения генетической непрерывности в ряду поколений
Размножение, как механизм обеспечения генетической непрерывности в ряду поколений Are you worried about wildlife
Are you worried about wildlife Сохраним природу
Сохраним природу Стероиды : стерины, желчные кислоты и стероидные гормоны
Стероиды : стерины, желчные кислоты и стероидные гормоны Обитатели моря
Обитатели моря Характеристика особенностей размножения кустарниковой и малоазийской полевок в природных и экспериментальных условиях
Характеристика особенностей размножения кустарниковой и малоазийской полевок в природных и экспериментальных условиях Вегетативная нервная система
Вегетативная нервная система Презентация на тему ХВОЙНЫЕ ДЕРЕВЬЯ
Презентация на тему ХВОЙНЫЕ ДЕРЕВЬЯ  О пользе ночного сна
О пользе ночного сна Выращивание гороха в комнатных условиях
Выращивание гороха в комнатных условиях В царстве грибов
В царстве грибов Отряд хищные
Отряд хищные Роль жиров в жизни человека
Роль жиров в жизни человека محاضرة تشريح
محاضرة تشريح Однолетние цветковые растения
Однолетние цветковые растения Тип членистоногие
Тип членистоногие Историческое прошлое людей
Историческое прошлое людей Домашние млекопитающие
Домашние млекопитающие