Содержание
- 2. 1. Какую в среднем долю составляет вода от общей массы живого организма? 50% 70% 90% 2.
- 3. 5. Какую способность молекулы воды определяет её дипольный характер? Ориентироваться в электрическом поле Ориентироваться в магнитном
- 4. Вода - один из основных экологических факторов, лимитирующих рост и развитие растений. Назовите приспособления, которые формируются
- 5. ФУНКЦИИ НЕОРГАНИЧЕСКИХ ВЕЩЕСТВ В КЛЕТКЕ Нерастворимые соли. Входят в состав межклеточного вещества костной ткани – Са3(РО4)2,
- 6. ИОНЫ В КЛЕТКЕ КАТИОНЫ К+, Na+, Ca2+, Mg2+ АНИОНЫ H2PO4-, Cl-, HCO3- К+ - основной внутриклеточный
- 7. ФУНКЦИИ ИОНОВ 1. БУФЕРНОСТЬ – способность клетки сохранять определенную концентрацию pH. В клетке рН = 7,2
- 9. Скачать презентацию
Слайд 21. Какую в среднем долю составляет вода от общей массы живого организма?
50%
70%
90%
2.
1. Какую в среднем долю составляет вода от общей массы живого организма?
50%
70%
90%
2.

Наличием водородных связей
Высокой молекулярной массой
Низкой плотностью
3. Какое свойство воды предохраняет клетку от резких температурных колебаний?
Высокая теплопроводность
Высокая теплоёмкость
Высокая теплота испарения
4. Какой процесс лежит в основе защиты живых организмов от перегрева?
Образования водородных связей
Испарения воды
Охлаждения воды
Слайд 35. Какую способность молекулы воды определяет её дипольный характер?
Ориентироваться в электрическом поле
Ориентироваться
Ориентироваться в электрическом поле
Ориентироваться

Создавать устойчивые химические связи
6. От чего зависит гидрофильность или гидрофобность вещества?
От структуры его молекул
От наличия в его молекуле заряженных атомов
От типа его межмолекулярных связей
7. Что такое диссоциация воды?
Разделение молекулы воды на протон и гидроксильный ион
Разделение молекулы воды на кислород и водород
Разрушение водородных связей
8. К чему по ионному составу близки жидкости организма?
К дистиллированной воде
К пресной воде
К морской воде
Слайд 4Вода - один из основных экологических факторов, лимитирующих рост и развитие растений.
Вода - один из основных экологических факторов, лимитирующих рост и развитие растений.

1) Хорошо развитая водозапасающая ткань (мясистые листья алоэ, толстые стебли кактуса)
2) Глубокая корневая система, повышающая количество всасываемой воды
3) Колючки, уменьшающие интенсивность испарения (транспирации)
4) Формирование подземных видоизмененных побегов (корневищ, луковиц, клубней) для перенесения засух
Почему альпинисты жалуются, что на больших высотах они не могут сварить горячий и крепкий чай? Объясните ответ, используя знания о строении молекул воды и её свойствах.
1) Кипением называется процесс парообразования по всему объему воды. Вода закипает, когда давление внутри пузырьков водяного пара становится больше, чем атмосферное давление снаружи. Тогда пузырьки растут и выталкивается вверх силой Архимеда.
2) На больших высотах атмосферное давление ниже, чем на поверхности земли. Чем ниже внешнее давление, тем ниже должно быть давление водяного пара для кипения воды, тем ниже температура закипания воды.
3) Поскольку вода переходит в пар, так и не прогреваясь до 100 градусов, в ней плохо растворяются вкусовые вещества чая.
Слайд 5ФУНКЦИИ НЕОРГАНИЧЕСКИХ ВЕЩЕСТВ В КЛЕТКЕ
Нерастворимые соли.
Входят в состав межклеточного вещества костной
ФУНКЦИИ НЕОРГАНИЧЕСКИХ ВЕЩЕСТВ В КЛЕТКЕ
Нерастворимые соли.
Входят в состав межклеточного вещества костной
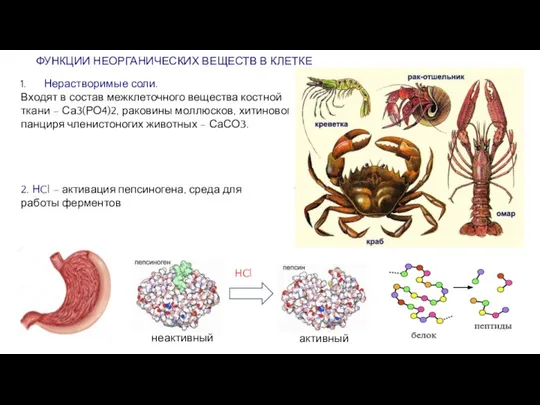
2. НCl – активация пепсиногена, среда для работы ферментов
Слайд 6ИОНЫ В КЛЕТКЕ
КАТИОНЫ
К+, Na+, Ca2+, Mg2+
АНИОНЫ
H2PO4-, Cl-, HCO3-
К+ - основной внутриклеточный
ИОНЫ В КЛЕТКЕ
КАТИОНЫ
К+, Na+, Ca2+, Mg2+
АНИОНЫ
H2PO4-, Cl-, HCO3-
К+ - основной внутриклеточный
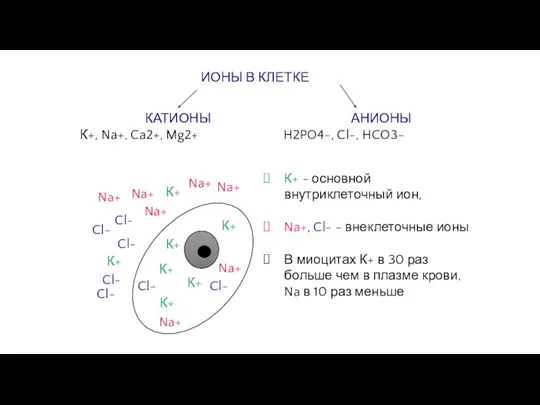
Na+, Cl- - внеклеточные ионы
В миоцитах К+ в 30 раз больше чем в плазме крови, Na в 10 раз меньше
Слайд 7ФУНКЦИИ ИОНОВ
1. БУФЕРНОСТЬ – способность клетки сохранять определенную концентрацию pH.
В клетке
ФУНКЦИИ ИОНОВ
1. БУФЕРНОСТЬ – способность клетки сохранять определенную концентрацию pH.
В клетке

БУФЕРНЫЕ СИСТЕМЫ
БЕЛКОВАЯ И
ГЕМОГЛОБИНОВАЯ
ФОСФАТНАЯ
(в тканях, моче, пищ соках)
БИКАРБОНАТНАЯ
(в плазме крови, эритроцитах)
NaH2PO4 –слабая кислота,
Na2HPO4 – слабая щелочь
При поступлении сильной кислоты:
Na2HPO4 + HCl → NaCl + NaH2PO4
При поступлении оснований:
NaH2PO4 + NaOH → H2O + Na2HPO4
Избыток продуктов реакции выводится почками.
H2CO3 - слабая кислота,
NaHCO3 – нейтральная соль
NaHCO3 легко диссоциирует на ионы Na+ и НСОз-.
При поступлении сильной кислоты:
NaHCO3 + HCl → NaCl + H2CO3 ,
H2CO3 → H2O + CO2
При поступлении оснований:
H2CO3 + NaOH → NaHCO3 + H2O
дигидрофосфат натрия
гидрофосфат натрия
 Эволюция пищеварительной системы животных
Эволюция пищеварительной системы животных Наследование. Менделевские законы наследования
Наследование. Менделевские законы наследования Чарльз Дарвин об эволюции органического мира
Чарльз Дарвин об эволюции органического мира Plexus lumbosacralis
Plexus lumbosacralis Поведение человека
Поведение человека Круглые черви и прогресс
Круглые черви и прогресс Знакомство с гусеницей
Знакомство с гусеницей Лунтик и его друзья в школе
Лунтик и его друзья в школе Презентация на тему ПИТАНИЕ РАСТЕНИЙ
Презентация на тему ПИТАНИЕ РАСТЕНИЙ  Строение и принцип работы нервной системы
Строение и принцип работы нервной системы Отряды Высших Млекопитающих
Отряды Высших Млекопитающих Тип Кольчатые черви
Тип Кольчатые черви Дыхательная система
Дыхательная система Анатомия и физиология системы внешнего дыхания
Анатомия и физиология системы внешнего дыхания Аминокислоты
Аминокислоты Дерево счастья
Дерево счастья Растительный и животный мир Крыма. Часть4
Растительный и животный мир Крыма. Часть4 Популяционная морфология и генетика. Актуальные направления исследований в популяционной генетике
Популяционная морфология и генетика. Актуальные направления исследований в популяционной генетике Борщевик – зеленый террорист
Борщевик – зеленый террорист Пищеварение в кишечнике
Пищеварение в кишечнике Общие свойства гормонов. Характеристика и типы рецепторов. Лекция №9
Общие свойства гормонов. Характеристика и типы рецепторов. Лекция №9 Кожа и её производные
Кожа и её производные Презентация на тему Кроссворд. Строение клетки
Презентация на тему Кроссворд. Строение клетки  Модель изменения численности с учётом внутривидовой конкуренции (модель Ферхюльста)
Модель изменения численности с учётом внутривидовой конкуренции (модель Ферхюльста) Первичная структура белка. Зависимость биологических свойств белков от первичной структуры. Вторичная структура белка
Первичная структура белка. Зависимость биологических свойств белков от первичной структуры. Вторичная структура белка Движение крови по сосудам
Движение крови по сосудам 454d85b138d6e44bd3f315723f4e8152 (1)
454d85b138d6e44bd3f315723f4e8152 (1) Структурные единицы организма человека
Структурные единицы организма человека