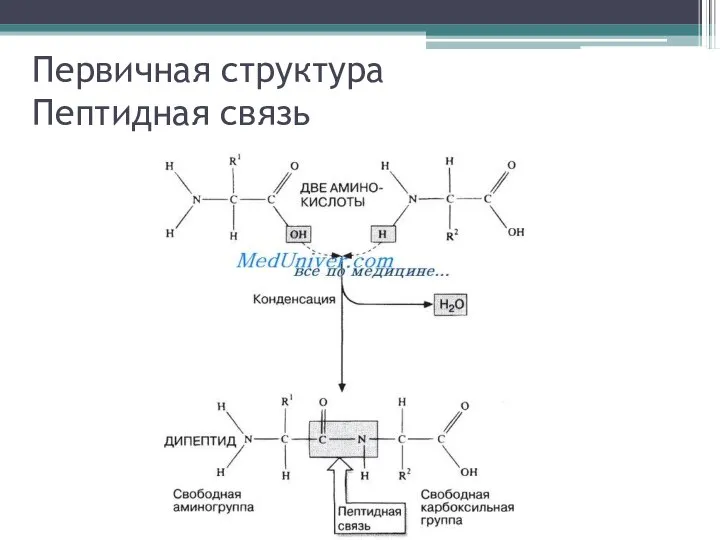
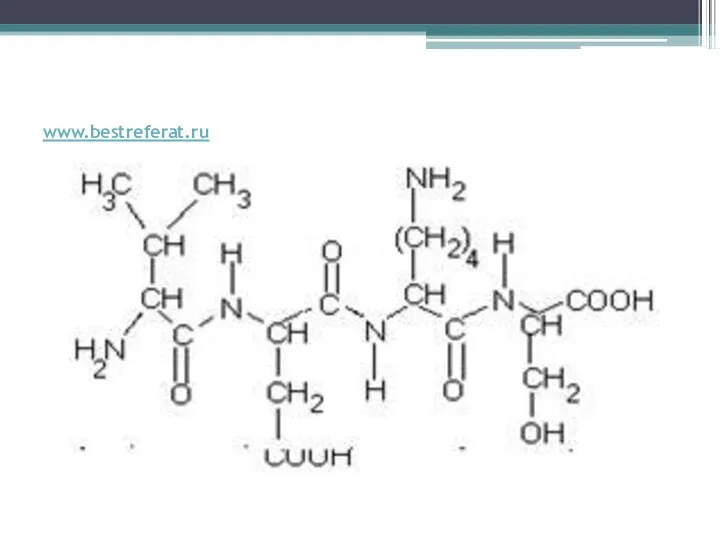
Слайд 2Первичная структура
Пептидная связь
Слайд 4plantcellbiology.masters.grkraj.o
Длина пептидной связи – 0.133 нм
Длина одинарной связи C-N – 0.149 нм
Длина
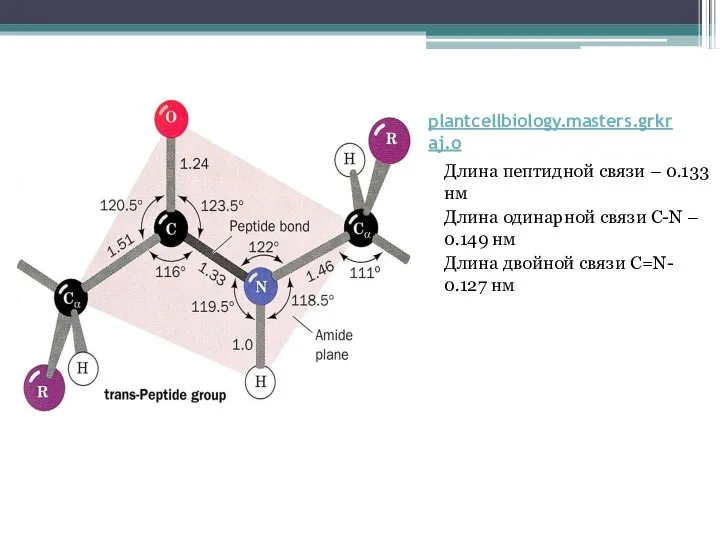
двойной связи C=N- 0.127 нм
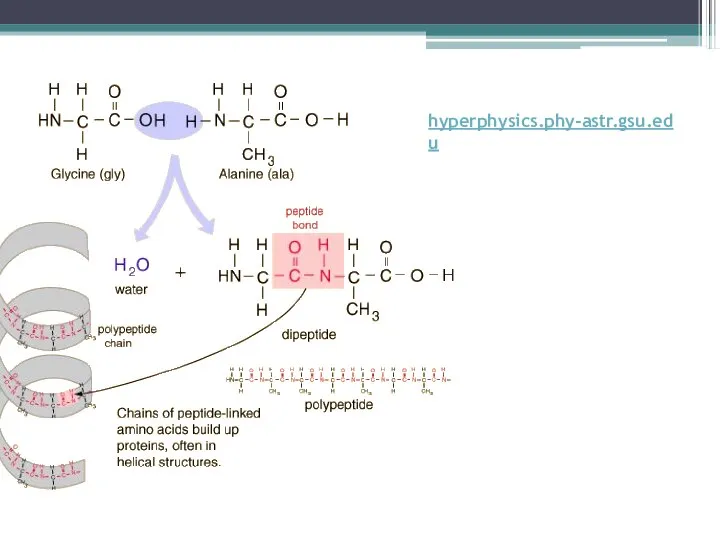
Слайд 5hyperphysics.phy-astr.gsu.edu
Слайд 7www.absoluteastronomy.com
Участки poly-Pro
Слайд 8http://www.lomonosov-fund.ru/enc/ru/encyclopedia:0130252

Слайд 9Параметры спирали:
3,6 аминокислотных остатков на один виток
Шаг спирали – 0,544 нм
Расстояние между

аминокислотными остатками – 0,15 нм
Слайд 10http://oadk.at.ua/load/khimija/lekcii_po_khimii/belki/55-1-0-1701
Причины нарушения спирализации:
Близкое расположение одноименно заряженных радикалов (лизин, аргинин, глутаминовая к-та и

др.
Близкое расположение крупных гидрофобных радикалов (серин, треонин, лейцин и др.)
Наличие пролина в цепи
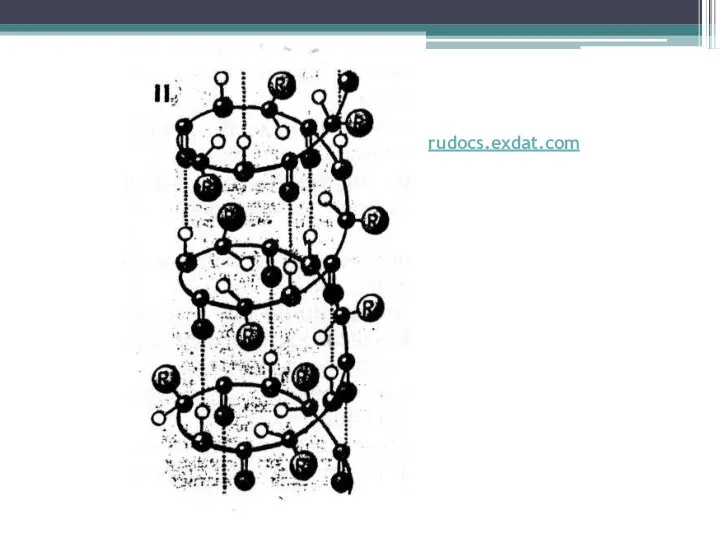
Слайд 11β-слой
http://www.icehouse.ru/2009-09_HT.shtml
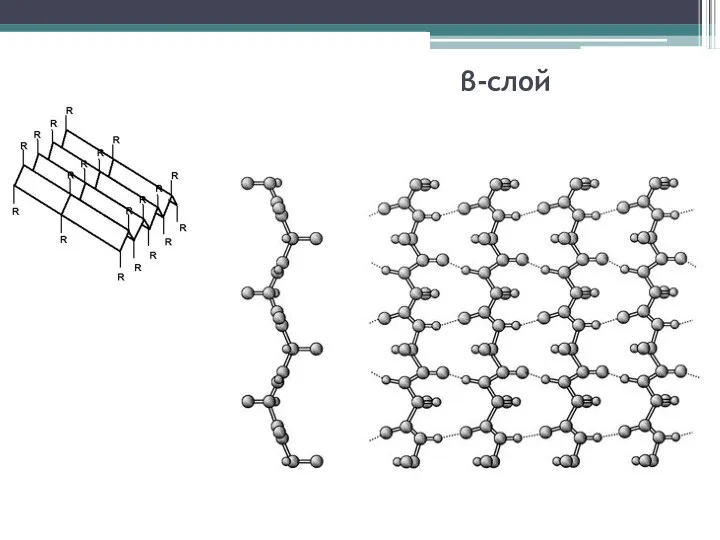
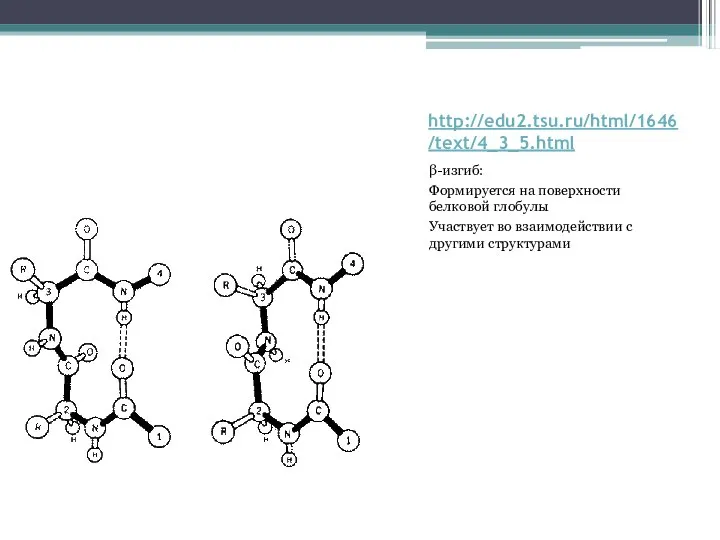
Слайд 12http://edu2.tsu.ru/html/1646/text/4_3_5.html
Образована за счет межцепочечных водородных связей, а внутрицепочечные связи отсутствуют
Слайд 13http://www.russianamerica.com/common/arc/story.php/523474
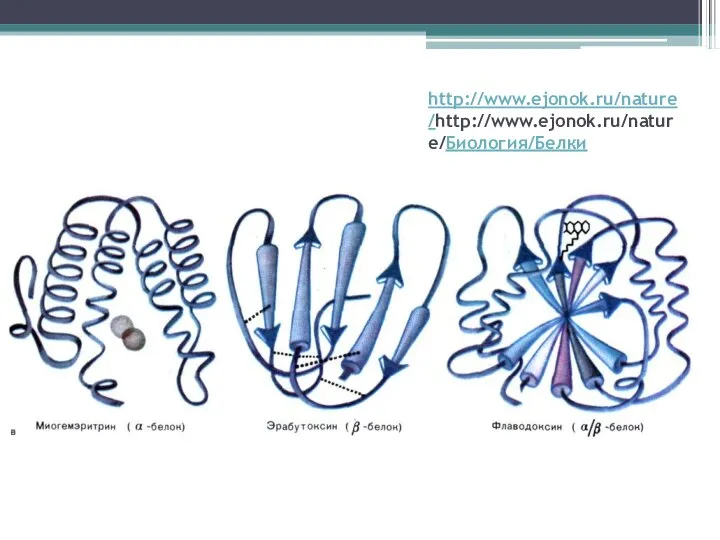
Слайд 14http://www.ejonok.ru/nature/http://www.ejonok.ru/nature/Биология/Белки
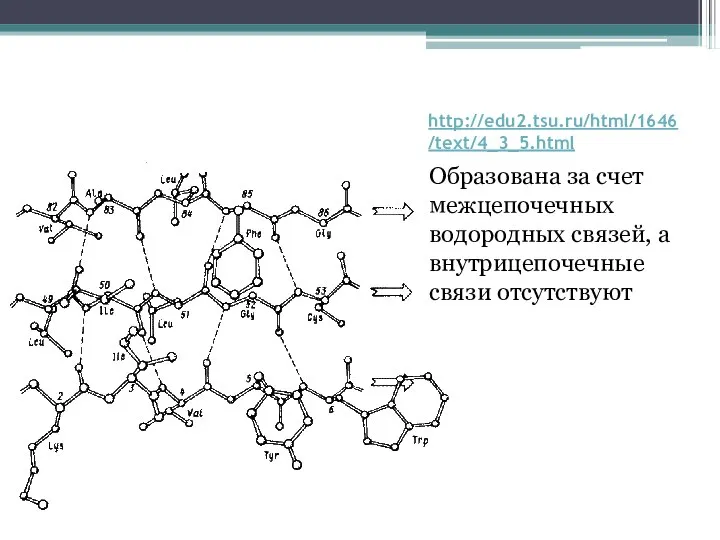
Слайд 15http://edu2.tsu.ru/html/1646/text/4_3_5.html
β-изгиб:
Формируется на поверхности белковой глобулы
Участвует во взаимодействии с другими структурами
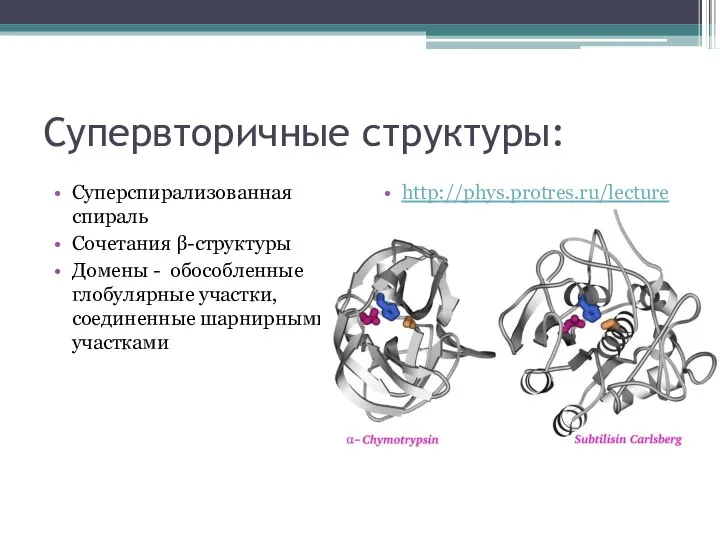
Слайд 16Супервторичные структуры:
Суперспирализованная спираль
Сочетания β-структуры
Домены - обособленные глобулярные участки, соединенные шарнирными участками
http://phys.protres.ru/lectures/protein_physics/l01.html













 Презентация на тему ВЫДЕЛИТЕЛЬНАЯ СИСТЕМА
Презентация на тему ВЫДЕЛИТЕЛЬНАЯ СИСТЕМА  Самые ядовитые комнатные растения
Самые ядовитые комнатные растения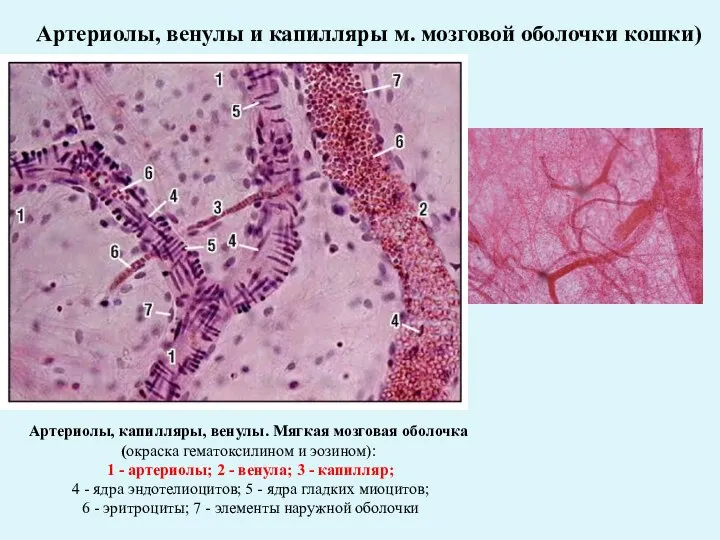 Артериолы, венулы и капилляры м. мозговой оболочки кошки
Артериолы, венулы и капилляры м. мозговой оболочки кошки «Болезни глаз. Гигиена зрения». Учебный проект по биологии ученицы 8 класса Железногорской санаторно-лесной школы Гербаль Людмил
«Болезни глаз. Гигиена зрения». Учебный проект по биологии ученицы 8 класса Железногорской санаторно-лесной школы Гербаль Людмил Железо, как биогенный элемент
Железо, как биогенный элемент Развитие мышечной системы в онтогенезе
Развитие мышечной системы в онтогенезе Тварини. Свійські тварини. Дикі тварини
Тварини. Свійські тварини. Дикі тварини Насекомоядные растения
Насекомоядные растения Лиственница сибирская
Лиственница сибирская Значение животных в природе и жизни человека
Значение животных в природе и жизни человека Блоттинг
Блоттинг Какие бывают животные окружающий мир. 2 класс
Какие бывают животные окружающий мир. 2 класс Ряст - проліска дволиста
Ряст - проліска дволиста Энергетический путь глюкозы. Путь получения энергии
Энергетический путь глюкозы. Путь получения энергии Законы наследования. Тема 17
Законы наследования. Тема 17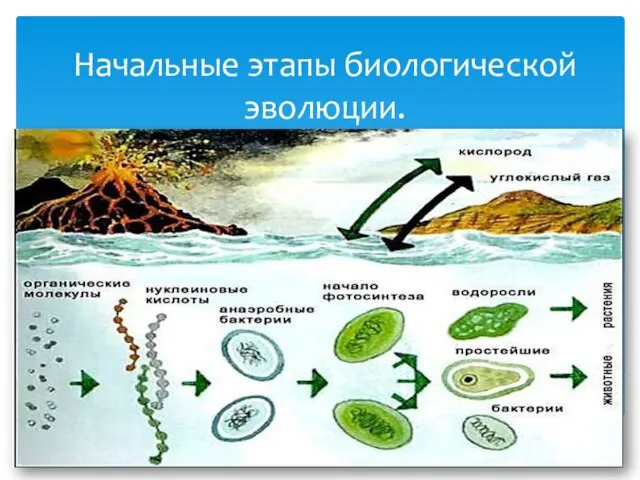 Начальные этапы биологической эволюции
Начальные этапы биологической эволюции Процессы жизнедеятельности. Обмен веществ
Процессы жизнедеятельности. Обмен веществ Семейка грибов на полянке (2 класс)
Семейка грибов на полянке (2 класс) Photosynthesis
Photosynthesis Мариукультура. Культивирование тихоокеанских устриц
Мариукультура. Культивирование тихоокеанских устриц Антропогенез
Антропогенез Строение семян однодольных и двудольных растений. Лабораторная работа
Строение семян однодольных и двудольных растений. Лабораторная работа Химический состав клетки
Химический состав клетки Зелёные водоросли, их многообразие, строение, среда обитания
Зелёные водоросли, их многообразие, строение, среда обитания Цветоводство : виды и значение
Цветоводство : виды и значение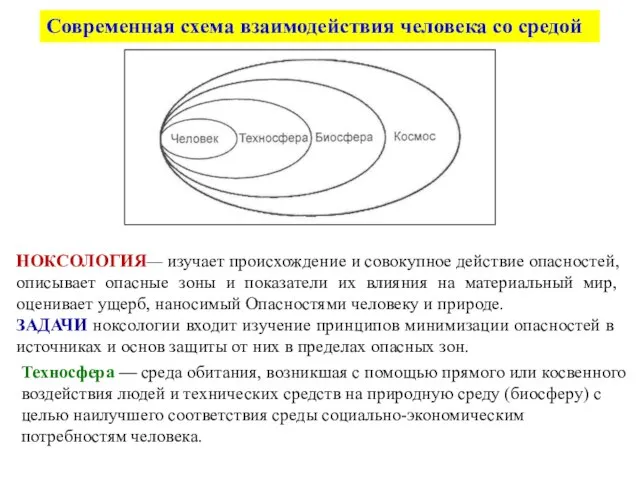 Современная схема взаимодействия человека со средой
Современная схема взаимодействия человека со средой Последствия деятельности человека в экосистемах
Последствия деятельности человека в экосистемах Царство Растения
Царство Растения