Содержание
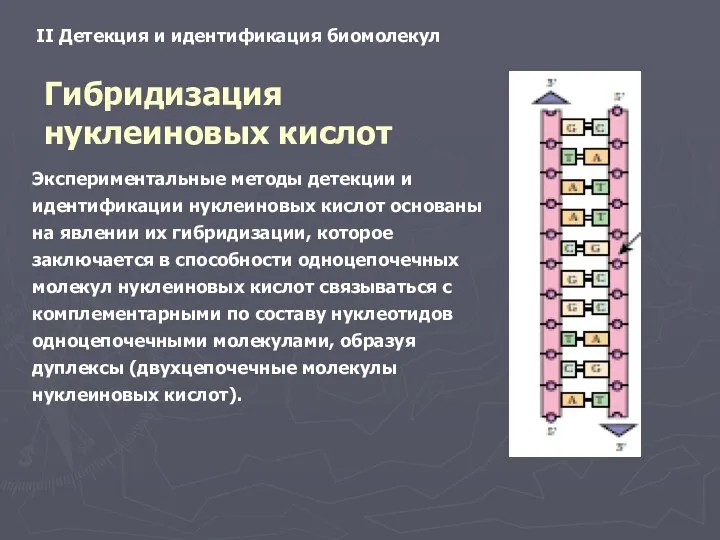
- 2. II Детекция и идентификация биомолекул Гибридизация нуклеиновых кислот Экспериментальные методы детекции и идентификации нуклеиновых кислот основаны
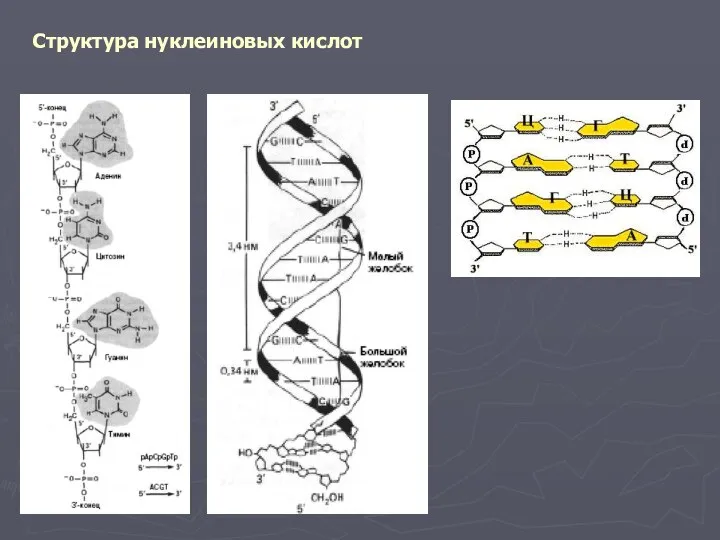
- 3. Структура нуклеиновых кислот
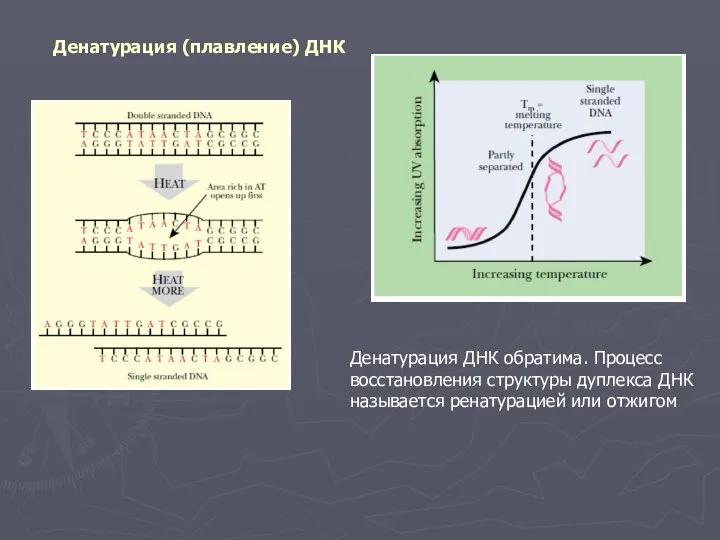
- 4. Денатурация (плавление) ДНК Денатурация ДНК обратима. Процесс восстановления структуры дуплекса ДНК называется ренатурацией или отжигом
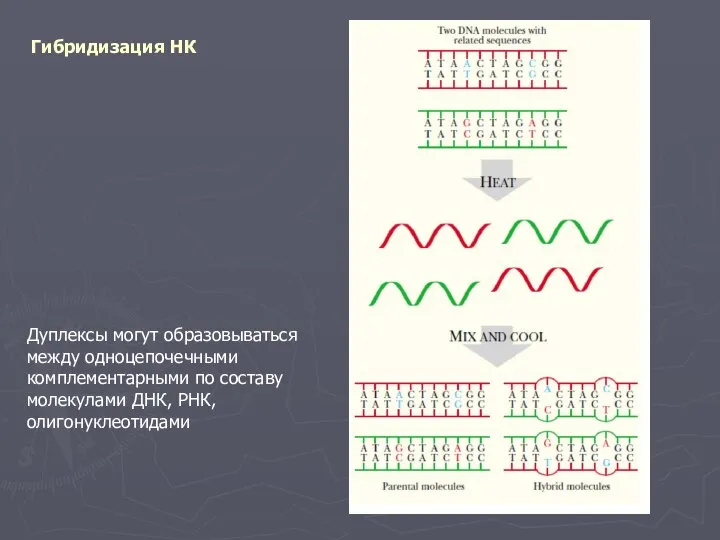
- 5. Гибридизация НК Дуплексы могут образовываться между одноцепочечными комплементарными по составу молекулами ДНК, РНК, олигонуклеотидами
- 6. Стабильность дуплексов нуклеиновых кислот определяется следующими факторами: длина цепей − длинные дуплексы удерживаются большим числом водородных
- 7. Мерой стабильности дуплекса нуклеиновых кислот является температура плавления (Tm). Это температура, соответствующая средней точке перехода между
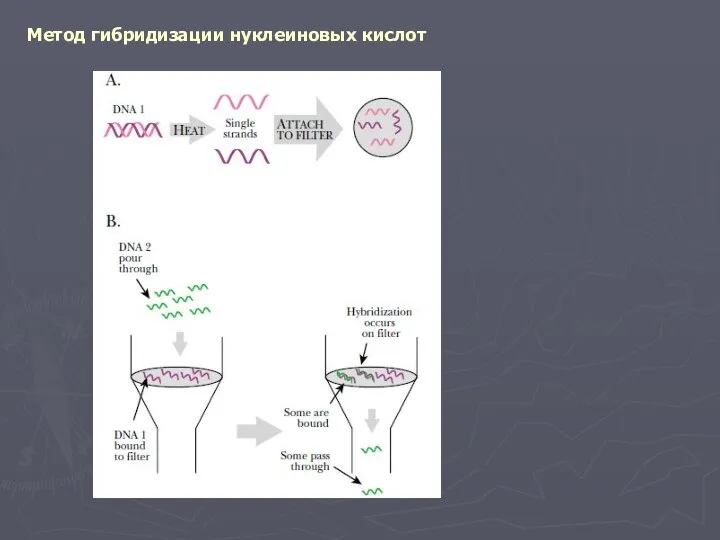
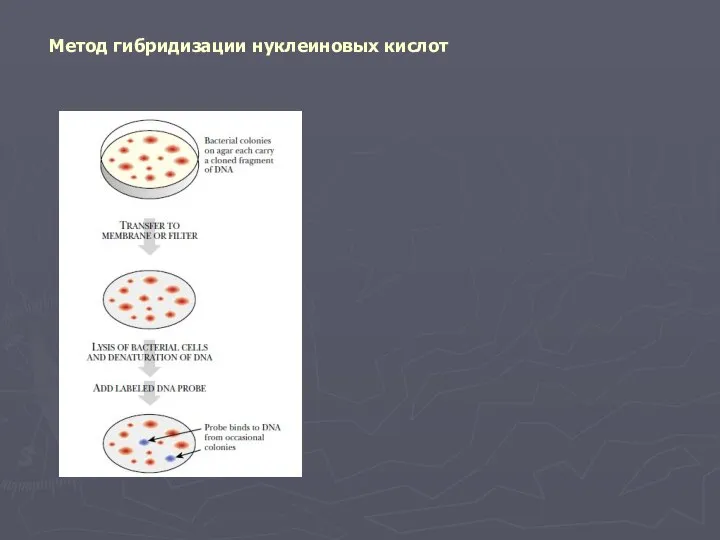
- 8. Метод гибридизации нуклеиновых кислот
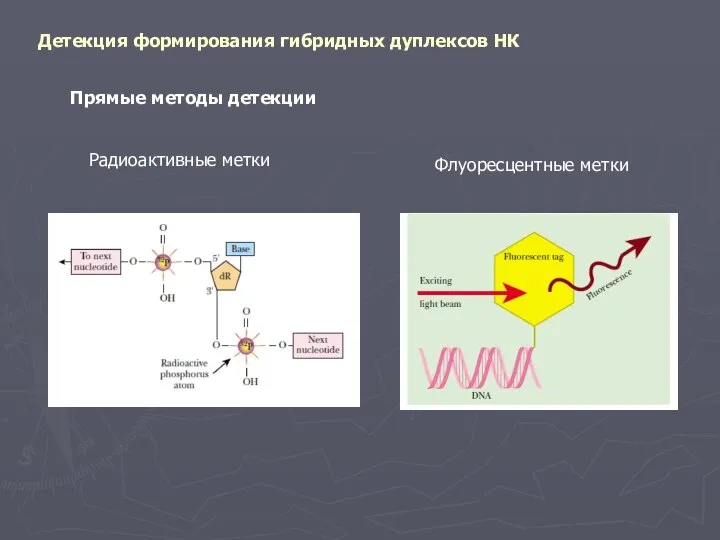
- 9. Детекция формирования гибридных дуплексов НК Прямые методы детекции Радиоактивные метки Флуоресцентные метки
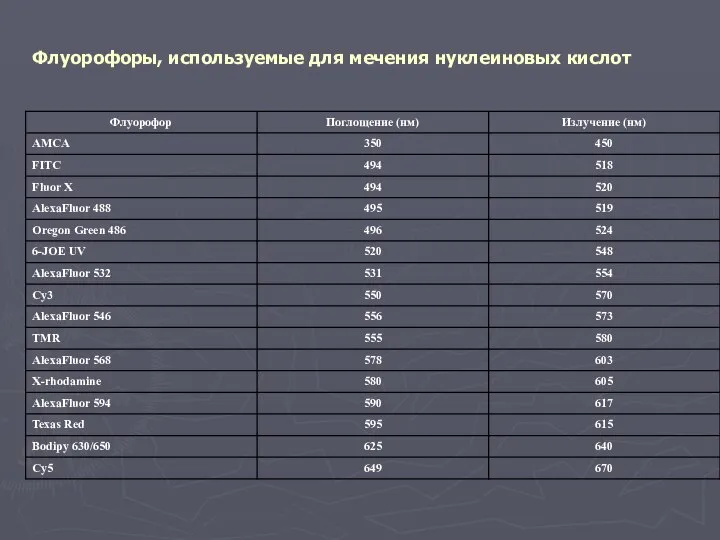
- 10. Флуорофоры, используемые для мечения нуклеиновых кислот
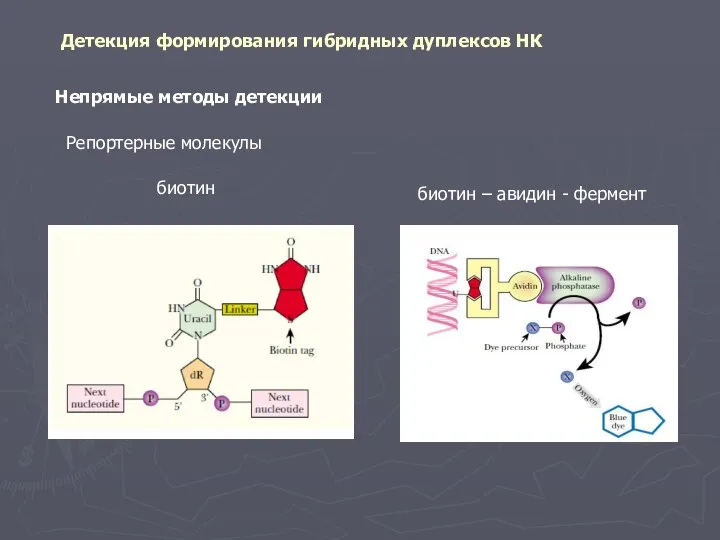
- 11. Непрямые методы детекции Детекция формирования гибридных дуплексов НК Репортерные молекулы биотин биотин – авидин - фермент
- 12. Метод гибридизации нуклеиновых кислот
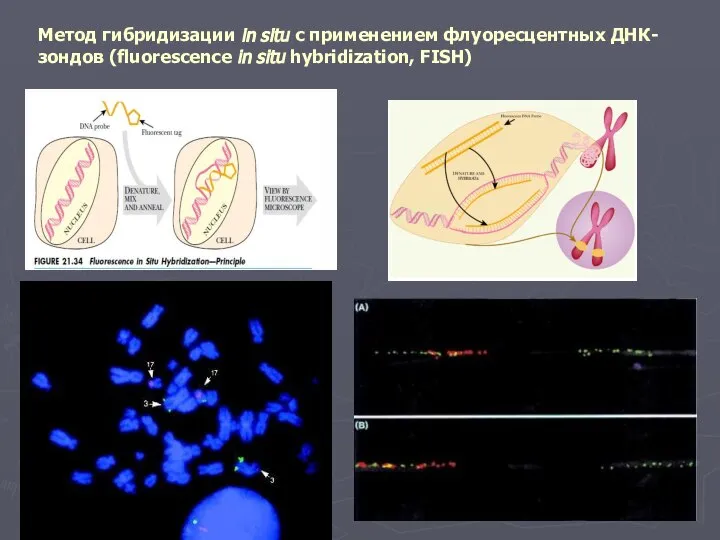
- 13. Метод гибридизации in situ с применением флуоресцентных ДНК-зондов (fluorescence in situ hybridization, FISH)
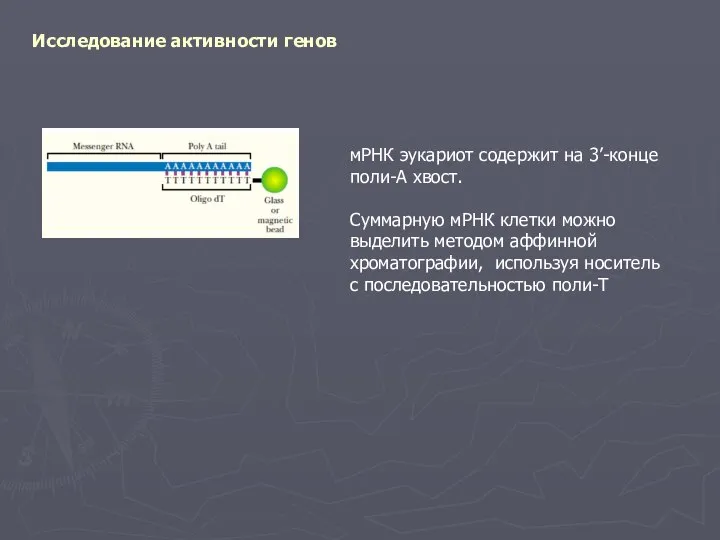
- 14. Исследование активности генов мРНК эукариот содержит на 3’-конце поли-А хвост. Суммарную мРНК клетки можно выделить методом
- 15. Исследование активности генов ДНК-микроматрицы и ДНК-биочипы
- 16. Исследование активности генов
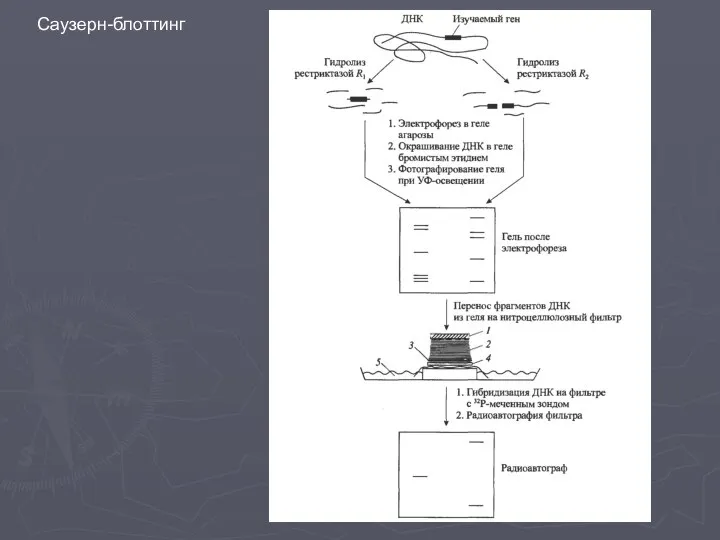
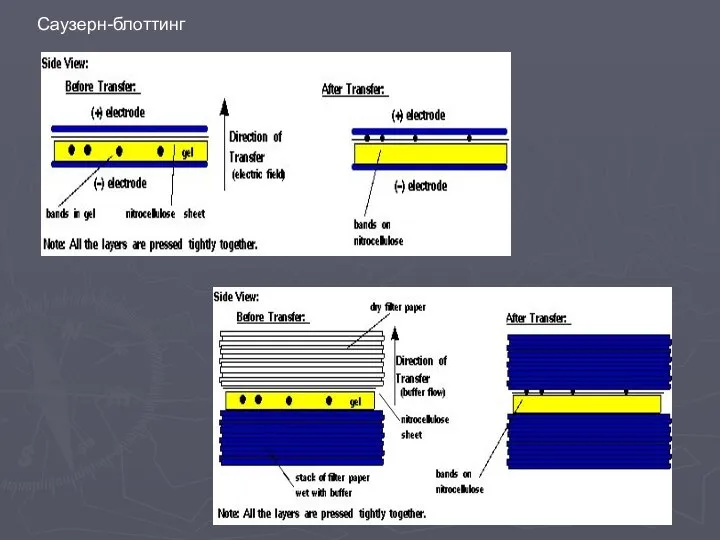
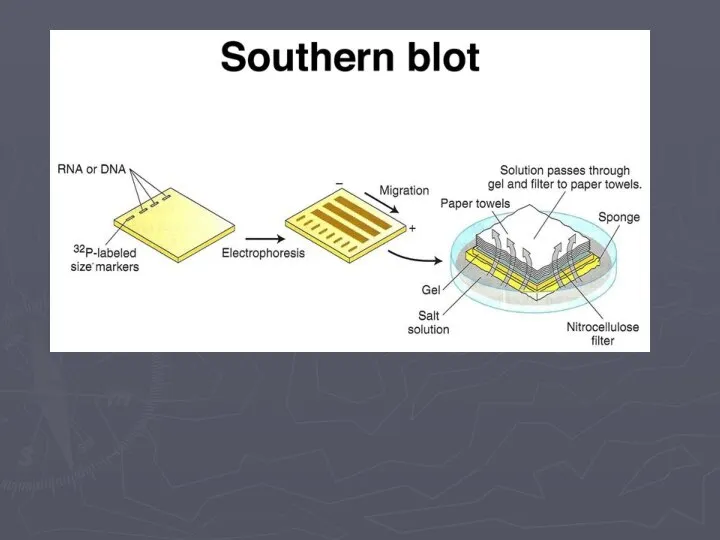
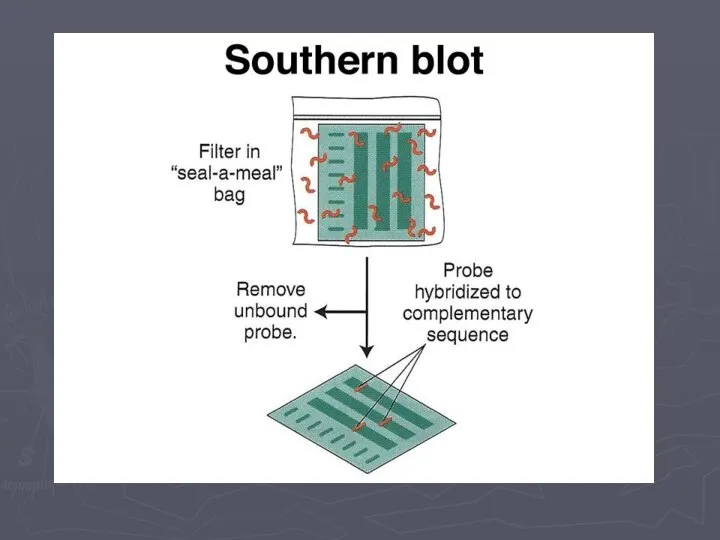
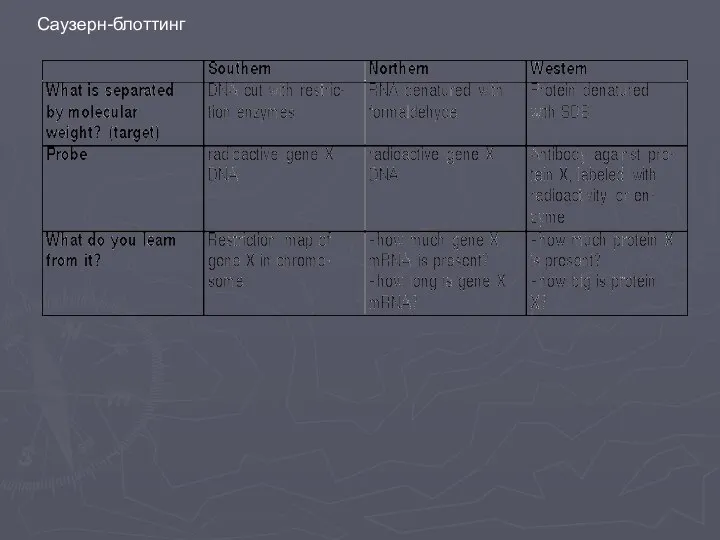
- 17. Саузерн-блоттинг
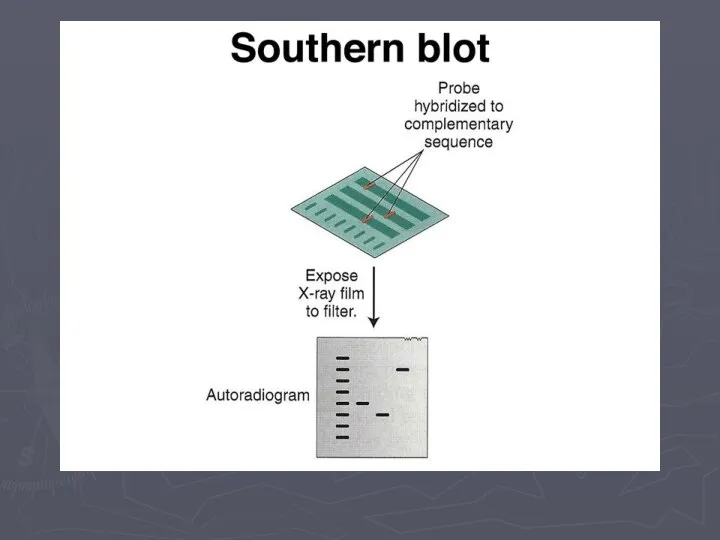
- 18. Саузерн-блоттинг
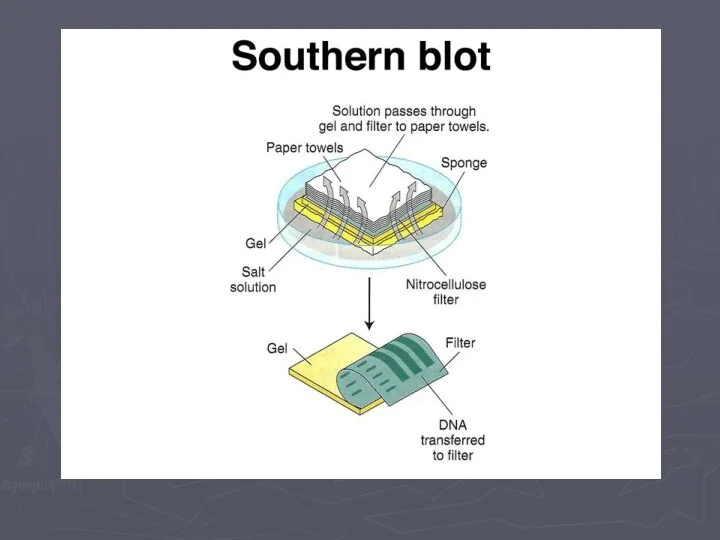
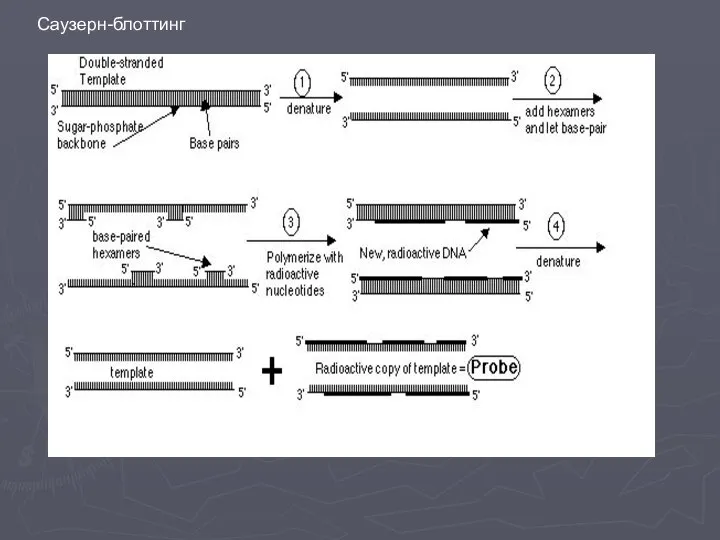
- 24. Саузерн-блоттинг
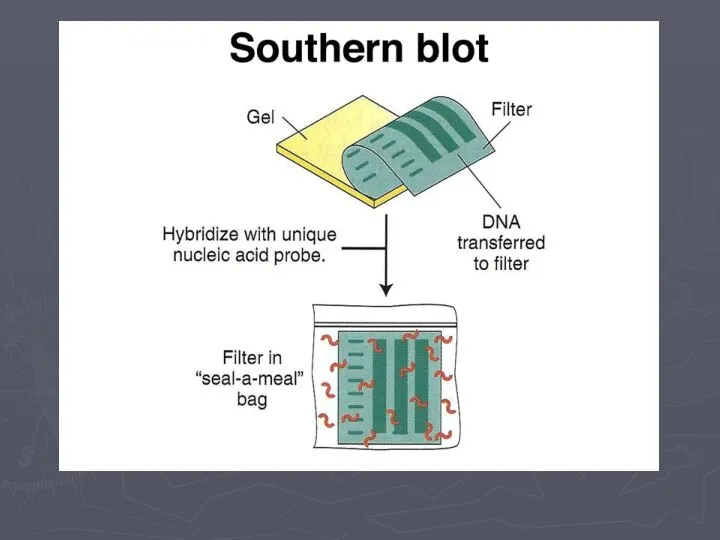
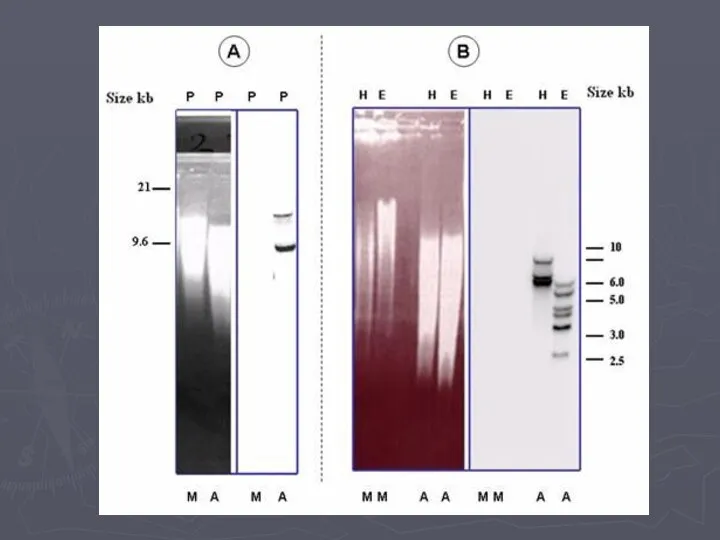
- 26. Саузерн-блоттинг
- 28. Скачать презентацию




 Биология – наука о жизни
Биология – наука о жизни Верхние челюстные кости
Верхние челюстные кости Презентация на тему Віруси. Пріони. Бактерії
Презентация на тему Віруси. Пріони. Бактерії  Переваривание и всасывание белков. Продукты белкового обмена
Переваривание и всасывание белков. Продукты белкового обмена Презентация на тему Ч. Дарвин и происхождение видов
Презентация на тему Ч. Дарвин и происхождение видов  Методы исследования генетики человека (число и тема в тетрадь)
Методы исследования генетики человека (число и тема в тетрадь) Культурные растения. Крыжовник
Культурные растения. Крыжовник Многообразие покрытосеменных
Многообразие покрытосеменных Строение рептилий
Строение рептилий Побег. Строение стебля
Побег. Строение стебля Растительный мир Песчанокопского района
Растительный мир Песчанокопского района Законы генетики
Законы генетики Семейство бобовые
Семейство бобовые Искусственные экосистемы
Искусственные экосистемы Млекопитающие самые сложноустроенные позвоночные животные, обитающие на суше, в воде и в почве
Млекопитающие самые сложноустроенные позвоночные животные, обитающие на суше, в воде и в почве Транспорт веществ у растений
Транспорт веществ у растений Растения эпифиты
Растения эпифиты Эндокринная система
Эндокринная система Как животные стали домашними
Как животные стали домашними Клеточная теория
Клеточная теория Морфофункциональная характеристика половых органов самцов (Лекция 5)
Морфофункциональная характеристика половых органов самцов (Лекция 5) Хламідомонада, хлорела - одноклітинні рослини (середовища існування, процеси життєдіяльності, будова, роль у природі)
Хламідомонада, хлорела - одноклітинні рослини (середовища існування, процеси життєдіяльності, будова, роль у природі) Процессы жизнедеятельности клетки
Процессы жизнедеятельности клетки Презентация на тему ГИГИЕНА ПИТАНИЯ
Презентация на тему ГИГИЕНА ПИТАНИЯ  Многообразие кольчатых червей
Многообразие кольчатых червей Пластиды (хлоропласты, хромопласты, лейкопласты)
Пластиды (хлоропласты, хромопласты, лейкопласты) Цитологические основы размножения
Цитологические основы размножения Расы человека
Расы человека