Содержание
- 2. Посевы для выявление S.aureus в определенной навеске продукта. Первый этап: Навеску или разведение навески продукта вносят
- 3. Второй этап: Из жидкой среды после инкубирования делают пересев на поверхность одной из плотных селективно-диагностичесиких сред.
- 4. На желточно-солевом агаре колонии S. аureus растут в виде колоний кремового или различных оттенков желтого цвета,
- 5. Селективный бульон Giolitti и Cantoni (Merck) для выявления стафилококков из пищевой продукции. Стафилококки выявляются по почернению
- 6. Агар Baird Parker (с плазмой кролика )- Staphilоcoccus aureus растет в виде черно-серых или черных колоний
- 7. Третий этап: подтверждение принадлежности характерных колоний к S. аureus. Для подтверждления принадлежности характерных колоний к S.
- 8. Постановка реакции плазмокоагуляции. К плазме кролика, приготовленной и разлитой по пробиркам, добавляют по 1 петле испытуемых
- 9. Плазма свернулась, реакция положительная Реакцию плазмокоагуляции оценивают как положительную даже при образовании небольшого компактного сгустка.
- 10. Способность S.aureus ферментировать мальтозу в анаэробных условиях. Определяют с целью дифференциации S.aureus от других коагулазоположительных видов
- 11. Если в посевах обнаружены грамположительные кокки, способные коагулировать плазму кролика, образующие каталазу, ферментирующие мальтозу в анаэробных
- 12. Для биохимической идентификации S.aureus допускается пользоваться биохимическими микротестами API Staph. Стрип API Staph состоит из 20
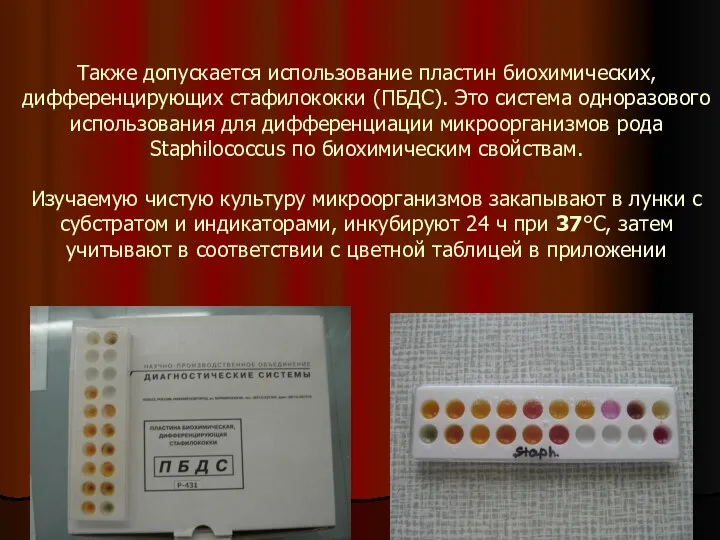
- 13. Также допускается использование пластин биохимических, дифференцирующих стафилококки (ПБДС). Это система одноразового использования для дифференциации микроорганизмов рода
- 14. Способ определения кол-ва S.aureus посевом в жидкие питательные среды основан на методе НВЧ. Для этого три
- 15. После инкубирования посевов выбирают три самых высоких последовательных разведения, в первом из которых во всех трех
- 16. Если все пробирки посеянных разведений окажутся отрицательными, (0, 0, 0), то НВЧ микроорганизмов будет ниже числа,
- 18. Скачать презентацию














 Красная книга Растения России
Красная книга Растения России Қан. Анизоцитоз
Қан. Анизоцитоз Обмен веществ и энергии
Обмен веществ и энергии Обмен веществ и энергии
Обмен веществ и энергии Функции нервной системы. Строение нейрона
Функции нервной системы. Строение нейрона Строение растительной и животной клеток
Строение растительной и животной клеток Минеральные удобрения. Влияние минеральных удобрений на рост и развитие растений
Минеральные удобрения. Влияние минеральных удобрений на рост и развитие растений Основные законы Менделя
Основные законы Менделя Спортивная физиология. Физиология дыхания
Спортивная физиология. Физиология дыхания Африканские слоны
Африканские слоны Ферменты. Местонахождение ферментов в организме
Ферменты. Местонахождение ферментов в организме Презентация на тему Спинной мозг
Презентация на тему Спинной мозг  Селекция. Порода, сорт, штамм
Селекция. Порода, сорт, штамм Бактерии: строение и жизнедеятельность
Бактерии: строение и жизнедеятельность Витамины значение в здоровом питании
Витамины значение в здоровом питании Уход за комнатными растениями
Уход за комнатными растениями Виды корней. Типы корневых систем (часть 1)
Виды корней. Типы корневых систем (часть 1) Сердечно-сосудистая система. Лекция 8
Сердечно-сосудистая система. Лекция 8 Физиология, которая нас окружает
Физиология, которая нас окружает Когда были открыты витамины
Когда были открыты витамины Формы размножения организмов. Типы бесполого размножения. Половое размножение
Формы размножения организмов. Типы бесполого размножения. Половое размножение Строение нейрона. Рефлекс
Строение нейрона. Рефлекс Силы в природе
Силы в природе Og|hidrāti un to nozīme. Monosaharīdi
Og|hidrāti un to nozīme. Monosaharīdi Физиология пищеварения в желудке
Физиология пищеварения в желудке Деревья - очистители воздуха
Деревья - очистители воздуха Ароморфозы в девонский и каменноугольный период
Ароморфозы в девонский и каменноугольный период Венерина мухоловка
Венерина мухоловка