Содержание
- 2. Введение Живая природа подчиняется иерархической организации. Иерархический принцип организации позволяет выделить в живой природе отдельные уровни,
- 3. Микроскоп - (от греческого mikros - малый и skopeo - смотрю), оптический прибор для получения увеличенного
- 5. Световая микроскопия. Устройство светового микроскопа Изучение препарата осуществляется в проходящем свете с помощью светового микроскопа. Источник
- 6. Основными частями светового микроскопа являются объектив и окуляр, заключенные в цилиндрический корпус – тубус. Большинство моделей,
- 7. Основание микроскопа Тубусодержатель Тубус Окуляр (чаще ×10) Револьвер микроскопа Объективы а) сухие: ×10, ×20, ×40 б)
- 8. Характеристики оптического микроскопа К основным характеристикам микроскопа относятся увеличение и разрешающая способность. Общее увеличение, которое дает
- 9. Электронная микроскопия. Устройство электронного микроскопа Электронный микроскоп — прибор, позволяющий получать изображение объектов с максимальным увеличением
- 10. Электронный микроскоп состоит из электронной пушки (устройства для получения пучка электронов) и системы электромагнитных линз, размещенных
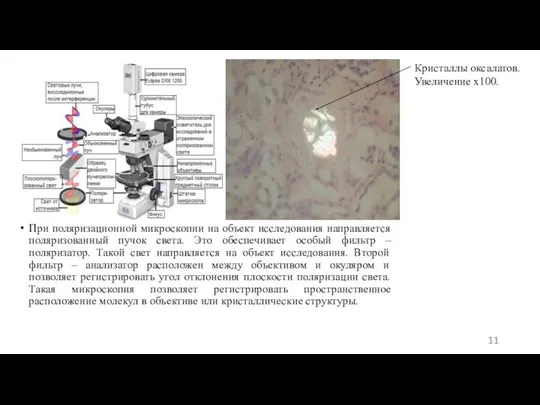
- 11. При поляризационной микроскопии на объект исследования направляется поляризованный пучок света. Это обеспечивает особый фильтр – поляризатор.
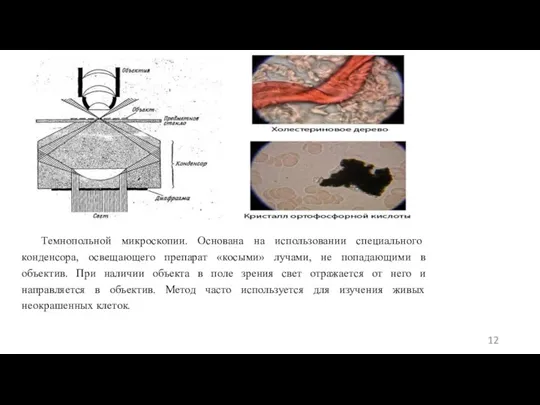
- 12. Темнопольной микроскопии. Основана на использовании специального конденсора, освещающего препарат «косыми» лучами, не попадающими в объектив. При
- 13. Метод фазово-контрастной микроскопии служит для получения контрастных изображений прозрачных и бесцветных объектов. Даже при очень малых
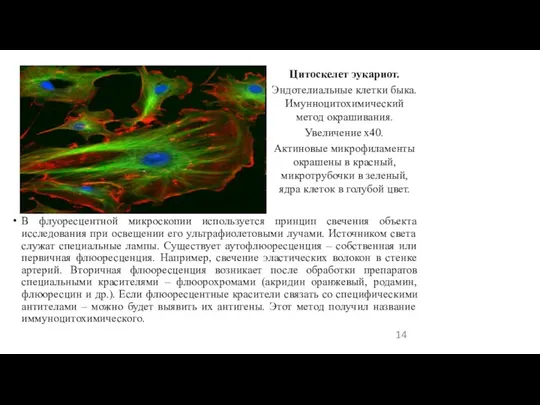
- 14. В флуоресцентной микроскопии используется принцип свечения объекта исследования при освещении его ультрафиолетовыми лучами. Источником света служат
- 15. Правила работы с микроскопом Установите микроскоп слева, штативом к себе; Поставьте в рабочее положение объектив малого
- 16. Поверхностный аппарат клетки
- 17. Определение клетки, ее компоненты Клетка - целостная элементарная система, способная к самовоспроизведению и саморегуляции метаболических процессов.
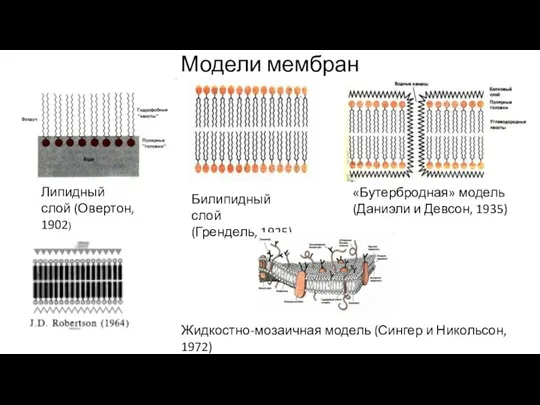
- 18. Модели мембран Липидный слой (Овертон, 1902) Билипидный слой (Грендель, 1925) «Бутербродная» модель (Даниэли и Девсон, 1935)
- 19. Поверхностный аппарат клетки
- 20. Плазматическая мембрана образована белками (-60%) и липидами (-40%). В состав липидов входят гликолипиды, стеролы, но наиболее
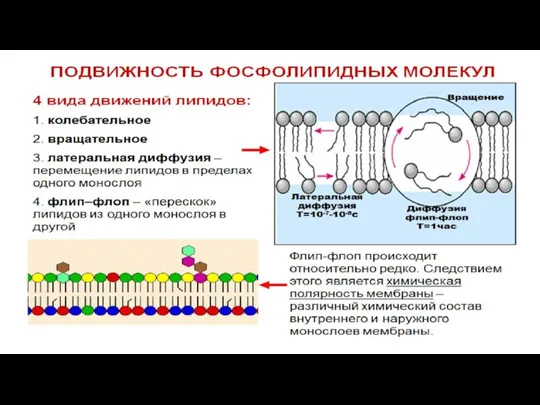
- 21. Свойства плазматической мембраны Способность к самосборке. После разрушающих воздействий мембрана способна восстановить свою структуру, т.к. молекулы
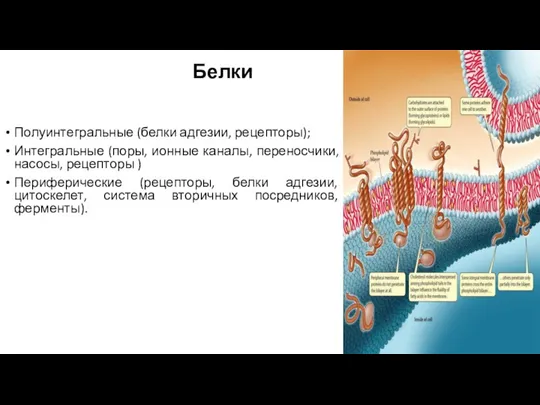
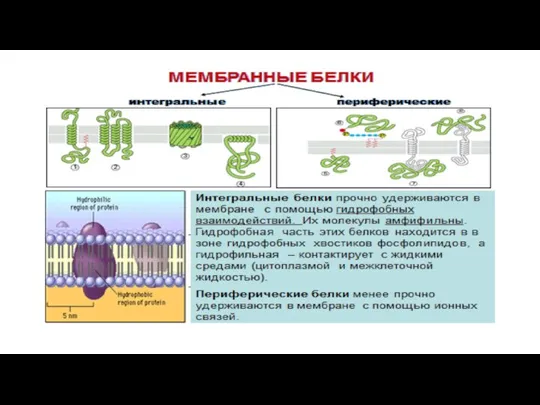
- 23. Белки Полуинтегральные (белки адгезии, рецепторы); Интегральные (поры, ионные каналы, переносчики, насосы, рецепторы ) Периферические (рецепторы, белки
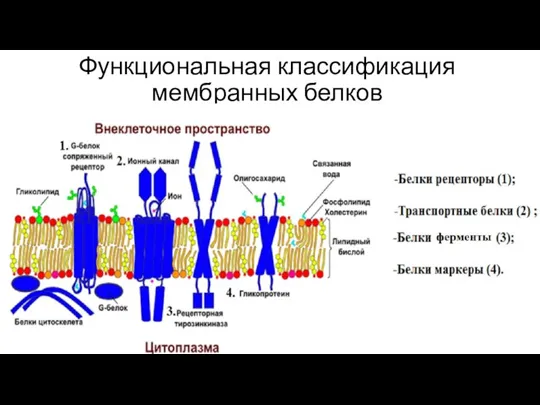
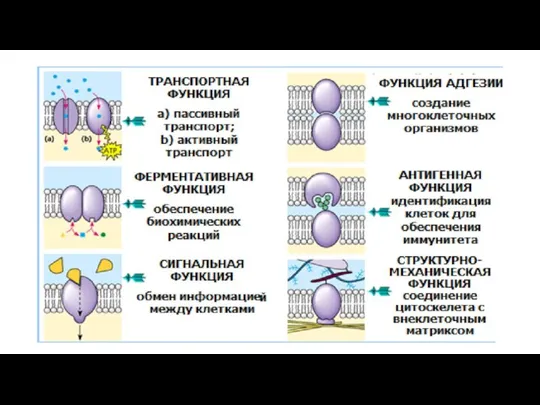
- 25. Функциональная классификация мембранных белков
- 27. Липиды мембраны Большинство липидов в мембранах млекопитающих представлены фосфолипидами, гликосфинголипидами и холестеролом. Фосфолипиды в составе мембран
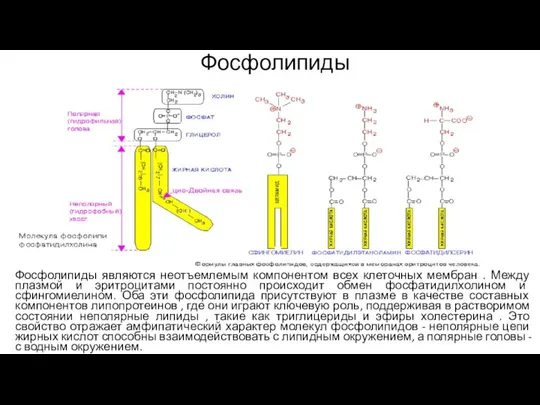
- 28. Фосфолипиды Фосфолипиды являются неотъемлемым компонентом всех клеточных мембран . Между плазмой и эритроцитами постоянно происходит обмен
- 29. Гликолипиды Гликолипиды составляют 5% липидных молекул наружного монослоя и сильно различаются у разных видов и даже
- 30. Холестерин Холестерин - это стерин, содержащий стероидное ядро из четырех колец и гидроксильную группу. Холестерин содержится
- 32. ВЛИЯНИЕ ХИМИЧЕСКОГО СОСТАВА Зависимость свойств мембраны от химического состава называется лиотропным полиморфизмом. Ненасыщенных жирные кислоты способствуют
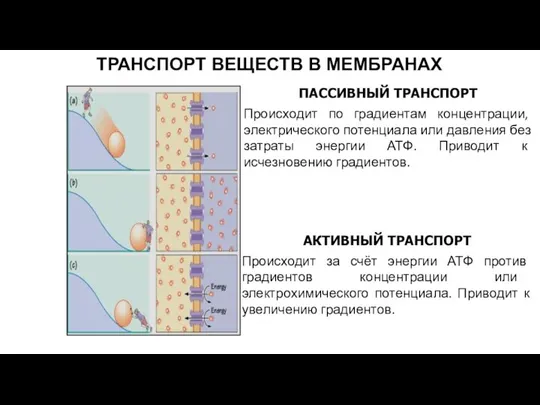
- 33. ТРАНСПОРТ ВЕЩЕСТВ В МЕМБРАНАХ
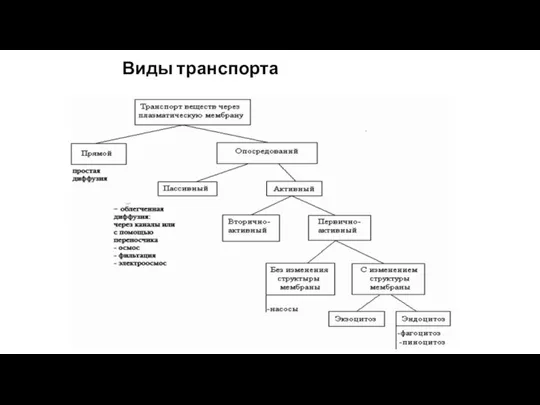
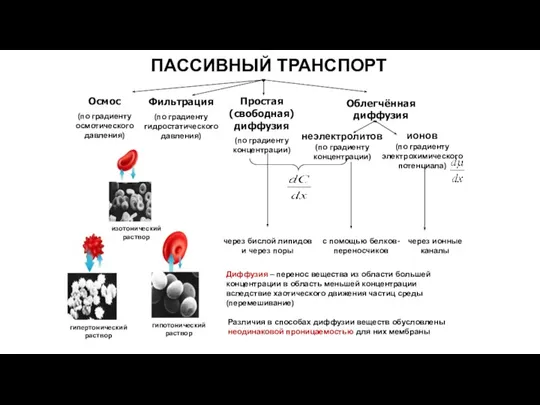
- 34. Виды транспорта
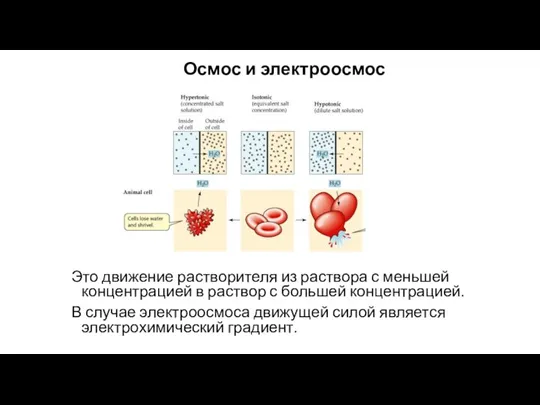
- 36. Осмос и электроосмос Это движение растворителя из раствора с меньшей концентрацией в раствор с большей концентрацией.
- 37. Фильтрация Это движение растворителя под действием гидростатического давления
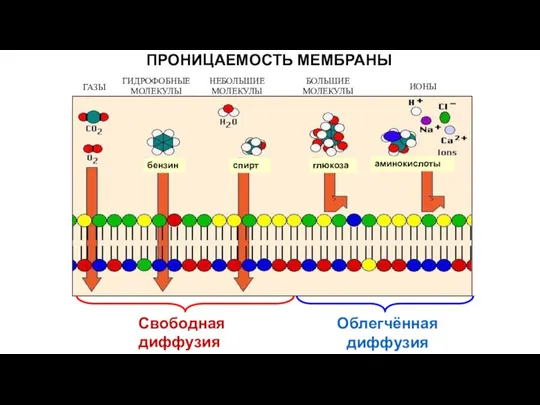
- 38. ПРОНИЦАЕМОСТЬ МЕМБРАНЫ Свободнаядиффузия Облегчённая диффузия
- 39. Простая диффузия Линейно зависит от градиента концентрации вещества; Характеризуется ненасыщаемостью.
- 40. Простая диффузия осуществляется через: Мембрану (для незаряженных жирорастворимых) веществ; Поры; Кинки.
- 41. Простая диффузия идет через кинки При повышении температуры тепловая подвижность жирнокислотных цепей приводит к спонтанному возникновению
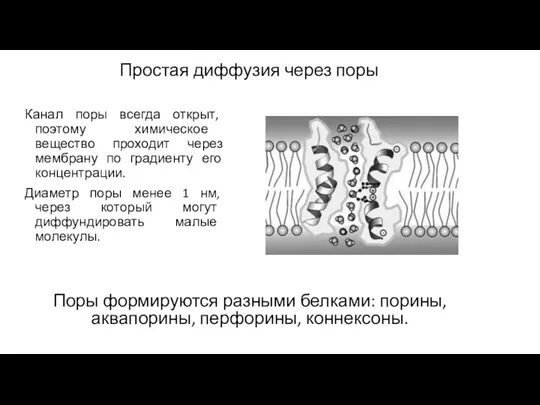
- 42. Простая диффузия через поры Канал поры всегда открыт, поэтому химическое вещество проходит через мембрану по градиенту
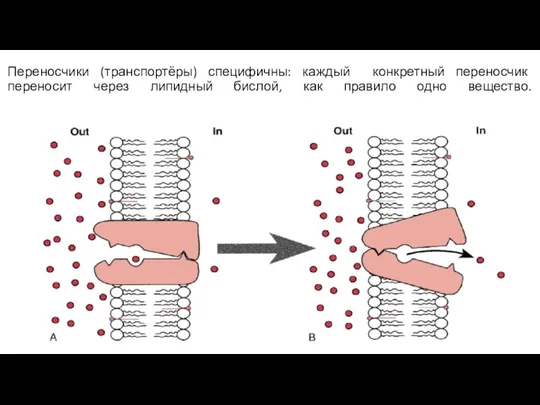
- 43. Переносчики (транспортёры) специфичны: каждый конкретный переносчик переносит через липидный бислой, как правило одно вещество.
- 44. ЭЛЕКТРОДИФФУЗИЯ ;
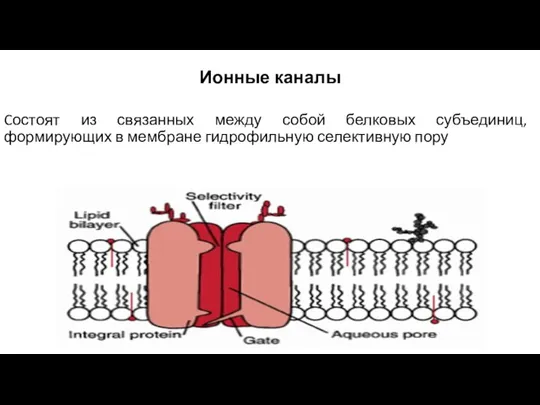
- 45. Ионные каналы Cостоят из связанных между собой белковых субъединиц, формирующих в мембране гидрофильную селективную пору
- 46. Свойства ионных каналов Специфичность Проводимость Наличие сенсора Наличие воротной системы
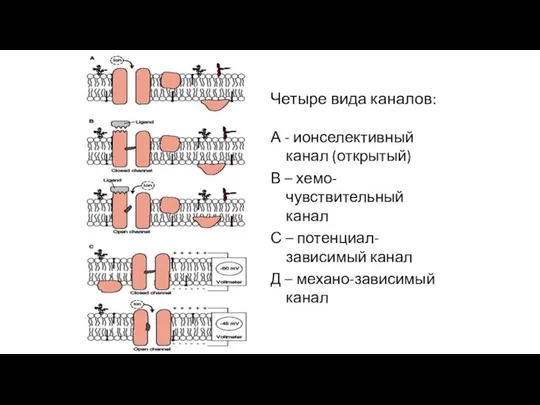
- 47. Четыре вида каналов: А - ионселективный канал (открытый) В – хемо-чувствительный канал С – потенциал-зависимый канал
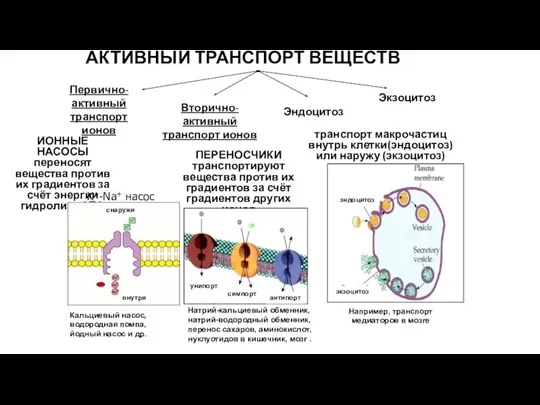
- 48. ИОННЫЕ НАСОСЫ переносят вещества против их градиентов за счёт энергии гидролиза АТФ ПЕРЕНОСЧИКИ транспортируют вещества против
- 49. Активный транспорт Осуществляется против электрохимического градиента Система в высшей степени специфична Необходимы источники энергии в виде
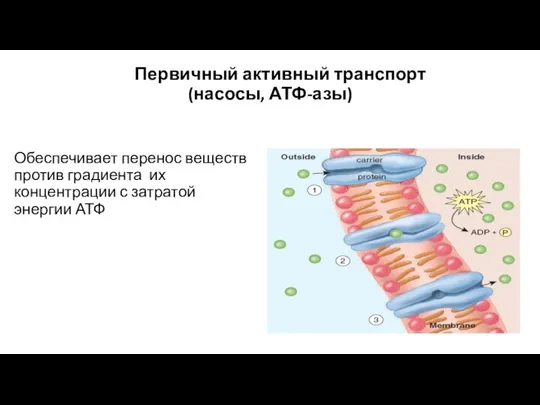
- 50. Первичный активный транспорт (насосы, АТФ-азы) Обеспечивает перенос веществ против градиента их концентрации с затратой энергии АТФ
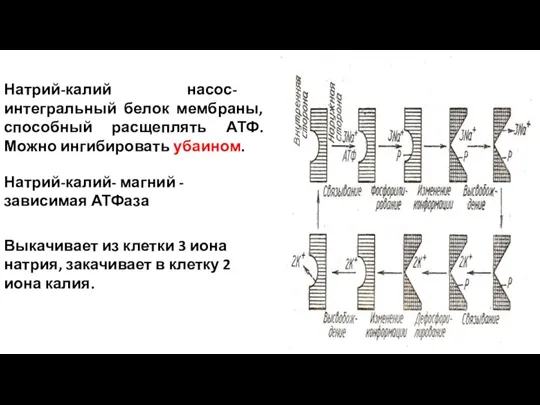
- 51. Натрий-калий- магний - зависимая АТФаза Натрий-калий насос- интегральный белок мембраны, способный расщеплять АТФ. Можно ингибировать убаином.
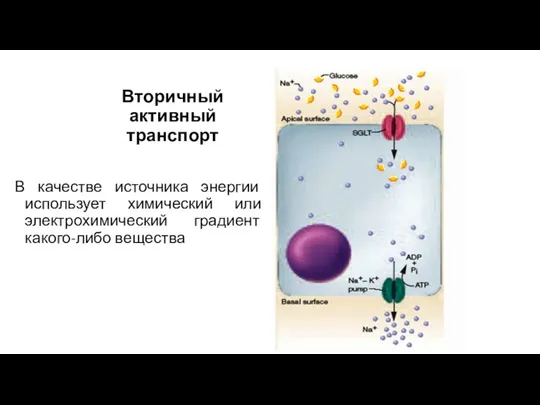
- 52. Вторичный активный транспорт В качестве источника энергии использует химический или электрохимический градиент какого-либо вещества
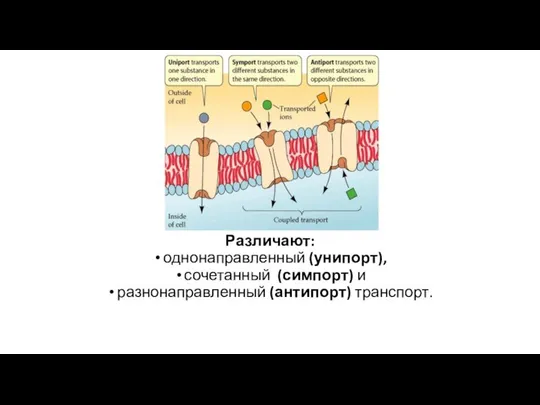
- 53. Различают: однонаправленный (унипорт), сочетанный (симпорт) и разнонаправленный (антипорт) транспорт.
- 54. Эндоцитоз Образуется окаймленная везикула (3), Везикула сливается с эндосомой(4). Вакуоль и ее содержимое претерпевают превращения (5),
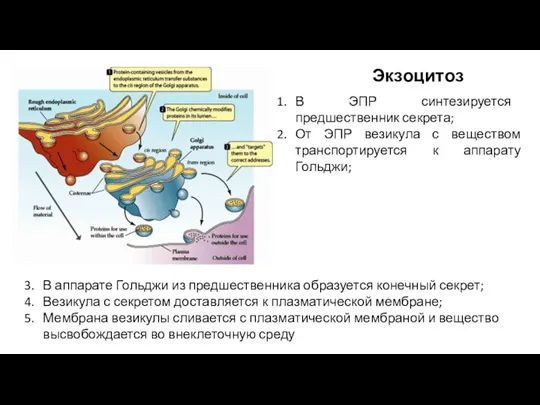
- 55. Экзоцитоз В аппарате Гольджи из предшественника образуется конечный секрет; Везикула с секретом доставляется к плазматической мембране;
- 56. Рецепторная функция. Постоянные межклеточные контакты. Цитоскелет
- 57. Этапы проведения сигнала 1) Прием сигнала (рецепция) 2) Обработка и передача сигнала (системы сигнальных путей /
- 58. Стимулы (информация, приходящая к клетке) 1) Высокоаффинные лиганды (связываются с рецептором высокоаффинно и высокоселективно) 2) Малоспецифичные
- 59. Ответы клетки Влияние на пролиферацию (стимуляция деления клеток / блок клеточного цикла); Влияние на апоптоз (стимуляция
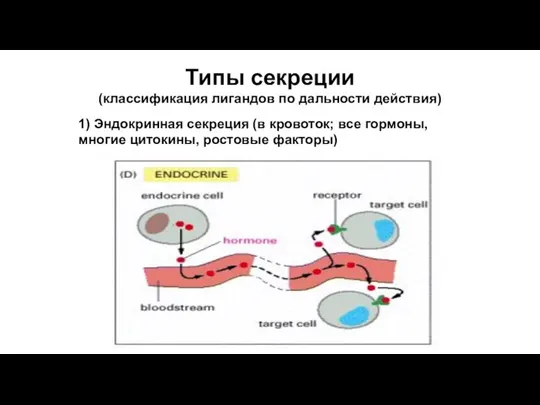
- 60. Типы секреции (классификация лигандов по дальности действия) 1) Эндокринная секреция (в кровоток; все гормоны, многие цитокины,
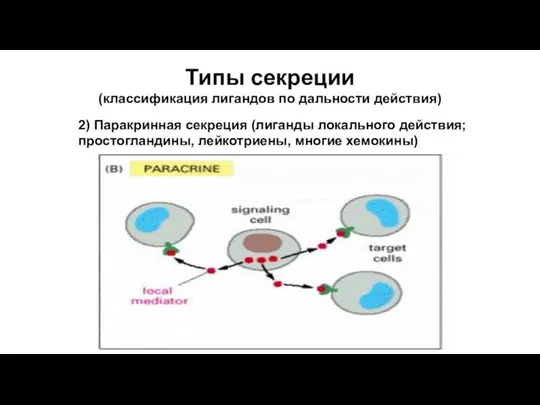
- 61. Типы секреции (классификация лигандов по дальности действия) 2) Паракринная секреция (лиганды локального действия; простогландины, лейкотриены, многие
- 62. Типы секреции (классификация лигандов по дальности действия) 3) Аутокринная секреция (действие на ту же клетку или
- 63. Типы секреции (классификация лигандов по дальности действия) 4) Юкстакринная, или зависимая от контактов секреция (jucstacrine; лиганды
- 64. Типы секреции (классификация лигандов по дальности действия) 5) Секреция компонентов внеклеточного матрикса (нерастворимые лиганды рецептируются контактами
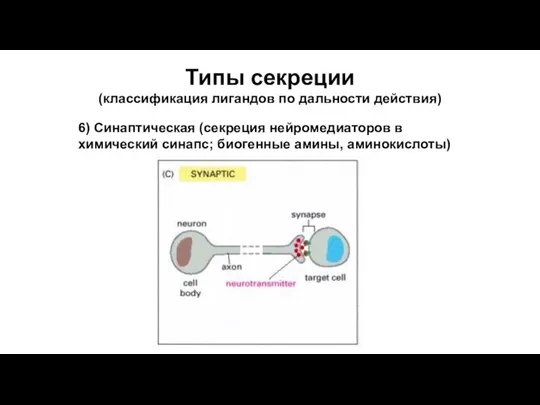
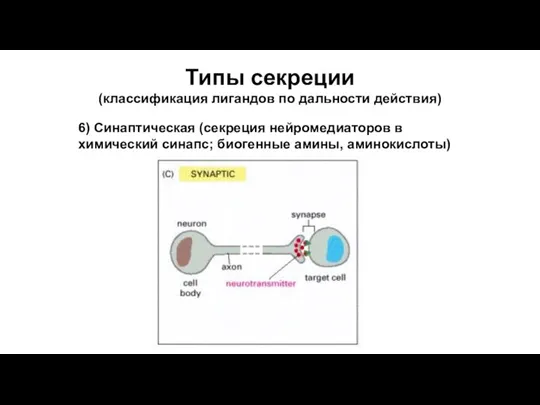
- 65. Типы секреции (классификация лигандов по дальности действия) 6) Синаптическая (секреция нейромедиаторов в химический синапс; биогенные амины,
- 66. Типы секреции (классификация лигандов по дальности действия) 7) Секреция через щелевые контакты (gap junctions; обмен внутриклеточными
- 67. Типы секреции (классификация лигандов по дальности действия) 6) Синаптическая (секреция нейромедиаторов в химический синапс; биогенные амины,
- 68. Клетки могут взаимодействовать друг с другом по средствам: На расстоянии через секрецию определенных веществ; Через сигнальные
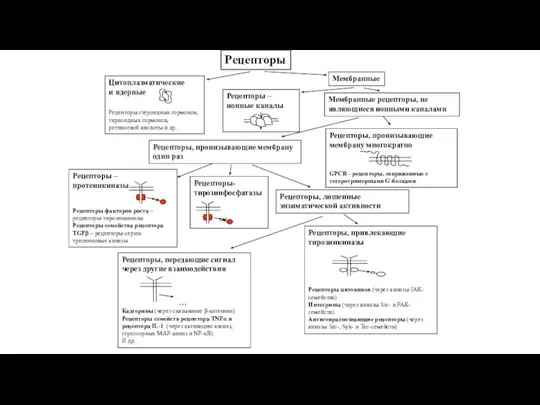
- 69. Рецепторы
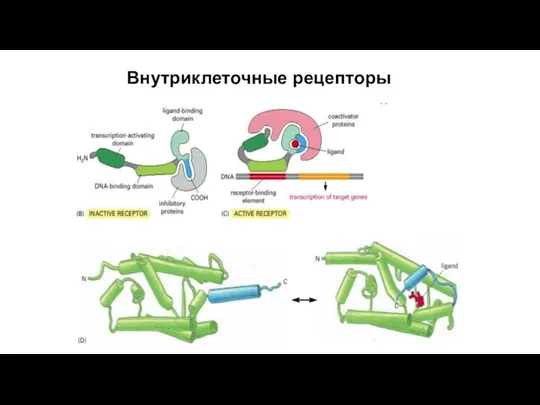
- 70. Внутриклеточные рецепторы
- 71. Цикл работы рецептора связанного с G-белком Субъединица альфа умеет расщеплять ГТФ. В активированном состоянии взаимодействует с
- 72. Мембранно-внутриклеточный механизм Вторичные посредники цАМФ - циклический аденозинмонофосфат; цГМФ - циклический гуанозинмонофосфат; ИФ3 - инозитол-3-фосфат; ДАГ
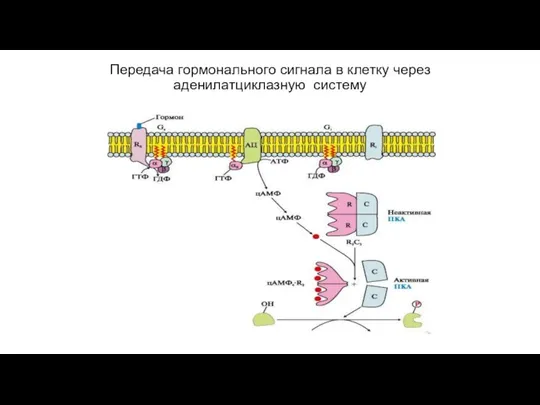
- 73. Вариант 1. (с участием аденилатциклазной системы) Вторичный посредник - цАМФ; Мембранно-связанный фермент - аденилатциклаза Гормон связывается
- 74. Передача гормонального сигнала в клетку через аденилатциклазную систему
- 75. Прекращение влияния цАМФ на процесс активации протеинкиназы А и, следовательно, фосфорилирования белков происходит под действием фосфодиэстеразы
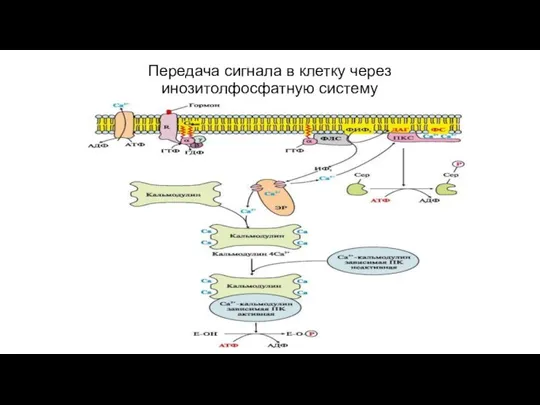
- 76. Вариант 2. (с участием инозитолфосфатной системы) Вторичные посредники- инозитол-3-фосфат (ИФ3), ДАГ Образуются путем гидролиза фосфолипида клеточной
- 77. Основные этапы передачи гормонального сигнала 1.Связывание гормона с рецептором меняется конформация рецептора. 2.Изменение конформации соответствующего G-белка,
- 78. Передача сигнала в клетку через инозитолфосфатную систему
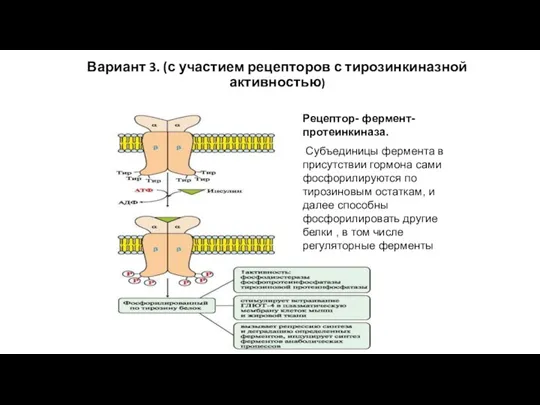
- 79. Вариант 3. (с участием рецепторов с тирозинкиназной активностью) Рецептор- фермент- протеинкиназа. Субъединицы фермента в присутствии гормона
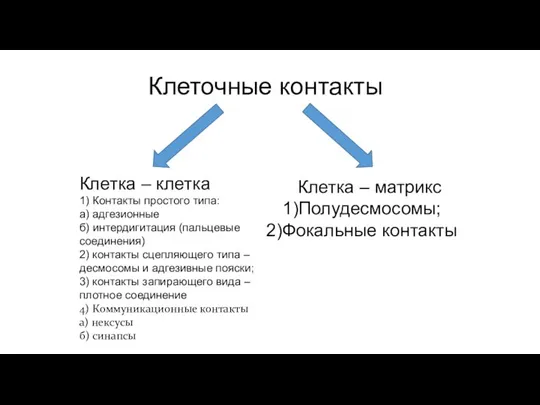
- 80. Клеточные контакты Клетка – клетка 1) Контакты простого типа: а) адгезионные б) интердигитация (пальцевые соединения) 2)
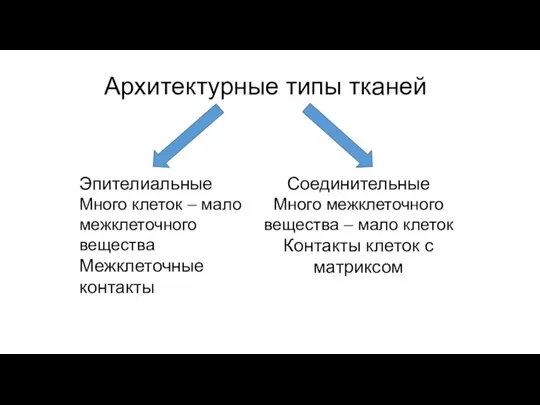
- 81. Архитектурные типы тканей Эпителиальные Много клеток – мало межклеточного вещества Межклеточные контакты Соединительные Много межклеточного вещества
- 82. Общая схема строения клеточных контактов Межклеточные контакты образуются по следующей схеме: Элемент цитоскелета (актиновые- или промежуточные
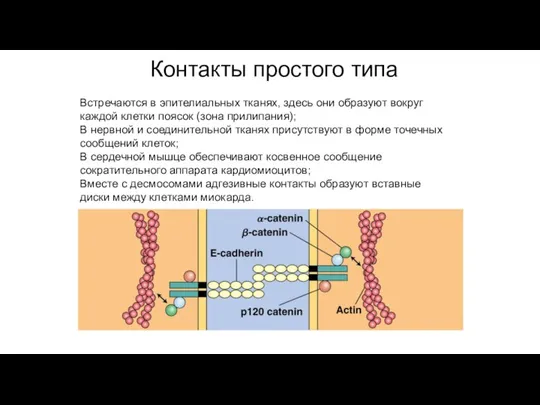
- 83. Контакты простого типа Адгезионные соединения Это простое сближение плазмолемм соседних клеток на расстояние 15-20 нм без
- 84. Интердигитация (пальцевидное соединение) (№ 2 на рисунке) представляет собой контакт, при котором плазмолемма двух клеток, сопровождая
- 85. Контакты простого типа Встречаются в эпителиальных тканях, здесь они образуют вокруг каждой клетки поясок (зона прилипания);
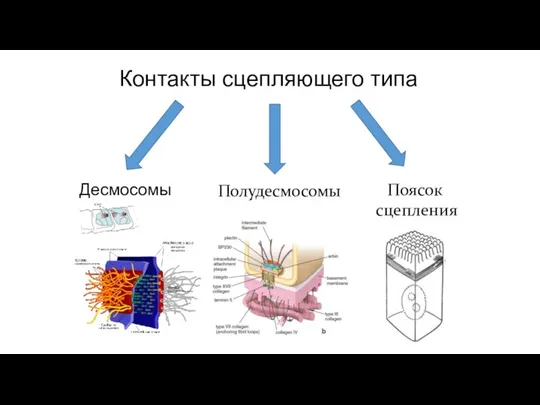
- 86. Контакты сцепляющего типа Десмосомы Полудесмосомы Поясок сцепления
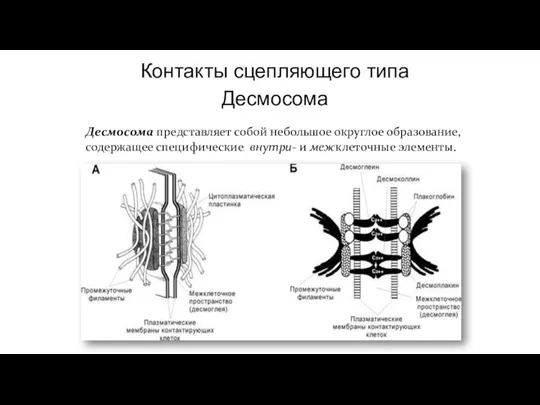
- 87. Контакты сцепляющего типа Десмосома Десмосома представляет собой небольшое округлое образование, содержащее специфические внутри- и межклеточные элементы.
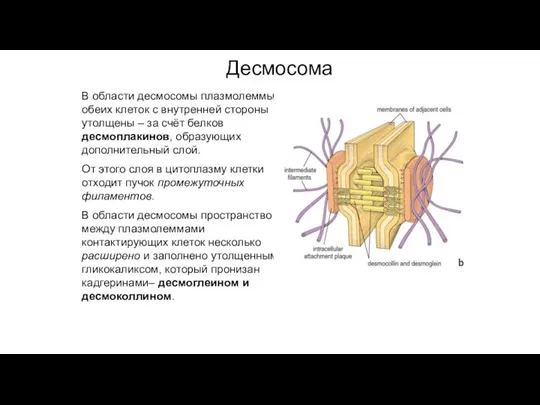
- 88. В области десмосомы плазмолеммы обеих клеток с внутренней стороны утолщены – за счёт белков десмоплакинов, образующих
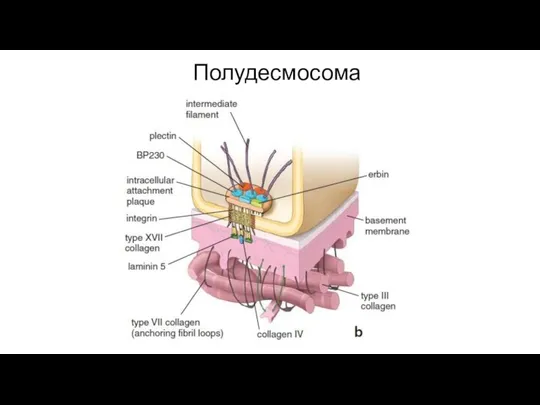
- 89. Полудесмосома Полудесмосома обеспечивает контакт клеток с базальной мембраной. По структуре гемидесмосомы напоминают десмосомы и тоже содержат
- 90. Полудесмосома
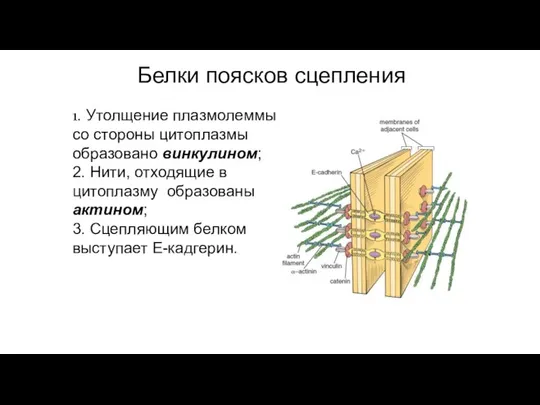
- 91. Поясок сцепления Адгезивный поясок, (поясок сцепления, поясная десмосома) (zonula adherens), – парное образование в виде лент,
- 92. Белки поясков сцепления 1. Утолщение плазмолеммы со стороны цитоплазмы образовано винкулином; 2. Нити, отходящие в цитоплазму
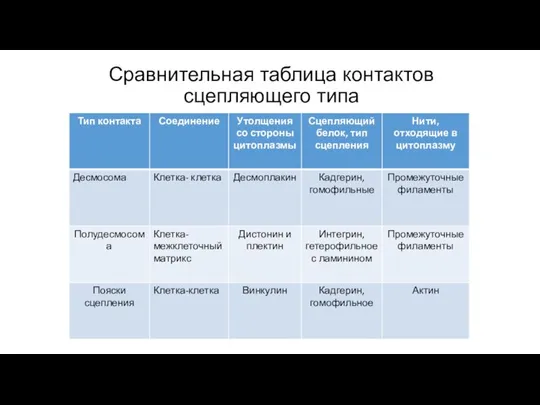
- 93. Сравнительная таблица контактов сцепляющего типа
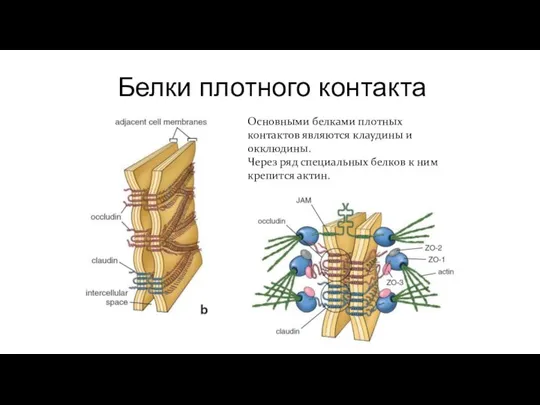
- 94. Контакт запирающего типа Плотный контакт Плазмолеммы клеток прилегают друг к другу вплотную, сцепляясь с помощью специальных
- 95. Белки плотного контакта Основными белками плотных контактов являются клаудины и окклюдины. Через ряд специальных белков к
- 96. Контакты коммуникационного типа Щелевидные соединения (нексусы, электрические синапсы, эфапсы) Нексус имеет форму круга диаметром 0,5-0,3 мкм.
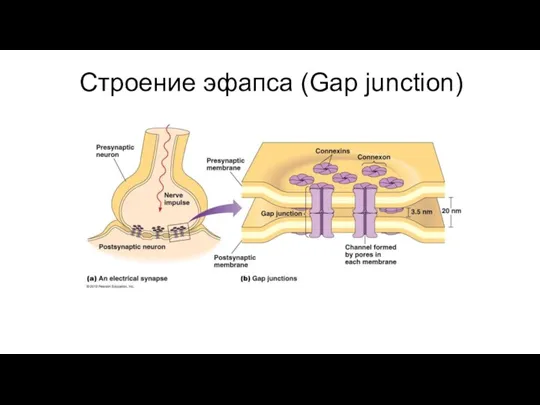
- 97. Строение эфапса (Gap junction)
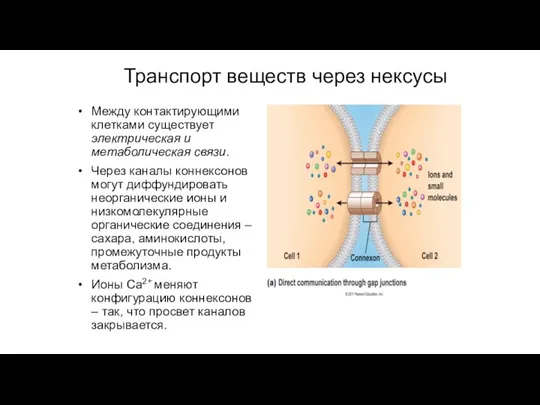
- 98. Между контактирующими клетками существует электрическая и метаболическая связи. Через каналы коннексонов могут диффундировать неорганические ионы и
- 99. Контакты коммуникационного типа Синапсы Синапсы служат для передачи сигнала от одних возбудимых клеток к другим. В
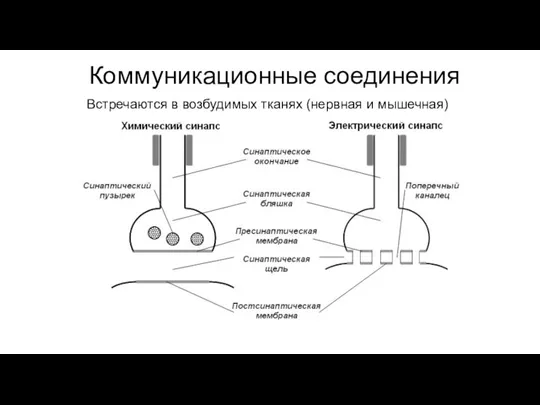
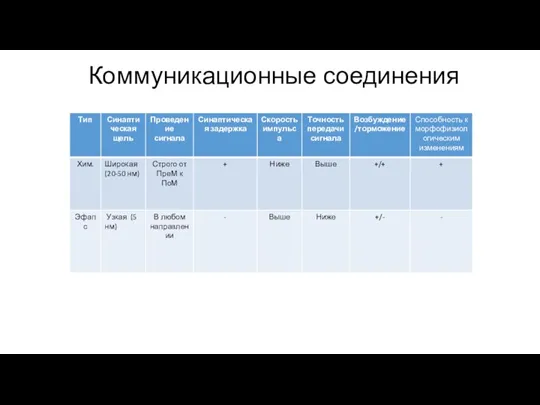
- 100. Коммуникационные соединения Встречаются в возбудимых тканях (нервная и мышечная)
- 101. Коммуникационные соединения
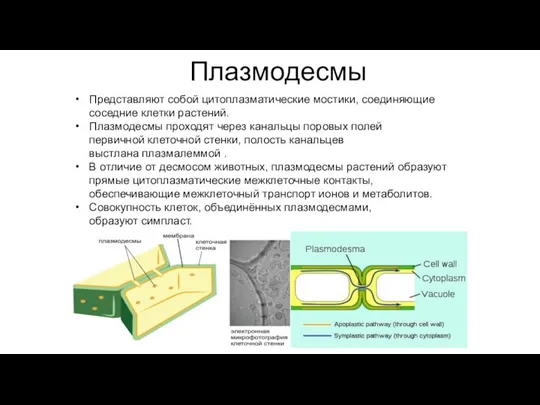
- 102. Плазмодесмы Представляют собой цитоплазматические мостики, соединяющие соседние клетки растений. Плазмодесмы проходят через канальцы поровых полей первичной
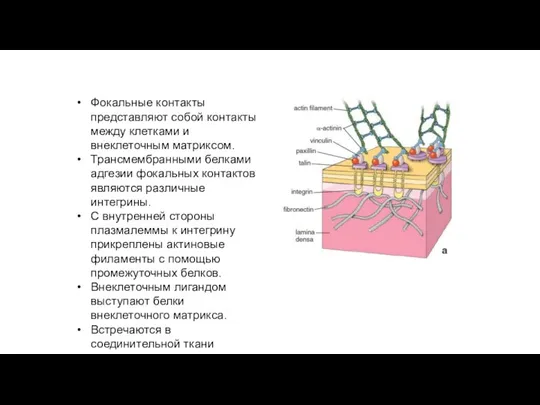
- 103. Фокальные контакты клеток Фокальные контакты представляют собой контакты между клетками и внеклеточным матриксом. Трансмембранными белками адгезии
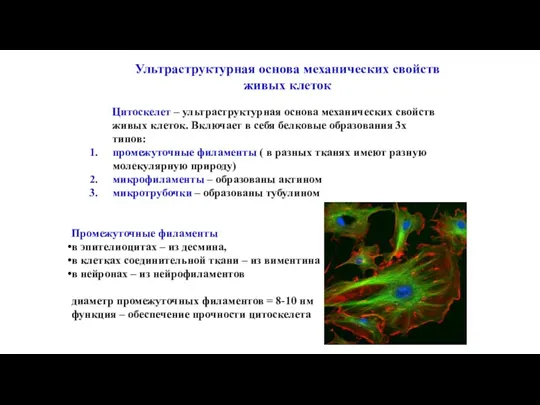
- 104. Ультраструктурная основа механических свойств живых клеток Цитоскелет – ультраструктурная основа механических свойств живых клеток. Включает в
- 106. Саркомер – элементарная надмолекулярная сократительная единица мышечного волокна. Соседние саркомеры соединяются друг с другом белком десмином
- 107. Саркомер состоит из тонких (актиновых) и толстых (миозиновых) филаментов, которые называют протофибриллами. В 1 миофибрилле содержится
- 108. На поперечном срезе саркомера нити актина и миозина образуют гексагональную структуру, в которой каждая миозиновая протофибрилла
- 109. Молекула тропомиозина занимает спиральный желобок между 2-я нитями F- актина, ге расположены активные центры, с которыми
- 110. Механизм мышечного сокращения После разблокирования активного цинтра актина с помощью ионов Ca2+ миозиновые головки взаимодействуют с
- 111. Максимальная сила сокращения пропорциональна мышцы пропорциональна взаимного перекрытия актиновых и миозиновых нитей. При уменьшении длины саркомера
- 112. При повышении физической нагрузки происходит гипертрофия миоцитов, т.к. это дифференцированные клетки, не способные к делению. Для
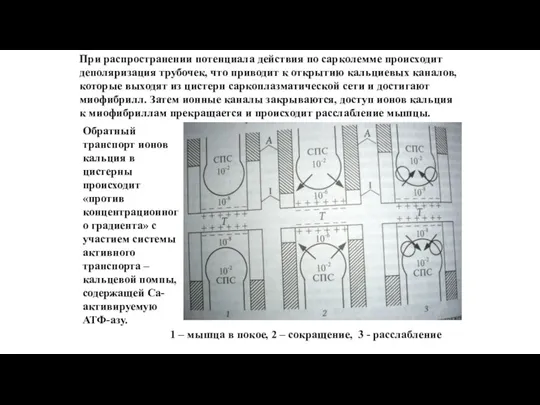
- 113. 1 – мышца в покое, 2 – сокращение, 3 - расслабление При распространении потенциала действия по
- 114. нервные импульсы, поступающие их спинного или головного мозга к к нервно-мышечному синапсу Схема нервно-мышечного сокращения Синаптическая
- 115. Метаболический аппарат клетки
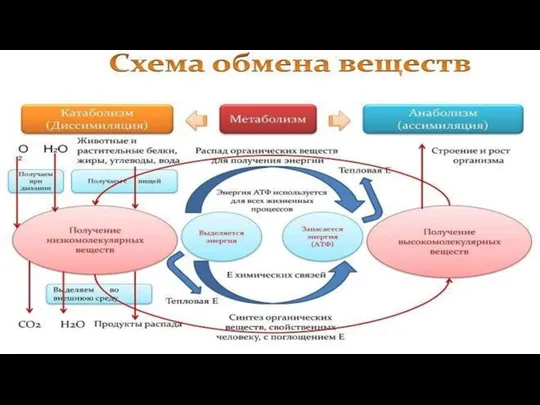
- 116. Метаболизм – это совокупность химических реакций, протекающих в живых клетках и обеспечивающих организм веществами и энергией
- 117. Структуры клетки участвующие в метаболизме Органоиды, участвующие в анаболизме: ШЭПС ГлЭПС Аппарат Гольджи Рибосомы Хлоропласты (у
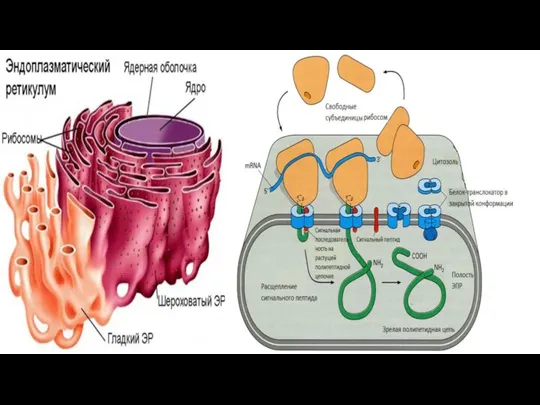
- 119. Эндоплазматический ретиккулум Эндоплазматический ретикулум (ЭПР) - это замкнутая система мембранных трубочек внутри клетки, образующих сложную переплетающуюся
- 121. Шероховатый ЭПС На рибосомах ШЭПС синтезируются следующие группы белков: Белки предназначенные для секреции-выведение через аппарат Гольджи;
- 122. Сборка белка. Этап прикрепления к ШЭПР Сборка любого белка начинается на рибосомах в цитозоле. В ЭПР
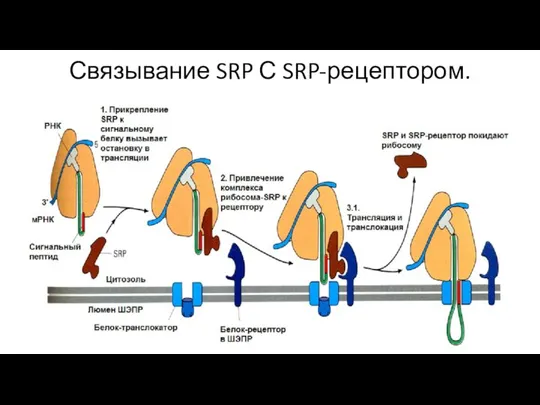
- 123. Связывание SRP С SRP-рецептором.
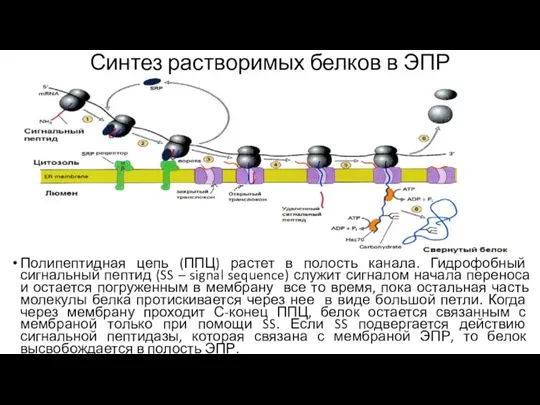
- 124. Синтез растворимых белков в ЭПР Полипептидная цепь (ППЦ) растет в полость канала. Гидрофобный сигнальный пептид (SS
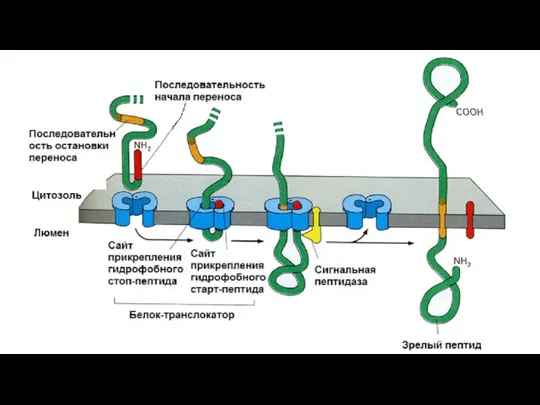
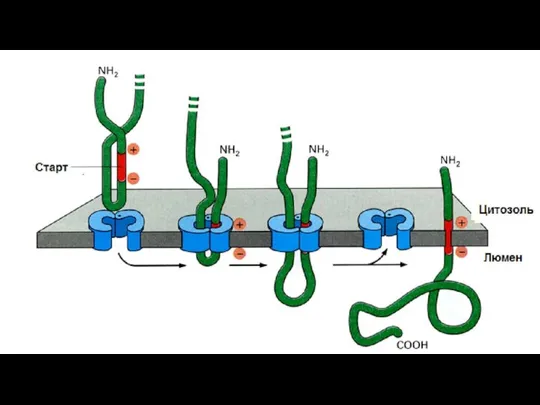
- 125. Синтез мембранных белков В синтезируемой ППЦ существует так называемая стоп-последовательность (STS – stop transport signal). Белок
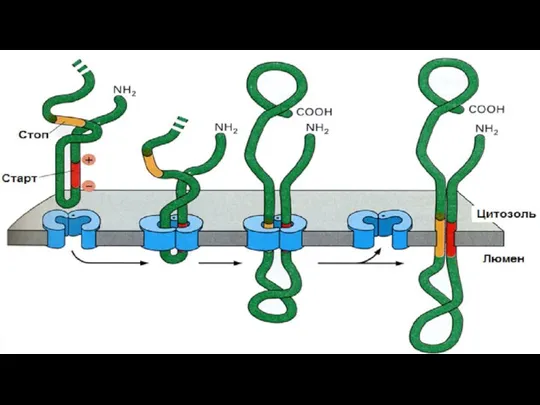
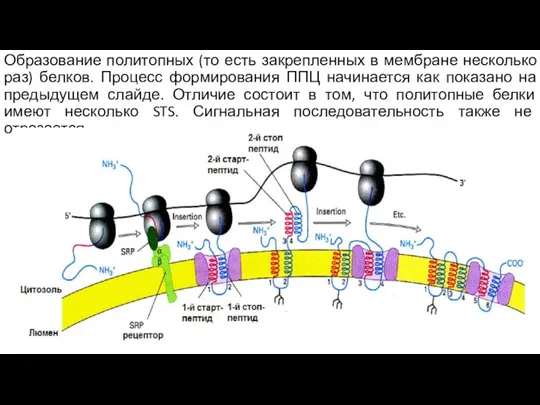
- 129. Образование политопных (то есть закрепленных в мембране несколько раз) белков. Процесс формирования ППЦ начинается как показано
- 130. Другие функции ШЭПР Большинство белков синтезированных в ШЭПР-гликопротеиды. По мере роста белковой цепи она соединяется с
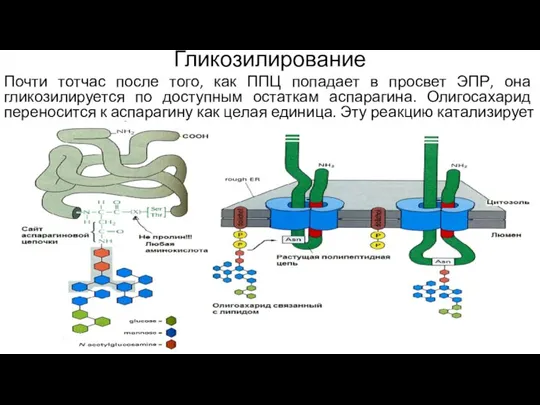
- 131. Гликозилирование Почти тотчас после того, как ППЦ попадает в просвет ЭПР, она гликозилируется по доступным остаткам
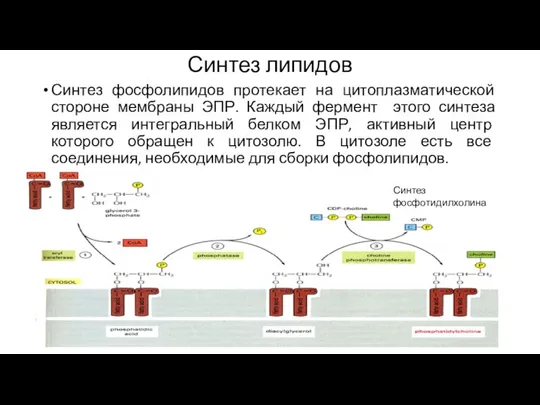
- 132. Синтез липидов Синтез фосфолипидов протекает на цитоплазматической стороне мембраны ЭПР. Каждый фермент этого синтеза является интегральный
- 133. Гладкий ЭПР Очень лабилен и способен к перестройкам в зависимости от внешних условий. Например, при детоксикации
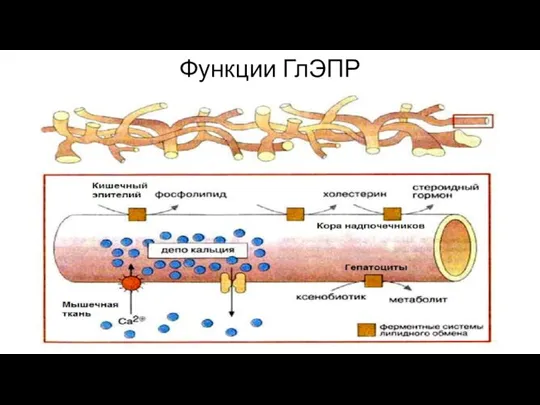
- 134. Функции ГлЭПР
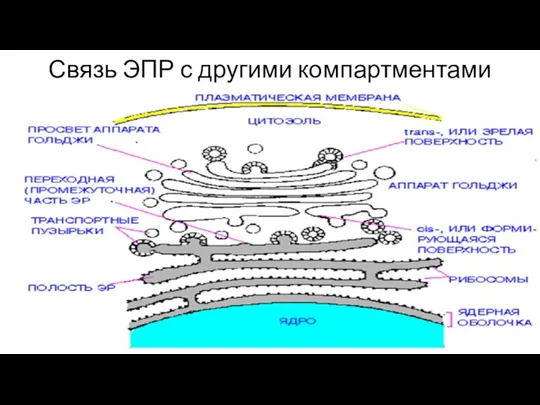
- 135. Связь ЭПР с другими компартментами
- 136. Аппарат Гольджи Аппарат Гольджи- интегрирующая часть метаболической системы эукариотической клетки. В нем происходит обособление секретируемых продуктов,
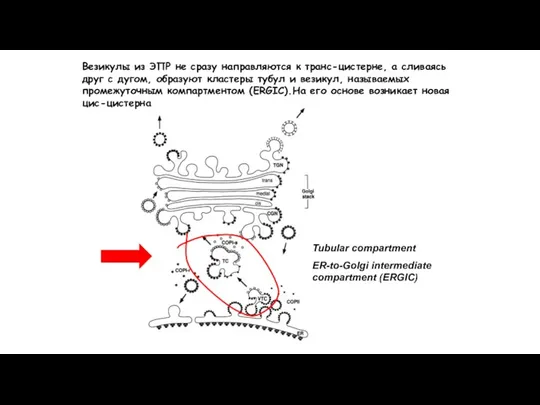
- 137. Tubular compartment ER-to-Golgi intermediate compartment (ERGIC) Везикулы из ЭПР не сразу направляются к транс-цистерне, а сливаясь
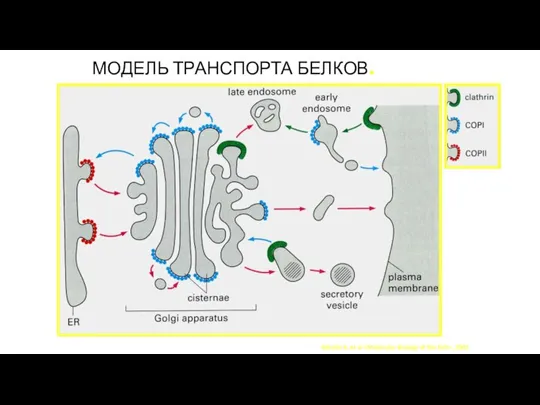
- 138. МОДЕЛЬ ТРАНСПОРТА БЕЛКОВ. Alberts B. et al «Molecular Biology of the Cell», 2002
- 139. Синтез и модификация веществ Каждая цистерна аппарата Гольджи имеет свой набор ферментов. Доработка гликопротеинов; Создание лизосомальных
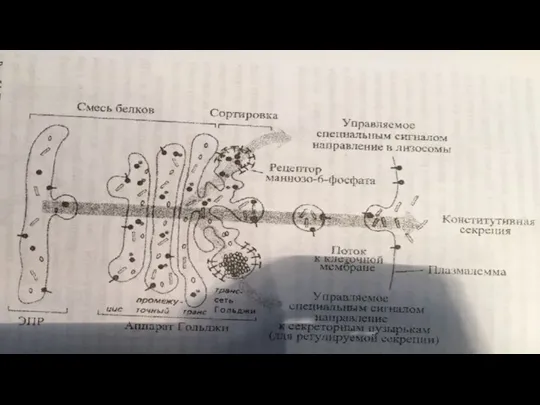
- 140. Сортировка Сортировка белков происходит в транс-сети аппарата Гольджи. Результатом является разделение белков и направление в места
- 142. Секреция Вещества выводятся из клетки одним из двух путей: в результате конструктивной (нерегулируемой) секреции (постоянная,например, путь
- 144. Функции обобщенно 1.Транспорт - через АГ проходят две группы белков: белки, предназначенные на экспорт из клетки,
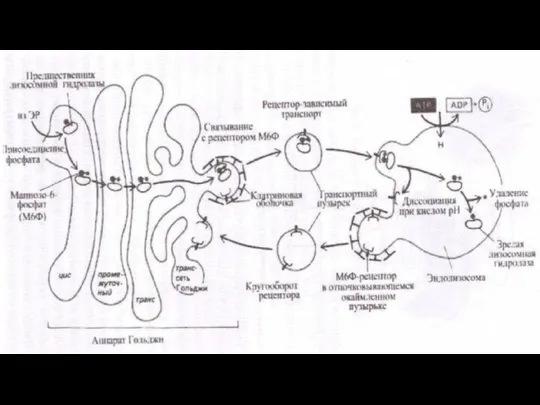
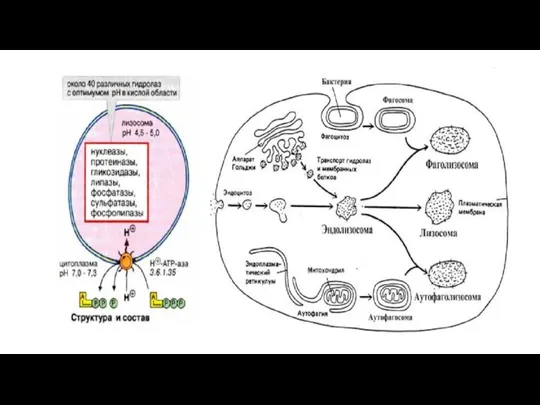
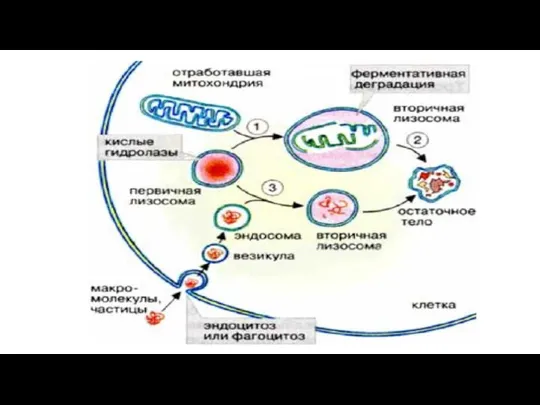
- 145. Лизосомы Лизосомы представляют собой гетерогенную (разнородную) группу цитоплазматических вакуолеподобных структур размером 1-3 мкм, отличительной особенностью которых
- 147. В первом случае расщепляемый материал - белки, полинуклеотиды или полисахариды - попадает в клетку путем эндоцитоза.
- 148. Второй путь формирования лизосом называется аутофагией. В процессе аутофагии происходит разрушение отработанных частей самой клетки. Известно,
- 150. Третий путь формирования лизосом имеется только у клеток, специализированных для фагоцитоза больших частиц и микроорганизмов. Такие
- 151. Эндосомы, аутофагосомы и фагосомы часто называют общим термином - прелизосомы, а эндолизосомы, аутофаголизосомы и фаголизосомы термином
- 152. Пероксисомы Мембранные пузырьки с однородным или гранулярным матриксом. В центре-сердцевина (нуклеоид) из кристаллических структур, образованных фибриллами
- 154. Пероксисомы обнаружены во всех эукариотических клетках. Они являются главным центром утилизации кислорода (наряду с митохондрией). Кислород
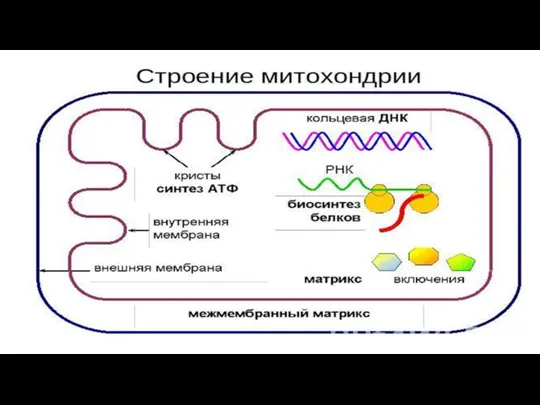
- 155. Митохондрии Митохондрии, как органеллы синтеза АТФ характерны для всех эукариотических клеток как автотрофных (фотосинтезирующие растения), так
- 156. Локализация Митохондрии скапливаются в энергозависимых участках клетки. В скелетных мышцах они располагаются между микрофибриллами, у простейших
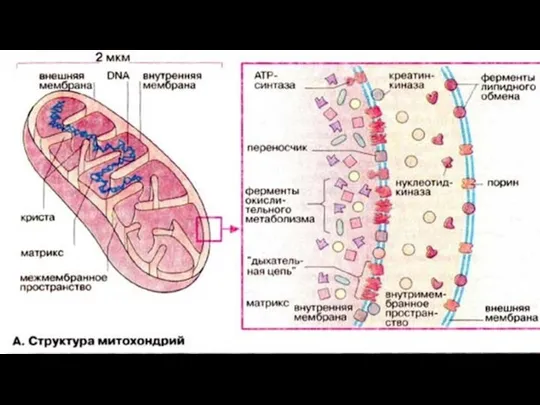
- 157. Строение Имеющиеся методы позволяют выделить из митохондрий все четыре компонента: наружную мембрану,содержимое межмембранного пространства, внутреннюю мембрану
- 160. Наружная мембрана. В состав наружной мембраны входит много молекул белка порина. Особенность его заключается в том,
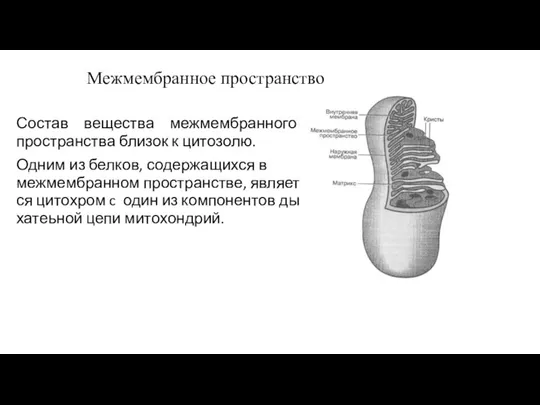
- 161. Межмембранное пространство Состав вещества межмембранного пространства близок к цитозолю. Одним из белков, содержащихся в межмембранном пространстве,
- 162. Внутренняя мембрана Внутренняя мембрана ограничивает основное рабочее пространство митохондрии. Она высокоспецифична, содержит большое количество фосфолипида кардиолипина
- 163. Матрикс Матрикс содержит высококонцентрированную смесь сотен различных ферментов, необходимых для окисления пирувата, жирных кислот и ферментов
- 164. Генетический аппарат Кольцевая молекула ДНК. Редко-линейная; Может синтезировать белок как с метохондриального иРНК, так и ядерного;
- 165. Функции Синтез АТФ; Специфический синтез-стероидные гормоны, некоторые липиды; Накопление ионов, особенно Ca2+; Накопление продуктов экскреции в
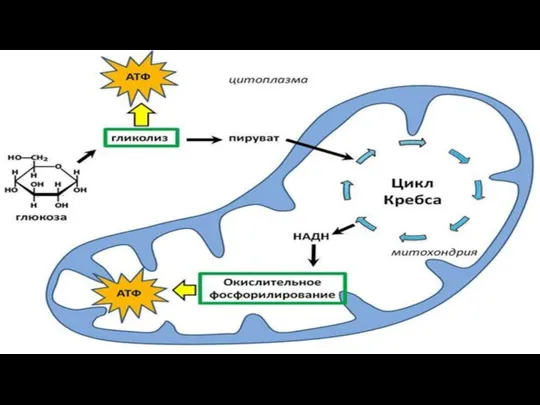
- 166. Этапы энергетического обмена: 1. Подготовительный 2. Гликолиз (бескислородное окисление) 3. Дыхание (кислородное окисление)
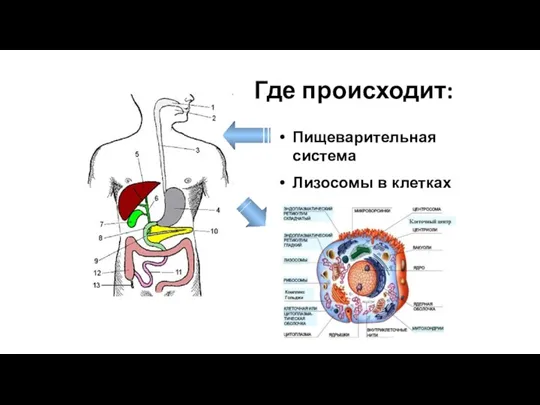
- 167. Первый этап Подготовительный ферментативное расщепление сложных органических веществ до простых
- 168. Где происходит: Пищеварительная система Лизосомы в клетках
- 169. Субстрат Углеводы = глюкоза + Е (1г = 17,6 кДж) Липиды = глицерин + жирные кислоты
- 170. Результат этапа Энергия не запасается, а выделяется только в тепловой форме
- 171. Гликолиз - неполное расщепление - анаэробное дыхание - брожение Второй этап Бескислородное окисление
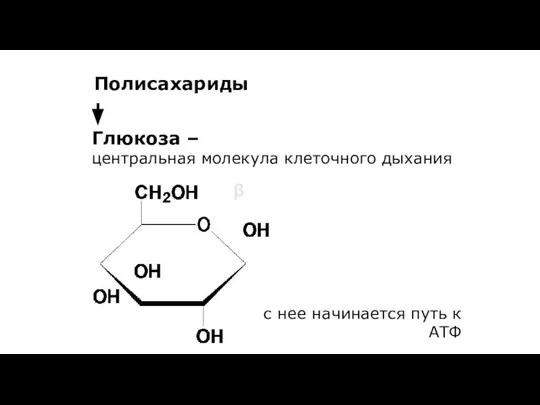
- 172. Глюкоза – центральная молекула клеточного дыхания Полисахариды β с нее начинается путь к АТФ
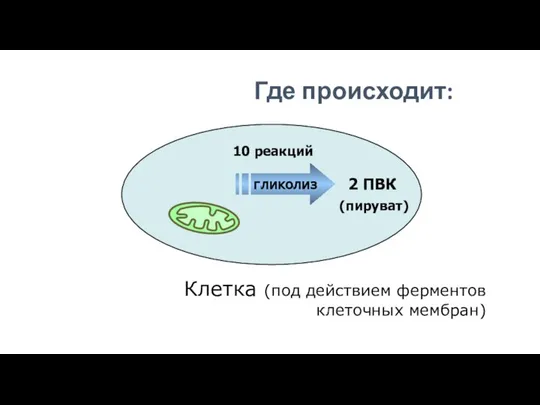
- 173. 2 ПВК Клетка (под действием ферментов клеточных мембран) 10 реакций (пируват) гликолиз Где происходит:
- 174. Субстрат С6Н12О6 + 2АДФ + 2Н3РО4 + 2НАД+ → глюкоза 2С3Н4О3 + 2АТФ + 2Н2О +
- 175. 60% выделяется в виде тепла 40% идет на синтез АТФ Энергия Результат этапа: из одной молекулы
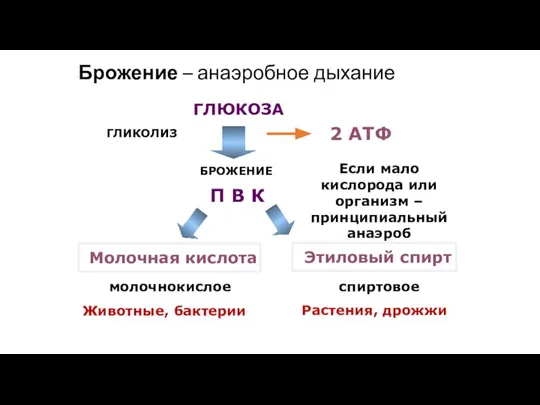
- 176. ГЛЮКОЗА П В К 2 АТФ Брожение – анаэробное дыхание Если мало кислорода или организм –
- 177. Выводы: Синтез АТФ в процессе гликолиза не нуждается в мембранах. Он идёт даже в пробирке, если
- 178. Третий этап Кислородное расщепление: полное расщепление пировиноградной кислоты, происходит при обязательном присутствии кислорода
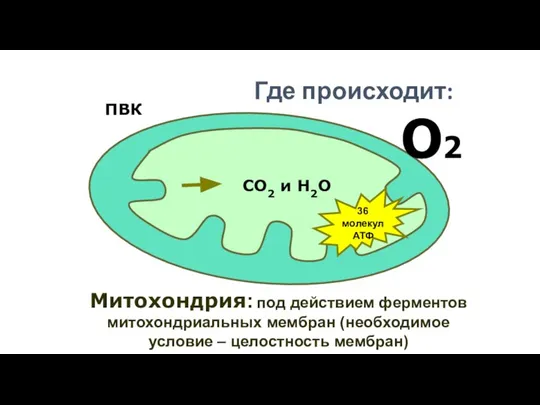
- 179. О2 Митохондрия: под действием ферментов митохондриальных мембран (необходимое условие – целостность мембран) ПВК СО2 и Н2О
- 180. Стадии аэробного дыхания: 1) Окислительное декарбоксилирование 2) Цикл Кребса 3) Электронтранспортная цепь (окислительное фосфолирирование)
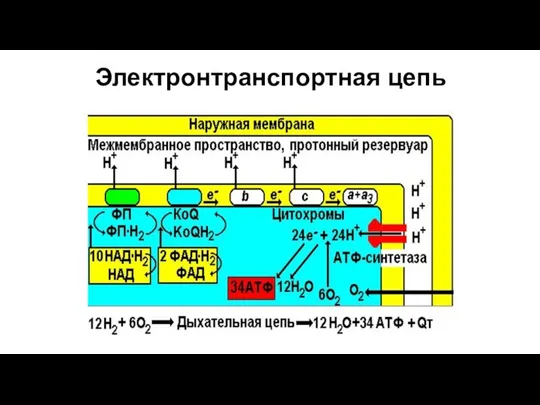
- 182. Электронтранспортная цепь
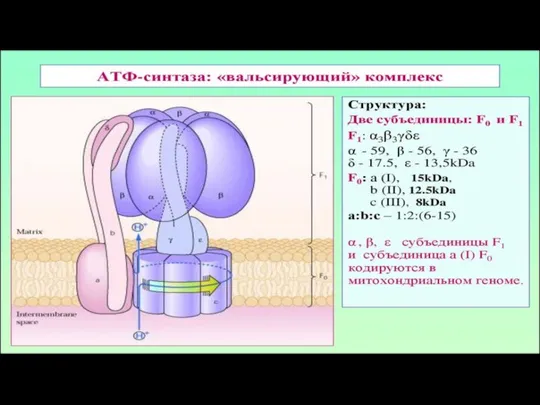
- 183. АТФ-ситаза Принимает электроны от цитохрома с и передает их на кислород с образованием воды. Переносит 2
- 185. Некоторые химические вещества (протонофоры) могут переносить протоны или другие ионы (ионофоры) из межмембранного пространства через мембрану
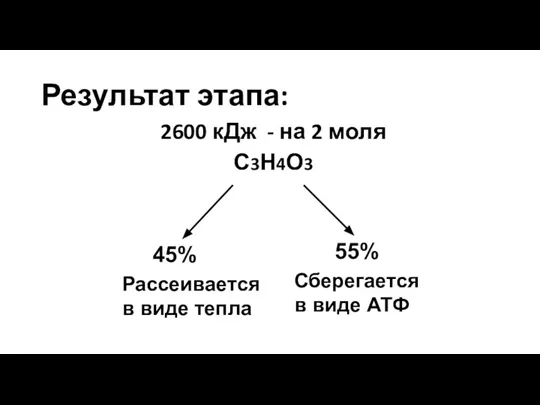
- 186. Результат этапа: 2600 кДж - на 2 моля С3Н4О3 45% Рассеивается в виде тепла Сберегается в
- 187. Выводы: Для осуществления кислородного процесса необходимо наличие неповреждённых митохондриальных мембран
- 188. Выводы: Расщепление в клетке 1 молекулы глюкозы до СО2 и Н2О обеспечивает синтез 38 молекул АТФ
- 189. Ядерный аппарат
- 190. Состав ядерного аппарата: Поверхностный аппарат ядра; Ядерный матрикс; Кариоплазма; Хроматин; Ядрышко.
- 191. 1 — ядерная оболочка (две мембраны - внутренняя и внешняя, и перинуклеарное пространство); 2 — ядерная
- 192. Поверхностный аппарат Ядерная оболочка с порами: Разделена на внешнюю и внутреннюю ядерные оболочки. Пространство между ними
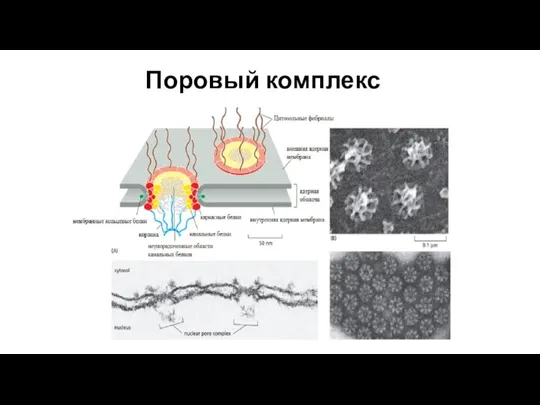
- 193. Поровый комплекс
- 194. РНК должны попасть из ядра в цитоплазму. Для этого нужно преодолеть ядерную мембрану. Мембрана пронизана большим
- 195. Функции поверхностного аппарата Отграничение ядра от цитоплазмы. В результате этого происходит разделение транскрипции и трансляции-возможен процессинг.
- 196. Ядерный матрикс Ядерный матрикс-это скелет ядра. Белки связывают определенные последовательности ДНК, образующие основание петель хроматина. Благодаря
- 197. Ядрышко Ядрышко – высокоорганизованная шаровидная структура ядра. Содержит большие петли ДНК, выступающие из хромосом, при этом
- 198. Хроматин Хроматин: основными компонентами являютсяДНК,гистоны инегистоновые белки (ДНП). Соотношение ДНК и белка составляет ~1:1,3, а основная
- 199. Урони упаковки хроматина
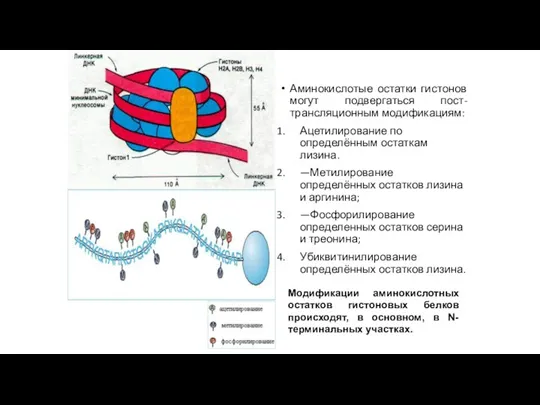
- 200. Урони упаковки хроматина Нуклеосомный уровень-8 молекул гистонов закручивают фрагмент 140 пар оснований. Линкерный участок-60 пар оснований.
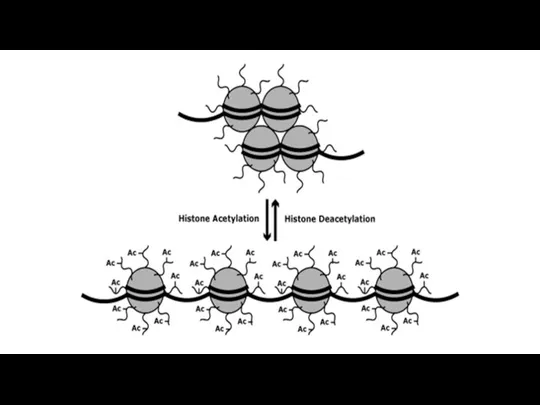
- 202. Аминокислотые остатки гистонов могут подвергаться пост-трансляционным модификациям: Ацетилирование по определённым остаткам лизина. —Метилирование определённых остатков лизина
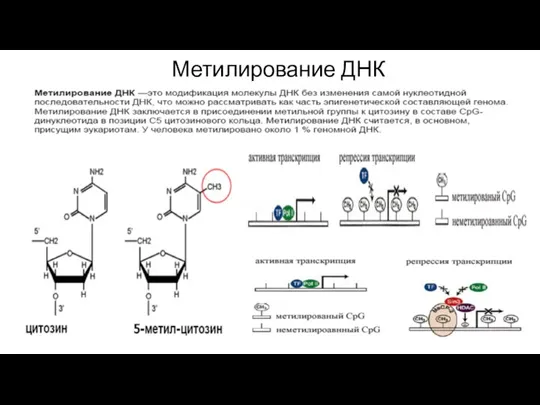
- 204. Метилирование ДНК
- 206. Что происходит? Метильные группы нарушают ДНК-белковые взаимодействия, выступая в большую бороздку ДНК и препятствуя связыванию специфических
- 207. Архитектурные белки высокомобильной группы (HMG) Были названы так потому, что обладают высокой электрофоретической мобильностью в полиакриламидном
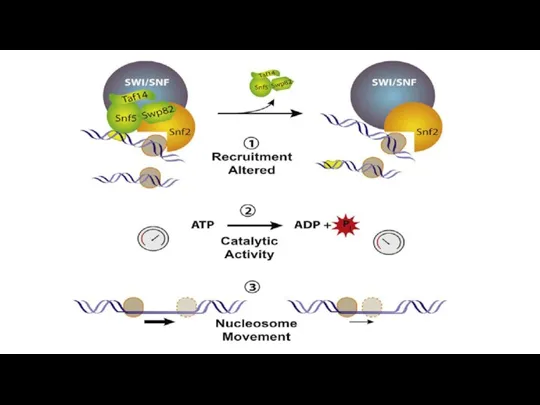
- 208. Хроматин-перестраивающие комплексы В середине 90-хгодов стало известно, что хроматин содержит комплексы, перестраивающие нуклеосомы и использующие энергию
- 210. Функция белков хроматина Определяют уровень компактизации ДНК; Влияют на уровень транскрипции; Осуществляют процесс транскрипции.
- 211. Функции ядра Хранение и передача генетической информации. Реализация генетической информации.
- 212. Основы молекулярной биологии клетки
- 213. Что такое молекулярная биология? Жизнь — способ существования биополимеров, из которых основными являются белки и нуклеиновые
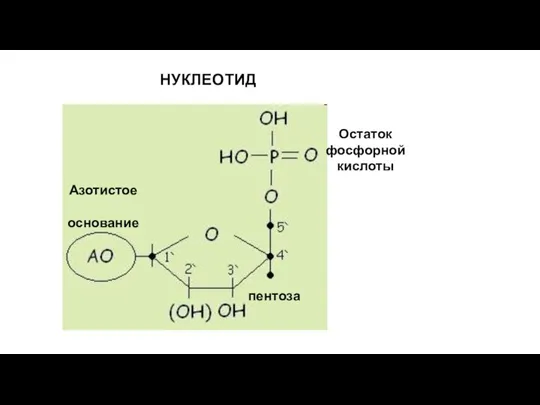
- 214. НУКЛЕОТИД Остаток фосфорной кислоты пентоза Азотистое основание
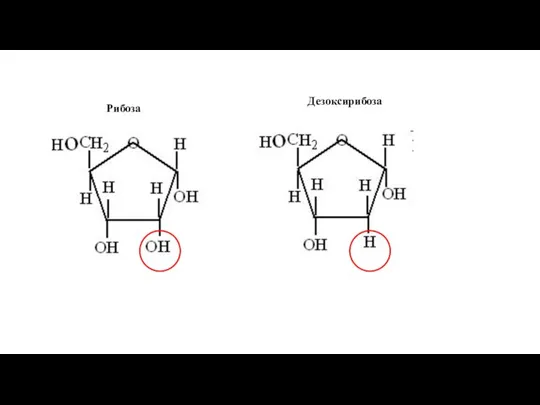
- 215. Рибоза Дезоксирибоза
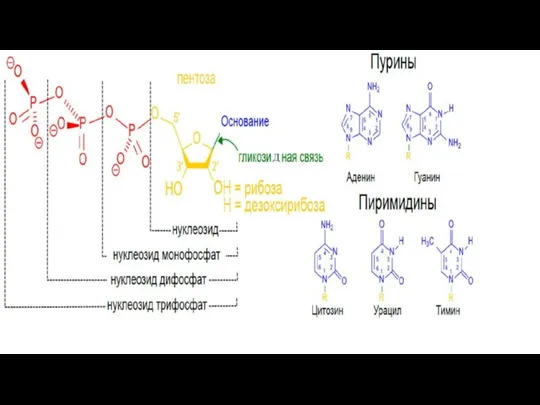
- 216. Нуклеиновые кислоты Нуклеиновые кислоты выполняют генетическую функцию (ДНК) и участвуют в реализации генетической информации (РНК). Молекулы
- 218. Связи в нуклеотидах Гликозидная связь— это тип ковалентной связи, которая соединяет молекулу сахара с другой молекулой.
- 219. Производные нуклиотидов Нуклиотиды, помимо того,что являются мономерами ДНК и РНК, учавствуют в большом количестве других важных
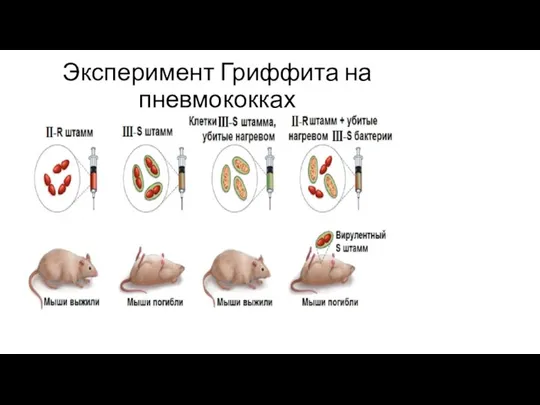
- 220. Эксперимент Гриффита на пневмококках
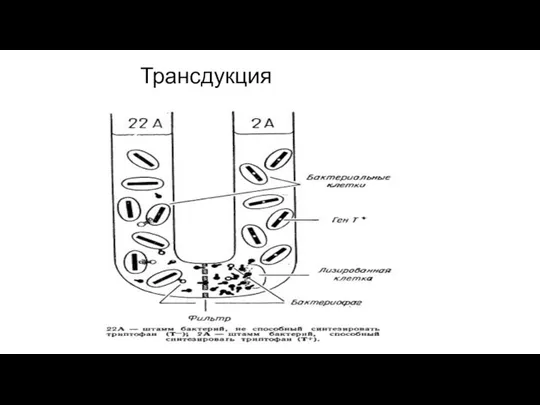
- 221. Трансдукция
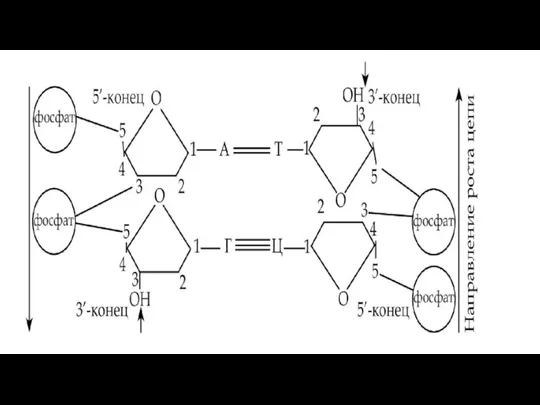
- 222. Строение ДНК Нуклеотиды одной цепи соединяются связями, возникающими между остатком фосфорной кислоты и углеводом через фосфат,
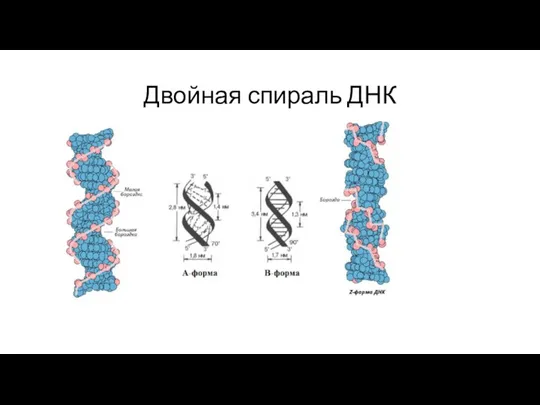
- 224. Двойная спираль ДНК
- 225. Комплементарность и правила Чаргаффа Комплементарность - это принцип взаимного соответствия парных нуклеотидов или способность нуклеотидов объединяться
- 226. Функции ДНК
- 227. РНК Молекула РНК представляет собой неразветвленный полинуклеотид, который может иметь первичную структуру – последовательность нуклеотидов, вторичную
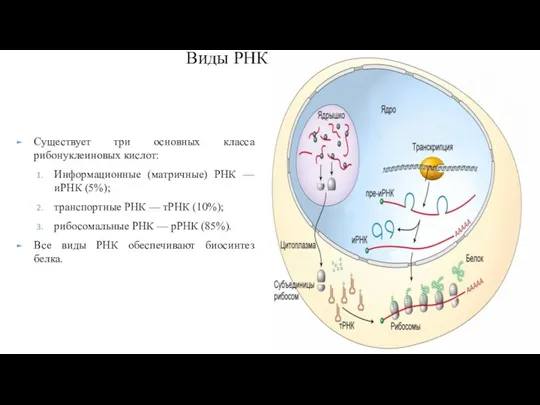
- 228. Виды РНК Существует три основных класса рибонуклеиновых кислот: Информационные (матричные) РНК — иРНК (5%); транспортные РНК
- 229. Информационная РНК. Наиболее разнообразный по размерам и стабильности класс. Все они являются переносчиками генетической информации из
- 230. тРНК Молекулы тРНК— сравнительно короткие молекулы, состоящие из 71–94 нуклеотидов. тРНК приходится до 10% от общего
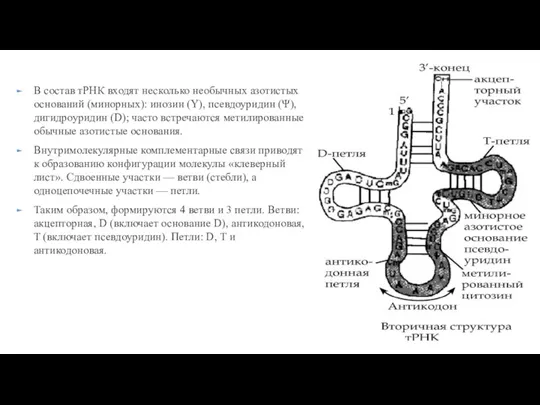
- 231. В состав тРНК входят несколько необычных азотистых оснований (минорных): инозин (Y), псевдоуридин (Ψ), дигидроуридин (D); часто
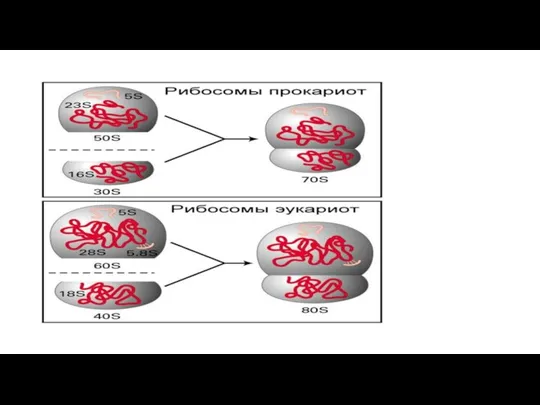
- 232. Рибосомы В состав субъединиц рибосом входят разнообразные рРНК, различающиеся по константе седиментации (единица Сведберга — S).
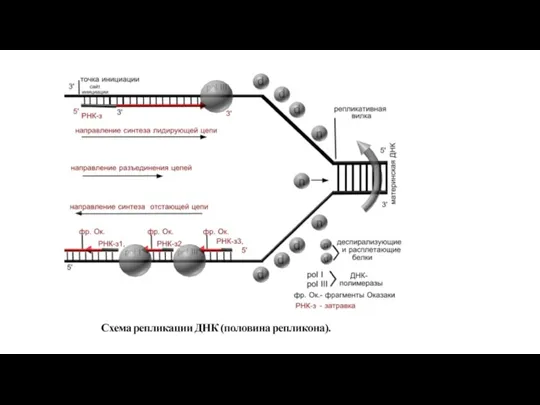
- 234. Репликация Самовоспроизведение ДНК (процесс, приводящий к удвоению молекул ДНК), называется репликацией. Репликация необходима перед делением клетки,
- 235. Участок молекулы ДНК, на котором идет репликация, называется репликон. У прокариот репликон один, а у эукариот
- 236. Начинается процесс с разрыва водородных связей между азотистыми основаниями ДНК на участке, включающем около 300 пар
- 237. На другой половине репликона, где разъединение цепей ДНК идёт в другую сторону, также, в одном направлении
- 239. Повреждения ДНК Спонтанные повреждения ДНК: Ошибки репликации (появление некомплементарных пар нуклеотидов); Апуринизация (отщепление азотистых оснований из
- 240. Фоторепарация 1. Нормальная молекула ДНК ↓ Облучение УФ-светом ↓ 2. Мутантная молекула ДНК – образование пиримидиновых
- 242. Эксцизионная репарация 1. Узнавание повреждения ДНК эндонуклеазой; 2. Инцизия (надрезание) цепи ДНК ферментом по обе стороны
- 243. Пострепликативная репарация ДНК Пострепликативная репарация осуществляется в тех случаях, когда повреждение доживает до фазы репликации (слишком
- 245. Скачать презентацию














































































































































 Классификация споровых растений
Классификация споровых растений Московский океанариум в РИО
Московский океанариум в РИО Класс Сосальщики (Trematoda)
Класс Сосальщики (Trematoda) Семейство розоцветные
Семейство розоцветные Анатомия и физиология человека. Пищеварительная система. (Лекция 6)
Анатомия и физиология человека. Пищеварительная система. (Лекция 6) Божья коровка. 2 часть
Божья коровка. 2 часть Лена Шёберг. Крутые факты о яйцах
Лена Шёберг. Крутые факты о яйцах Вид. Критерии вида (3)
Вид. Критерии вида (3) Лекция+1+2022
Лекция+1+2022 Презентация на тему Что такое кровь
Презентация на тему Что такое кровь  Пищеварение в желудке
Пищеварение в желудке Класс насекомые. Членистоногие
Класс насекомые. Членистоногие Питомник Крымской опытноселекционной станции, филиал ВИР
Питомник Крымской опытноселекционной станции, филиал ВИР Деление клеток. Митоз
Деление клеток. Митоз Мышечная броня В. Райх. Реакция борьбы и бегства У. Кеннон
Мышечная броня В. Райх. Реакция борьбы и бегства У. Кеннон 7a830270a0b74ab3b028bc80fba8a3a9
7a830270a0b74ab3b028bc80fba8a3a9 Влияние внешних факторов на рост и развитие растения
Влияние внешних факторов на рост и развитие растения Лекция 1
Лекция 1 Актуальные и перспективные медицинские технологии
Актуальные и перспективные медицинские технологии Ткани растений
Ткани растений Крушина ольховидная. Семейство Крушиновые
Крушина ольховидная. Семейство Крушиновые Как зимуют звери в лесу
Как зимуют звери в лесу Простейшие (Корненожки, солнечники, споровики, радиолярии)
Простейшие (Корненожки, солнечники, споровики, радиолярии) Обмен минеральных веществ и воды. Лекция 15
Обмен минеральных веществ и воды. Лекция 15 Пища под ногами
Пища под ногами Систематика растений и животных
Систематика растений и животных Способы размножения растений
Способы размножения растений Наследственность и изменчивость
Наследственность и изменчивость