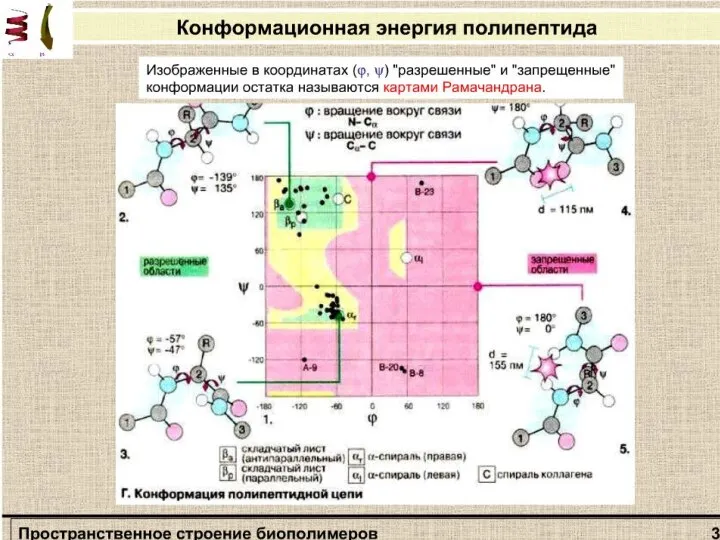
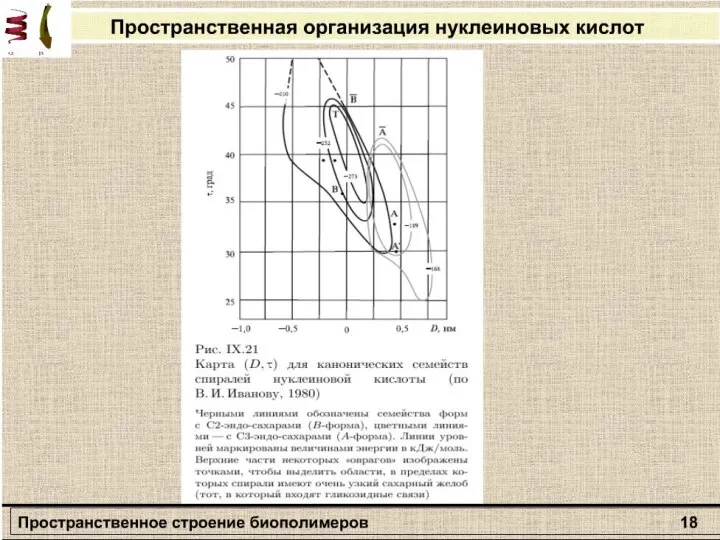
двух соседних аминокислотных остатков. Индийский ученый Г. Рамачандран рассчитал допустимые значения углов ψ и φ (углы отсчитываются от плоской транс-конформации полипептидной цени) и построил стерические карты, на которых но оси абсцисс откладываются значения углов φ от 0 до 360°, а по оси ординат - значения углов ψ. На карте отмечаются полностью разрешенные (при обычных межатомных расстояниях) и частично разрешенные (при минимальных межатомных расстояниях) области значений этих углов.
Стерическая карта Рамачандрана для поли-L-аланина.
Сплошные линии обозначают границы полностью разрешенных областей; пунктирные - частично разрешенных. На карте указаны области значений углов ψ и φ для параллельной (βп„) и антипараллельной (βа) β-форм, спирали белка коллагена (К), правой (αR) и левой (αL) α -спиралей.


















 Презентация на тему Надкласса рыб (Pisces)
Презентация на тему Надкласса рыб (Pisces)  Презентация на тему Передвижение организмов в водной среде
Презентация на тему Передвижение организмов в водной среде  Членистоногие
Членистоногие Презентация на тему СЕМЕЙСТВО ЗОНТИЧНЫЕ
Презентация на тему СЕМЕЙСТВО ЗОНТИЧНЫЕ  Морфофункциональная характеристика вегетативной нервной системы
Морфофункциональная характеристика вегетативной нервной системы Отрочество - особая пора жизни
Отрочество - особая пора жизни Организменная среда обитания
Организменная среда обитания Интероцептивные ощущения
Интероцептивные ощущения Ствол мозга. Строение и кровоснабжение
Ствол мозга. Строение и кровоснабжение Витамины и коферменты
Витамины и коферменты Овощные культуры
Овощные культуры Презентация на тему Плоские черви
Презентация на тему Плоские черви  Сравнительная анатомия Беспозвоночных
Сравнительная анатомия Беспозвоночных Тест по теме «Цветок» 6 класс
Тест по теме «Цветок» 6 класс Альтернативный адаптивный иммунитет Круглоротых
Альтернативный адаптивный иммунитет Круглоротых 11.4 Закономерности наследования признаков. Моногибридное скрещивание
11.4 Закономерности наследования признаков. Моногибридное скрещивание Презентация на тему Растительность средиземноморской области
Презентация на тему Растительность средиземноморской области  Отчет по практике на тему Ярусность растений пришкольного участка Муниципального бюджетного общеобразовательного учреждения
Отчет по практике на тему Ярусность растений пришкольного участка Муниципального бюджетного общеобразовательного учреждения What makes our blood different from others
What makes our blood different from others Динамика макромолекул
Динамика макромолекул Неповрежденные клетки семени подсолнечника
Неповрежденные клетки семени подсолнечника Cost: chemical synthesis with in vitro 1st step experiments
Cost: chemical synthesis with in vitro 1st step experiments Физиологические основы психики
Физиологические основы психики Рыбы. Задания
Рыбы. Задания Строение и функции нервной системы
Строение и функции нервной системы Презентация на тему ОБЩАЯ ХАРАКТЕРИСТИКА ЦАРСТВА РАСТЕНИЯ
Презентация на тему ОБЩАЯ ХАРАКТЕРИСТИКА ЦАРСТВА РАСТЕНИЯ  Экосистема луга в Ярославской области
Экосистема луга в Ярославской области Пшеница и рожь. Сравнение зерновых культур
Пшеница и рожь. Сравнение зерновых культур