Содержание
- 2. Удельная теплота плавления — количество теплоты, необходимое для плавления единицы массы тела при его температуре плавления:
- 3. Парообразование — процесс перехода вещества из жидкого состояния в газообразное. Существует два способа перехода жидкости в
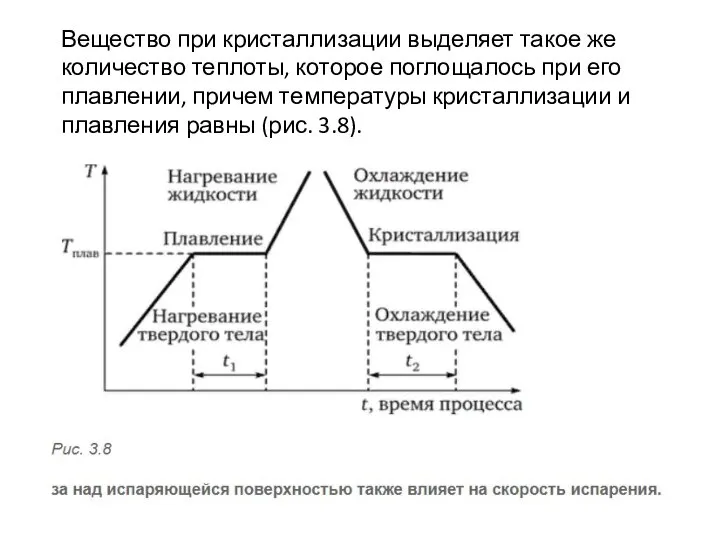
- 4. Вещество при кристаллизации выделяет такое же количество теплоты, которое поглощалось при его плавлении, причем температуры кристаллизации
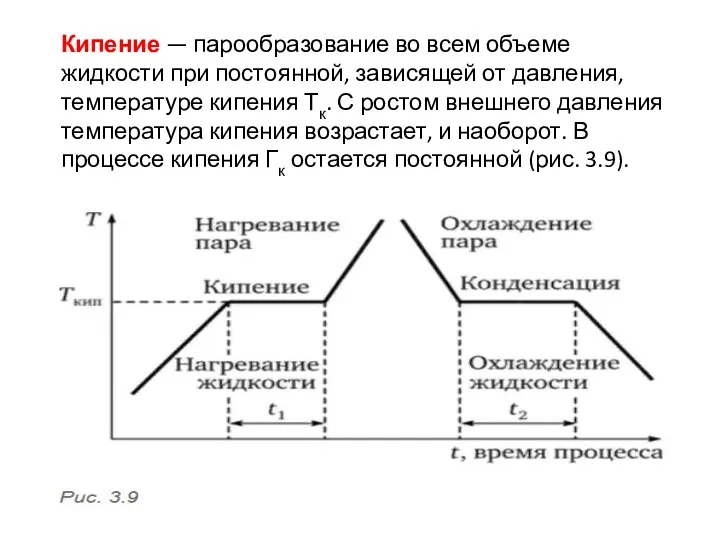
- 5. Кипение — парообразование во всем объеме жидкости при постоянной, зависящей от давления, температуре кипения Тк. С
- 6. Конденсация — процесс перехода вещества вследствие его охлаждения или сжатия из газообразного состояния в жидкое. Удельная
- 7. Удельная теплота сгорания — количество теплоты, выделенное при полном сгорании единицы массы топлива при постоянной температуре
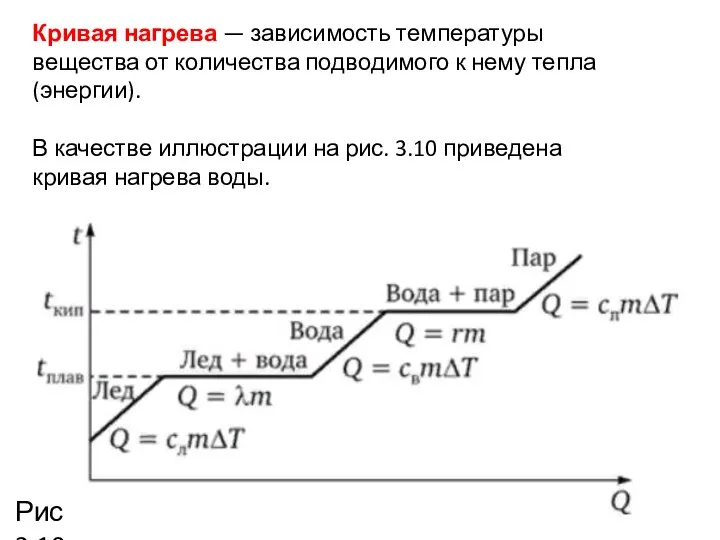
- 8. Кривая нагрева — зависимость температуры вещества от количества подводимого к нему тепла (энергии). В качестве иллюстрации
- 9. При осуществлении теплообмена между телами, образующими изолированную термодинамическую систему, механическая работа внутри системы не совершается (А
- 10. Уравнение теплового баланса: алгебраическая сумма количества теплоты, отданного телами (внутренняя энергия тел при этом уменьшается), и
- 11. Теплоту, полученную телом, считают положительной, теплоту, отданную телом — отрицательной. Следствие из уравнения теплового баланса: при
- 12. С, с — соответственно теплоемкость и удельная теплоемкость тел (связь: С = cm); λ — удельная
- 13. Насыщенный пар — газ, находящийся в динамическом равновесии со своей жидкостью. Насыщенный пар имеет максимальные плотность
- 14. Абсолютная влажность — плотность водяного пара при данных условиях, чаще всего выражаемая в г/м3. В метрологии
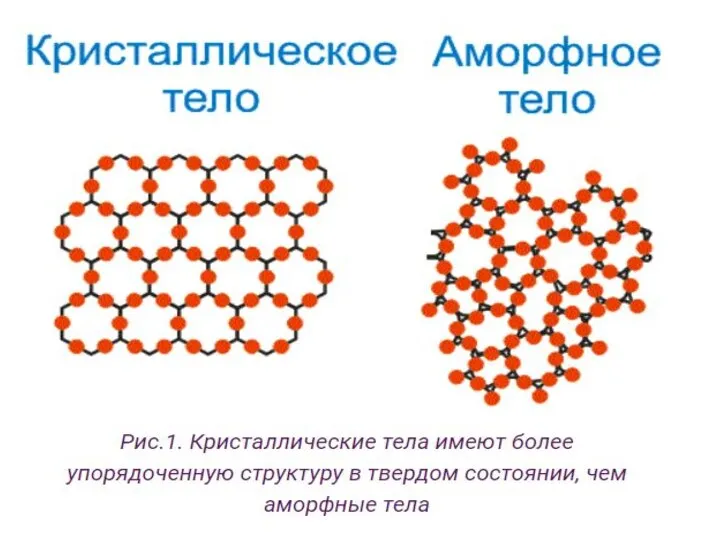
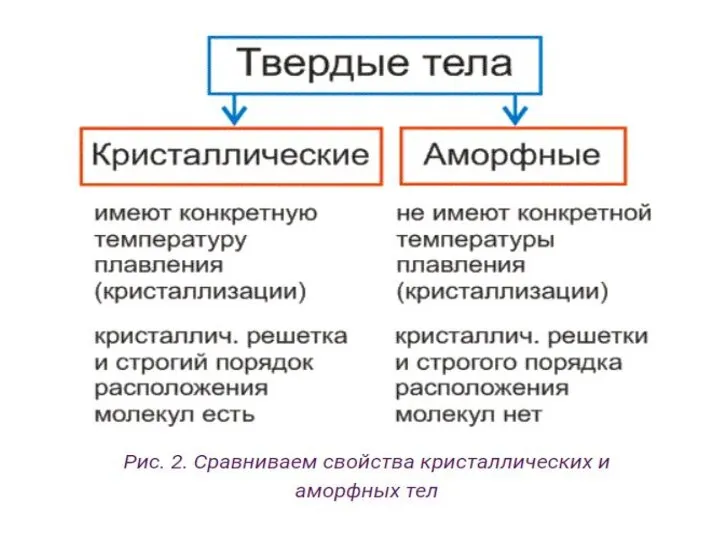
- 16. Кристаллические и аморфные тела У кристаллических тел есть строго упорядоченное положение мельчайших частиц. Эти частички образуют
- 19. Плавление аморфных тел Аморфные тела конкретной температуры плавления не имеют. Строение аморфных тел больше похоже на
- 20. Примеры аморфных тел канифоль (смола хвойных деревьев); стекло; эбонит; сургуч; различные пластмассы; Примечание: Эбонит («Эбенос» др.-греч.
- 21. Плавление кристаллических тел Чтобы кристаллическое тело начало плавиться, его нужно нагреть до определенной температуры. Одни кристаллические
- 22. Примечания: Кристаллические вещества плавятся при той же температуре, при которой они будут превращаться в твердое тело
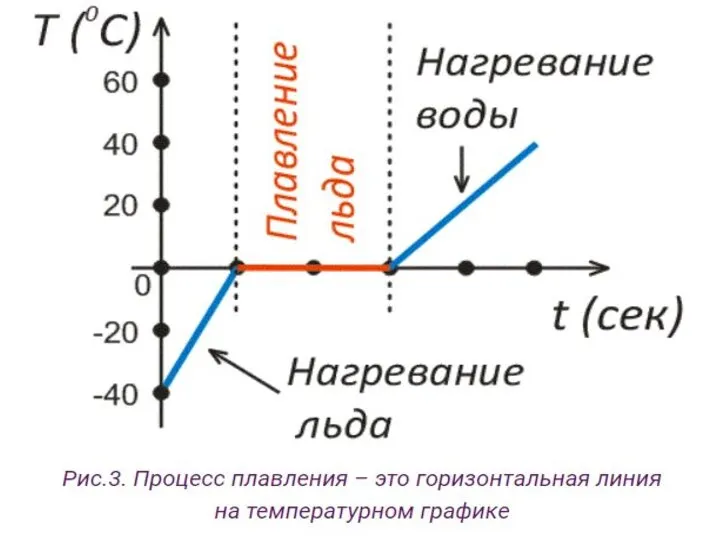
- 23. Как на графике выглядит процесс плавления кристаллического тела Рассмотрим переход из твердого состояния в жидкое —
- 25. Как только будет достигнута температура плавления льда – «0» градусов по Цельсию, лед начнет превращаться в
- 26. Примечания: Чтобы тело расплавить, ему нужно передать тепловую энергию. Значит, при плавлении, тепловая энергия поглощается телом.
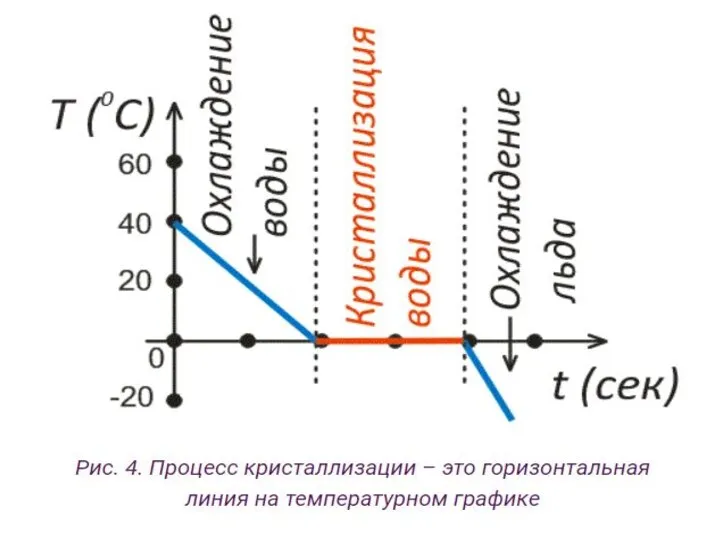
- 27. Как на графике выглядит процесс кристаллизации для кристаллического тела Давайте теперь прекратим нагревание воды, вынесем кастрюльку
- 29. Примечание: Если в воде присутствуют пылинки, или другие мелкие примеси, то кристаллизация проходит быстрее. Такие мелкие
- 30. Выводы Все тела в твердом состоянии по их строению можно разделить на аморфные и кристаллические. Переход
- 32. Скачать презентацию






















 Презентация на тему Основные акустические опасные факторы воздействия на человека
Презентация на тему Основные акустические опасные факторы воздействия на человека  Історія вивчення магнетизму
Історія вивчення магнетизму Силы в природе. Тест
Силы в природе. Тест Электромагнитная волна
Электромагнитная волна Применение радиоактивных изотопов
Применение радиоактивных изотопов Гармонические колебания
Гармонические колебания Движение тела по окружности с постоянной по модулю скоростью
Движение тела по окружности с постоянной по модулю скоростью Расчет коленчатого вала. Лекция №11б
Расчет коленчатого вала. Лекция №11б Урок-игра Механика
Урок-игра Механика Физические формулы
Физические формулы Путешествие в космос. Внеклассное мероприятие по физике, астрономии, химии и информатике
Путешествие в космос. Внеклассное мероприятие по физике, астрономии, химии и информатике Электрические явления
Электрические явления Соединения конденсаторов
Соединения конденсаторов Разветвленная цепь синусоидального тока
Разветвленная цепь синусоидального тока Презентация Механика Лекция 1
Презентация Механика Лекция 1 Электрические машины. Законы электромеханики
Электрические машины. Законы электромеханики Основы аэродинамики
Основы аэродинамики Строение атома
Строение атома Катушки индуктивности
Катушки индуктивности Расчет вакум-насоса
Расчет вакум-насоса Гармонические колебания. Затухающие и вынужденные колебания. Резонанс
Гармонические колебания. Затухающие и вынужденные колебания. Резонанс Нанотехнологии. Ричард Фейнман
Нанотехнологии. Ричард Фейнман Атомное ядро. Дефект масс
Атомное ядро. Дефект масс 8__2_zakon_Nyutona
8__2_zakon_Nyutona Пара сил и момент силы относительно точки
Пара сил и момент силы относительно точки Движение тела по окружности под действием силы тяжести
Движение тела по окружности под действием силы тяжести Машины переменного тока. Переменный ток. Синхронные генераторы
Машины переменного тока. Переменный ток. Синхронные генераторы Смачивание. Капиллярнность
Смачивание. Капиллярнность