Содержание
- 2. Электрический ток в электролитах Электролиты. Носители зарядов в электролитах. Электролиз. Закон Фарадея для электролиза.
- 3. Электролитами принято называть проводящие среды, в которых протекание электрического тока сопровождается переносом вещества. Носителями свободных зарядов
- 4. Основными представителями электролитов, широко используемыми в технике, являются водные растворы неорганических кислот, солей, оснований, щёлочей. Прохождение
- 5. Электролиз Это совокупность процессов, протекающих в растворе или расплаве электролита, при пропускании через него электрического тока.
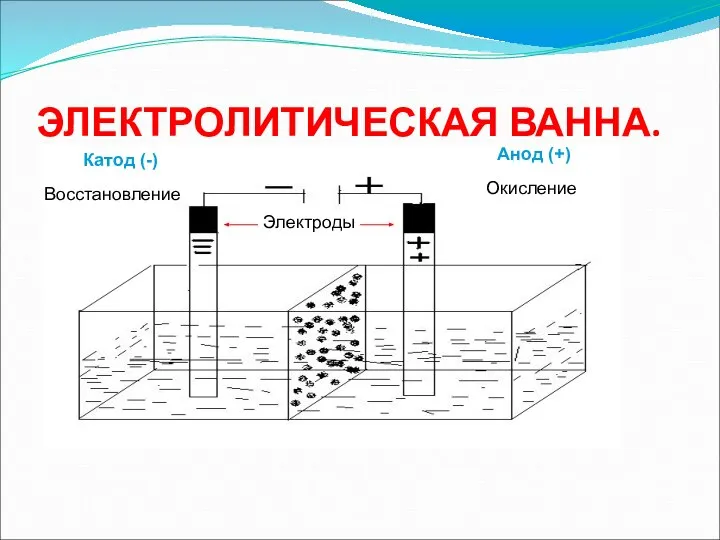
- 6. ЭЛЕКТРОЛИТИЧЕСКАЯ ВАННА. Катод (-) Анод (+) Восстановление Окисление Электроды
- 7. Электрический ток в электролитах представляет собой перемещение ионов обоих знаков в противоположных направлениях. Положительные ионы движутся
- 8. Сущность электролиза В результате электролиза на электродах (катоде и аноде) выделяются соответствующие продукты восстановления и окисления,
- 9. Закон электролиза был экспериментально установлен английским физиком М. Фарадеем в 1833 году. Закон Фарадея определяет количества
- 10. Процесс получения отслаиваемых покрытий (гальванопластика) был разработан русским ученым Б.С.Якоби, который в 1836 году применил этот
- 11. * Электролитические процессы *классифицируются следующим образом: получение неорганических веществ(водорода, кислорода, хлора, щелочей и т.д.) получение металлов(литий,
- 12. Практическое применение электролиза Электрохимические процессы широко применяются в различных областях современной техники, в аналитической химии, биохимии
- 13. В цветной металлургии электролиз используется для извлечения металлов из руд и их очистки. Электролизом расплавленных сред
- 14. Гальванотехника – область прикладной электрохимии, занимающаяся процессами нанесения металлических покрытий на поверхность как металлических, так и
- 16. Скачать презентацию












 Удельное электрическое сопротивление горных пород со сложной структурой пористого пространства
Удельное электрическое сопротивление горных пород со сложной структурой пористого пространства Фазовые диаграммы состояния вещества
Фазовые диаграммы состояния вещества Презентация по физике "Решение задач на расчет работы и мощности" -
Презентация по физике "Решение задач на расчет работы и мощности" -  Устройство, работа, возможные неисправности системы охлаждения двигателя КамАЗ -740. ТО системы охлаждения
Устройство, работа, возможные неисправности системы охлаждения двигателя КамАЗ -740. ТО системы охлаждения Основы физической органической химии. Сигма-ро анализ
Основы физической органической химии. Сигма-ро анализ Плоская задача теории упругости
Плоская задача теории упругости Сборка механического манипулятора
Сборка механического манипулятора Основы ядерной физики и дозиметрии
Основы ядерной физики и дозиметрии Дефекты машинной строчки (технология, 7 класс)
Дефекты машинной строчки (технология, 7 класс) Презентация на тему Звуковые волны в различных средах
Презентация на тему Звуковые волны в различных средах 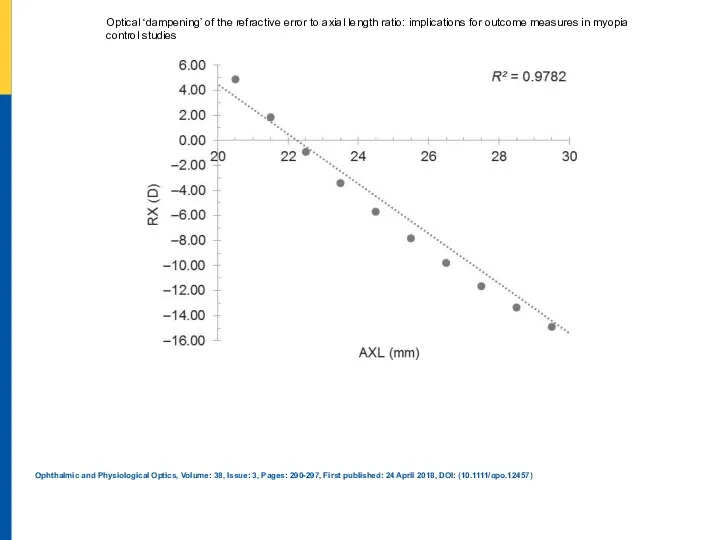 Ophthalmic and Physiological Optics, Volume
Ophthalmic and Physiological Optics, Volume Константа
Константа Аморфные тела
Аморфные тела Электрическая свеча Ябочкова
Электрическая свеча Ябочкова Фундаментальные опыты в молекулярной физике
Фундаментальные опыты в молекулярной физике Строение атома
Строение атома Порядок решения задач по динамике МТ
Порядок решения задач по динамике МТ Что такое энергия?
Что такое энергия? Повышение КПД ГТУ путём внедрения регенеративного цикла
Повышение КПД ГТУ путём внедрения регенеративного цикла Применение первого закона термодинамики к изобарическому процессу
Применение первого закона термодинамики к изобарическому процессу Энергия топлива. Удельная теплота сгорания
Энергия топлива. Удельная теплота сгорания Конференция. Чёрная дыра
Конференция. Чёрная дыра Каналы связи по линиям электропередач
Каналы связи по линиям электропередач Основы термодинамики
Основы термодинамики Радиоактивность. Открытие
Радиоактивность. Открытие Оптика. Уравнения Максвелла. (Лекция 1)
Оптика. Уравнения Максвелла. (Лекция 1) Адсорбция комплексных соединений на нанопористых соединениях
Адсорбция комплексных соединений на нанопористых соединениях Изменение изотопного состава. Выгорание топлива
Изменение изотопного состава. Выгорание топлива