Содержание
- 2. ВНУТРЕННЯЯ ЭНЕРГИЯ Сумма кинетических энергий хаотического движения всех частиц тела относительно центра масс тела (молекул, атомов)
- 3. Внутренняя энергия одноатомного идеального газа Для идеального газа: U=U(T), т.к. взаимодействием на расстоянии пренебрегаем или Внутренняя
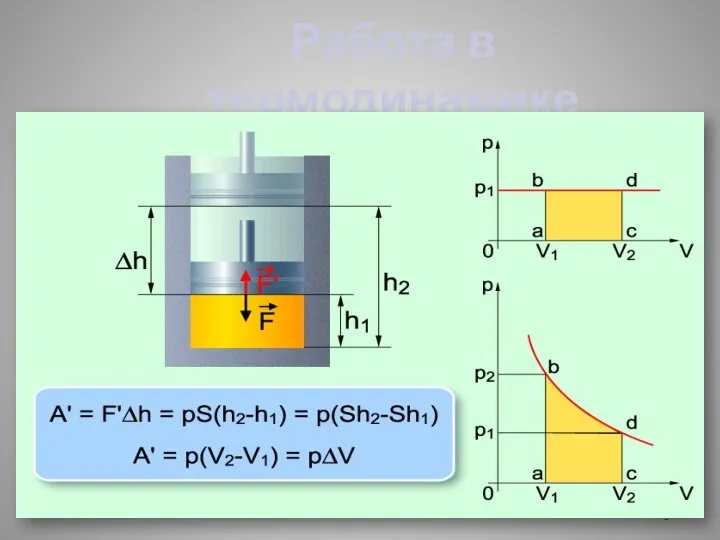
- 4. Способы изменения внутренней энергии Совершение работы А Работа газа - Аꞌ Работа внешних сил - А
- 5. Работа в термодинамике
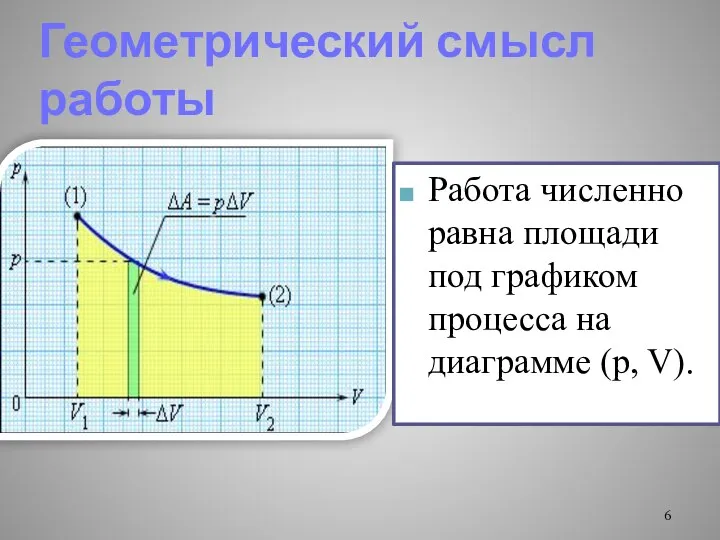
- 6. Геометрический смысл работы Работа численно равна площади под графиком процесса на диаграмме (p, V).
- 7. КОЛИЧЕСТВО ТЕПЛОТЫ
- 8. КОЛИЧЕСТВО ТЕПЛОТЫ Q = cm(t02 - t01) – нагревание (охлаждение) Q=±λm - плавление (кристаллизация) Q =
- 9. ПЕРВЫЙ ЗАКОН ТЕРМОДИНАМИКИ Обмен энергией между термодинамической системой и окружающими телами в результате теплообмена и совершаемой
- 10. Первый закон термодинамики Изменение внутренней энергии системы при переходе ее из одного состояния в другое равно
- 11. Применение 1 закона термодинамики к изопроцессам А) изохорный процесс (v=const) т.к. ΔV=0, то A= 0, значит
- 12. Применение 1 закона термодинамики к изопроцессам Б)Изотермический процесс (T=const) т.к. T=const, то ΔU = 0, значит
- 13. Применение 1 закона термодинамики к изопроцессам В)Изобарный процесс (р = const) При изобарном нагревании T>0, U>0,
- 14. Адиабатный процесс. Адиабатный процесс -термодинамический процесс в теплоизолированной системе. Теплоизолированная система - система, не обменивающаяся энергией
- 15. ΔU=A +Q Решение задач. Q =Aꞌ +ΔU 1. Идеальный газ получил количество теплоты, равное 300 Дж,
- 16. Тепловые двигатели Тепловые двигатели – это устройства, превращающие внутреннюю энергию топлива в механическую энергию.
- 17. Виды тепловых двигателей:
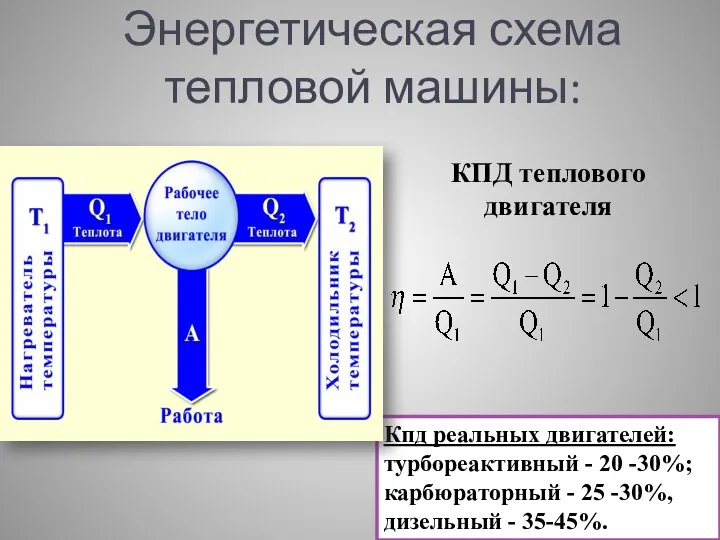
- 18. Энергетическая схема тепловой машины: КПД теплового двигателя Кпд реальных двигателей: турбореактивный - 20 -30%; карбюраторный -
- 19. Идеальная тепловая машина Идеальная тепловая машина - машина Карно (Сади Карно, Франция, 1815) Теорема Карно: кпд
- 21. Скачать презентацию















 Испарение и факторы, влияющие на него
Испарение и факторы, влияющие на него Основные понятия электродинамики
Основные понятия электродинамики Презентация (4)
Презентация (4) Устройство легкового автомобиля и величина тормозного пути транспортного средства
Устройство легкового автомобиля и величина тормозного пути транспортного средства Призматический фасонный резец
Призматический фасонный резец Техническое обслуживание и текущий ремонт сцепления, коробки передач, карданной передачи
Техническое обслуживание и текущий ремонт сцепления, коробки передач, карданной передачи Презентация на тему Солнце (11 класс)
Презентация на тему Солнце (11 класс)  Термодинамика
Термодинамика Давление газа. Уравнение состояния идеального газа. Изопроцессы
Давление газа. Уравнение состояния идеального газа. Изопроцессы Оценка одновременно нескольких параметров
Оценка одновременно нескольких параметров Элементы гидроаэромеханики (продолжение)
Элементы гидроаэромеханики (продолжение) Амперметр. Измерение силы тока в цепи
Амперметр. Измерение силы тока в цепи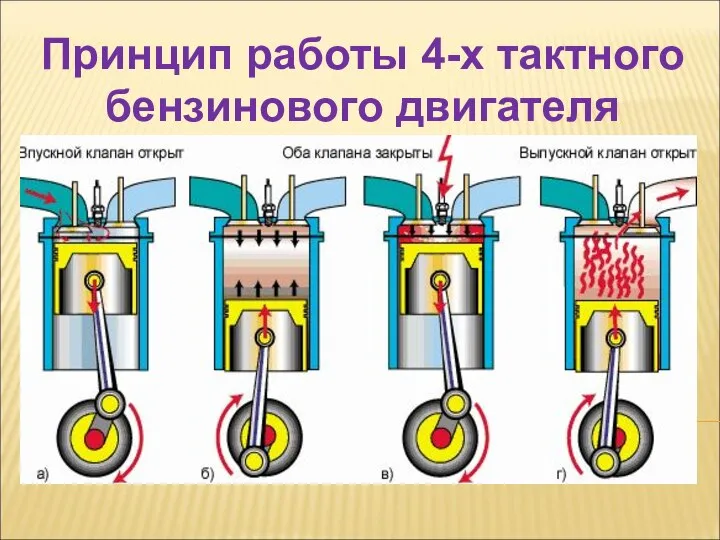 Принцип работы 4-х тактного бензинового двигателя
Принцип работы 4-х тактного бензинового двигателя Температура
Температура Циркониевые трубки
Циркониевые трубки Абрикосов Алексей Алексеевич
Абрикосов Алексей Алексеевич Методы исследование структуры. Часть 1
Методы исследование структуры. Часть 1 Общие теоремы динамики
Общие теоремы динамики Взаимодействие проводников с током
Взаимодействие проводников с током Законы физики в стихах
Законы физики в стихах Графит и алмаз. Кристаллы
Графит и алмаз. Кристаллы Тормозные рычажные передачи
Тормозные рычажные передачи Сила Архимеда 7 класс - Презентация_
Сила Архимеда 7 класс - Презентация_ Энергия магнитного поля. Объемная плотность энергии
Энергия магнитного поля. Объемная плотность энергии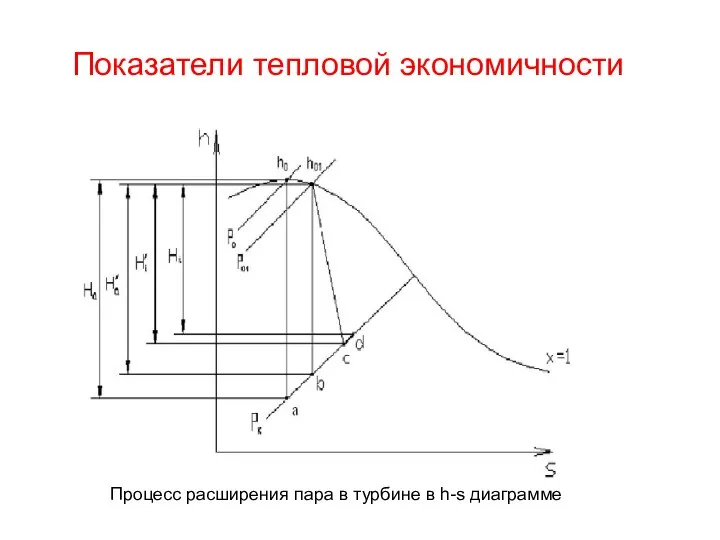 Показатели тепловой экономичности
Показатели тепловой экономичности Рентгеновское излучение их природа, и свойства
Рентгеновское излучение их природа, и свойства Чувствительность взрывчатых систем к внешним воздействиям
Чувствительность взрывчатых систем к внешним воздействиям Термодинамика. Лекция 6
Термодинамика. Лекция 6