Содержание
- 2. Общие сведения о строении вещества Электрические и механические свойства любых материалов обусловлены их структурой, которая в
- 3. Общие сведения о строении вещества Атомы любого вещества состоят из положительно заряженного ядра и окружающих его
- 4. В простейшей планетарной модели атома, предложенной Резерфордом, электроны вращаются по круговым орбитам относительно ядра. Условию сохранения
- 5. Полная энергия электрона Э в атоме складывается из кинетической энергии движения по орбите Эк и потенциальной
- 6. Чтобы устранить противоречия планетарной модели, Н.Бор постулировал квантовые условия для движения электронов в атоме. В соответствии
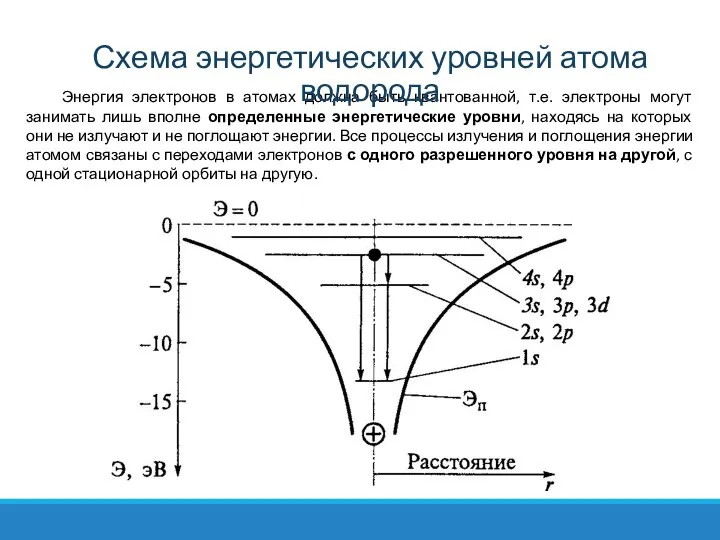
- 7. Энергия электронов в атомах должна быть квантованной, т.е. электроны могут занимать лишь вполне определенные энергетические уровни,
- 8. По мере возрастания главного квантового числа n увеличивается плотность расположения уровней на энергетической шкале. Соответственно уменьшается
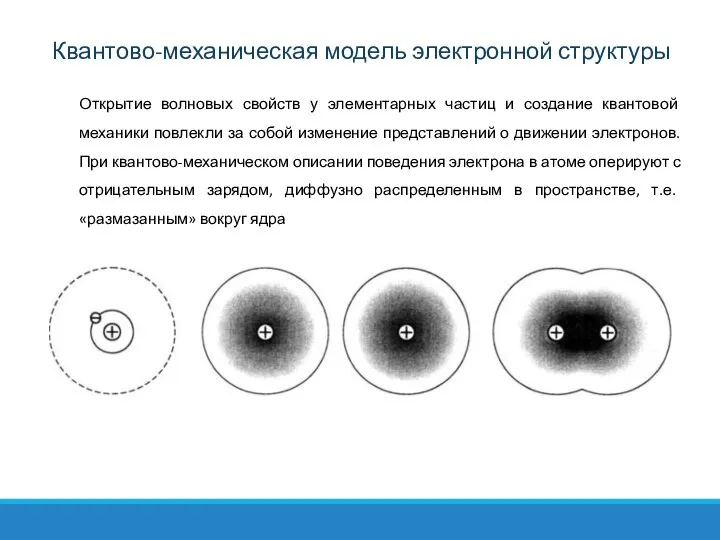
- 9. Открытие волновых свойств у элементарных частиц и создание квантовой механики повлекли за собой изменение представлений о
- 10. Учитывая волновые свойства частиц при оценке стабильности электронных состояний в атомах, постулат Бора можно переформулировать следующим
- 11. Состояниям с квантовыми числами п = 1, 2, 3, 4, 5, 6, 7 присвоены буквенные обозначения
- 12. Наряду с азимутальным вращением электрон вращается вокруг собственной оси. Представление электрона в виде волчка безусловно является
- 13. Основные видыхимической связи Если при уменьшении расстояния между атомами энергия системы понижается по сравнению с суммарной
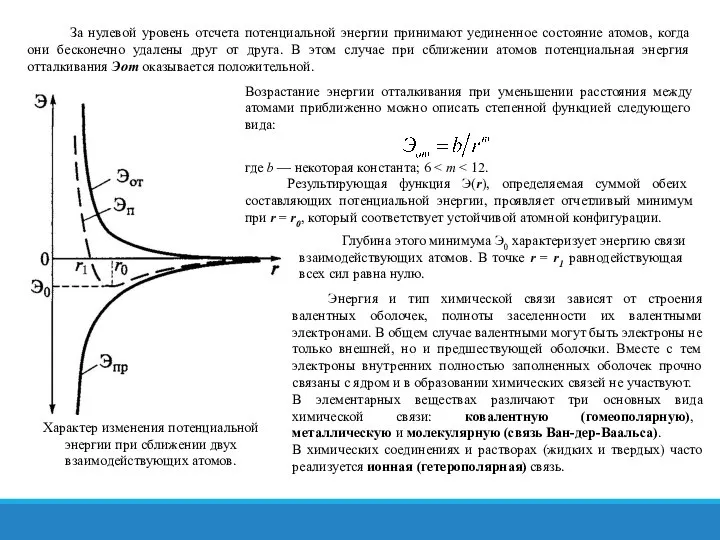
- 14. За нулевой уровень отсчета потенциальной энергии принимают уединенное состояние атомов, когда они бесконечно удалены друг от
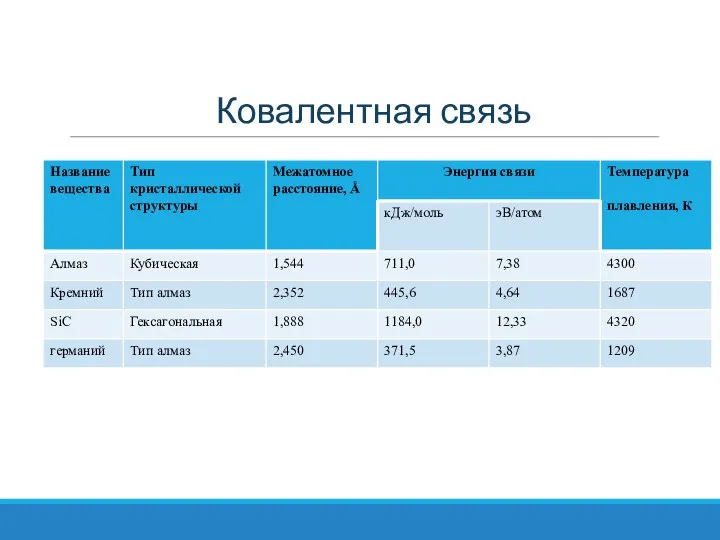
- 15. Ковалентная связь Ковалентная связь. Эта связь образуется путем спаривания валентных электронов соседних атомов при перекрытии электронных
- 16. Ковалентная связь возникает не только между одинаковыми атомами, но и между атомами различных элементов. Молекулы с
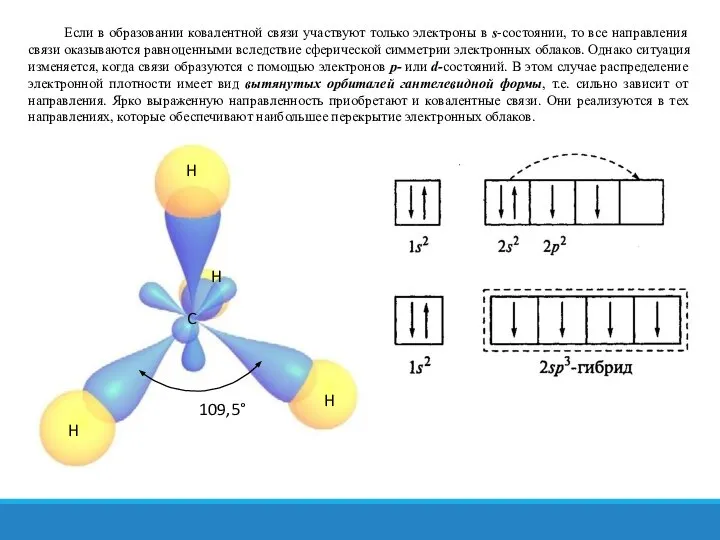
- 17. Если в образовании ковалентной связи участвуют только электроны в s-состоянии, то все направления связи оказываются равноценными
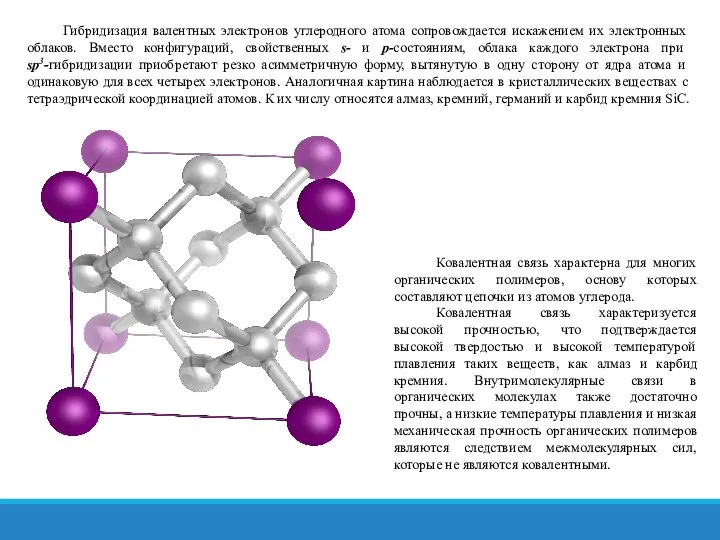
- 18. Гибридизация валентных электронов углеродного атома сопровождается искажением их электронных облаков. Вместо конфигураций, свойственных s- и p-состояниям,
- 19. Ковалентная связь
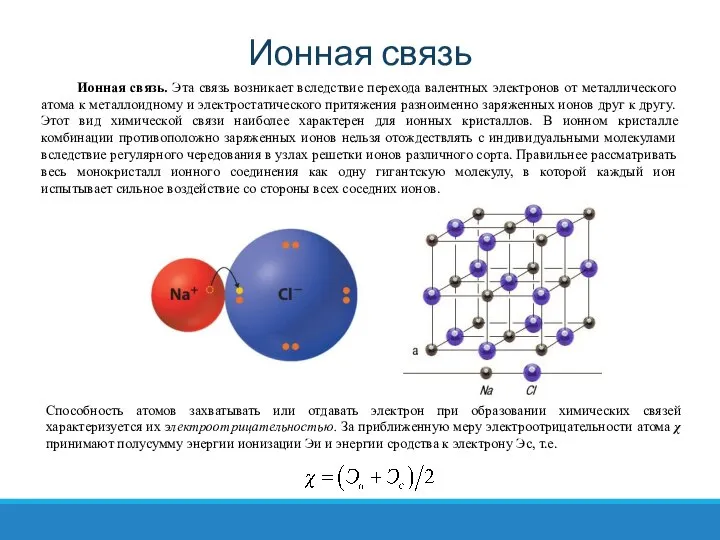
- 20. Ионная связь Способность атомов захватывать или отдавать электрон при образовании химических связей характеризуется их электроотрицательностью. За
- 21. При этом энергией сродства к электрону называют то количество энергии, которое выделяется в случае присоединения электрона
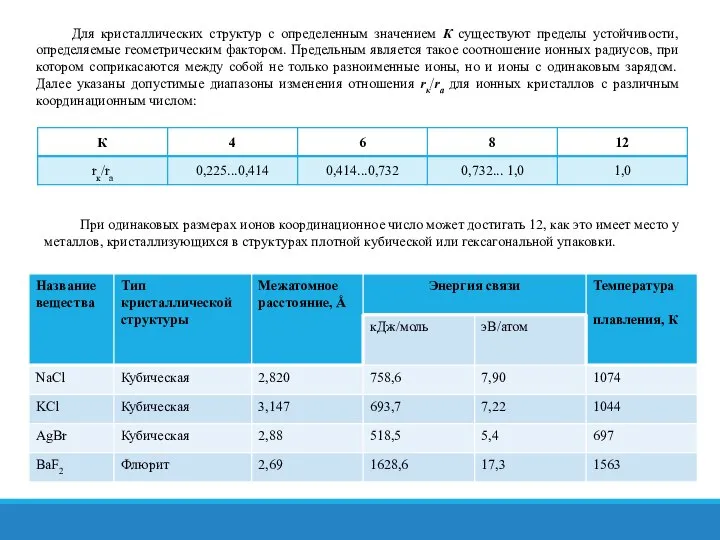
- 22. Для кристаллических структур с определенным значением К существуют пределы устойчивости, определяемые геометрическим фактором. Предельным является такое
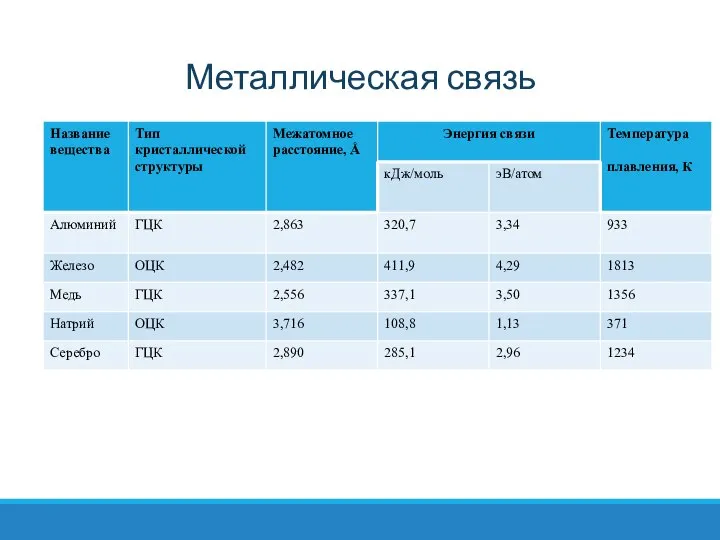
- 23. Металлическая связь Металлическая связь. Эта связь существует в системах, построенных из положительных атомных остовов, находящихся в
- 24. Об отсутствии насыщения связей в металле свидетельствует тот факт, что число связей у каждого атома существенно
- 25. Металлическая связь
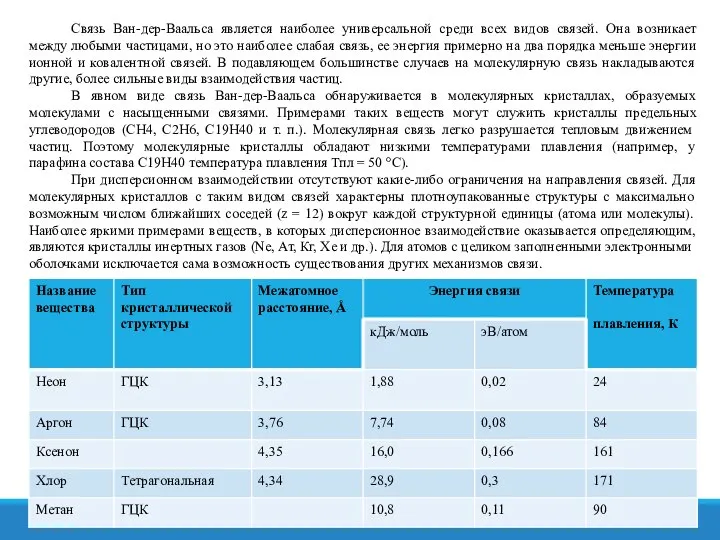
- 26. Молекулярная связь Молекулярная связь (связь Ван-дер-Ваальса). Эта связь наблюдается у ряда веществ между молекулами с ковалентным
- 27. Связь Ван-дер-Ваальса является наиболее универсальной среди всех видов связей. Она возникает между любыми частицами, но это
- 28. Структура твёрдых тел Существует две разновидности твёрдых тел: аморфная и кристаллическая Аморфные тела характеризуются хаотическим расположением
- 29. Кристаллические тела могут существовать в виде отдельных кристаллов (монокристаллы) или же состоять из отдельных зёрен (поликристаллы).
- 30. Кристаллические тела состоят из одинаковых многогранников. Каждый такой многогранник называется элементарной ячейкой кристалла. Элементарные ячейки характеризуются
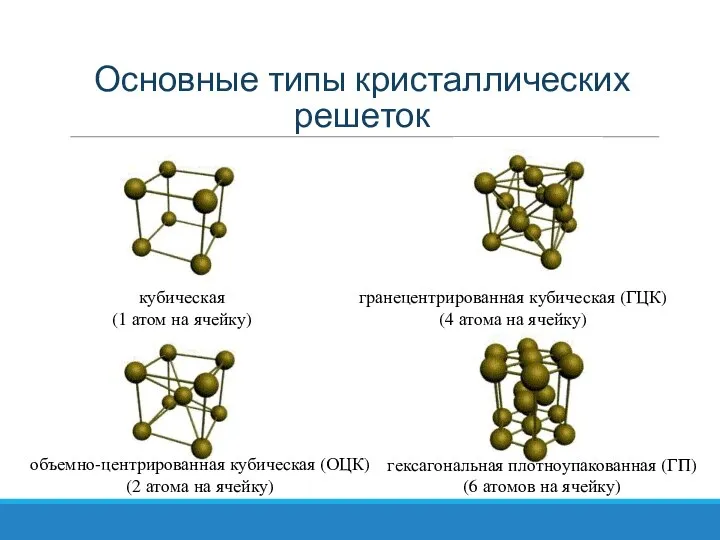
- 31. Основные типы кристаллических решеток кубическая (1 атом на ячейку) объемно-центрированная кубическая (ОЦК) (2 атома на ячейку)
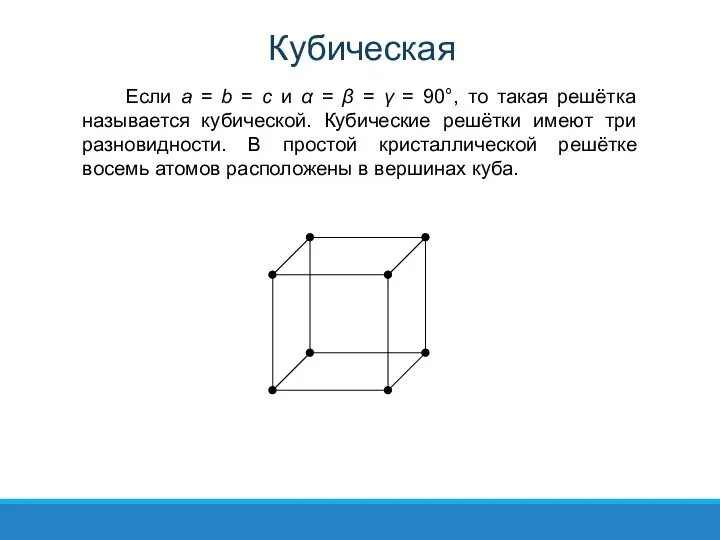
- 32. Если a = b = c и α = β = γ = 90°, то такая
- 33. В объёмоцентрированной решётке помимо восьми атомов, расположенных в вершинах куба, имеется девятый атом в центре куба.
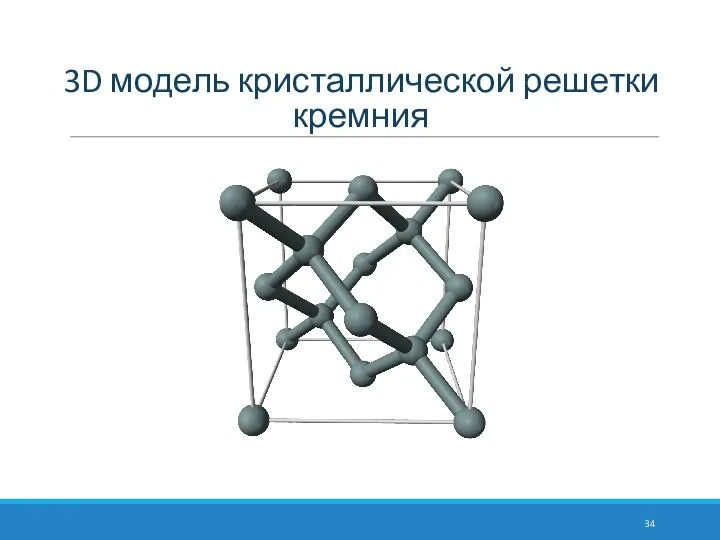
- 34. 3D модель кристаллической решетки кремния
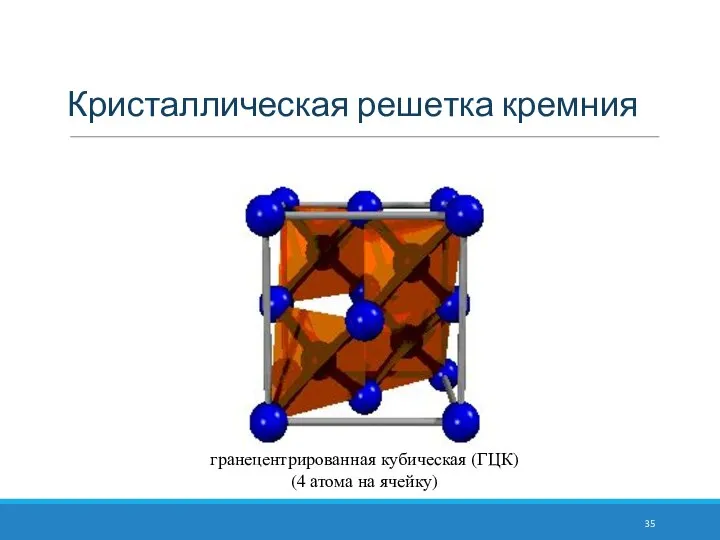
- 35. Кристаллическая решетка кремния гранецентрированная кубическая (ГЦК) (4 атома на ячейку)
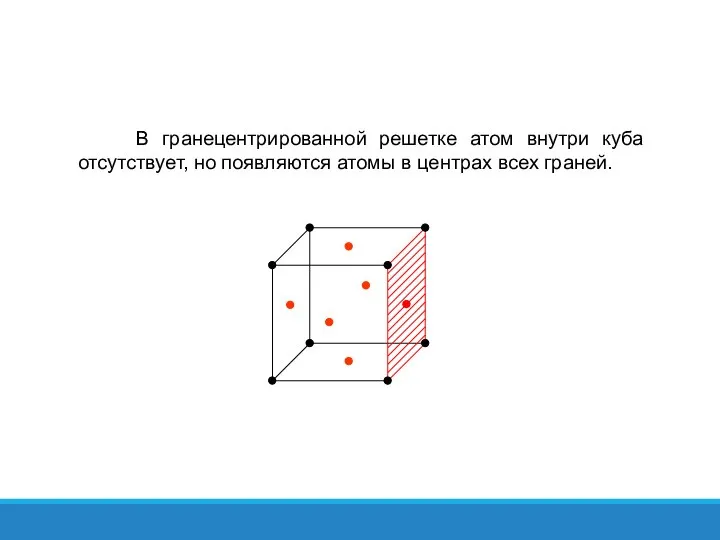
- 36. В гранецентрированной решетке атом внутри куба отсутствует, но появляются атомы в центрах всех граней.
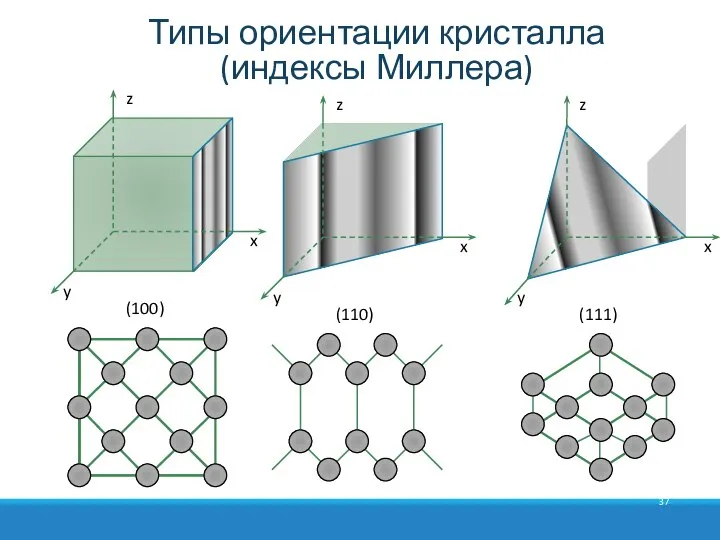
- 37. Типы ориентации кристалла (индексы Миллера) z x y (100) x y (110) z x y (111)
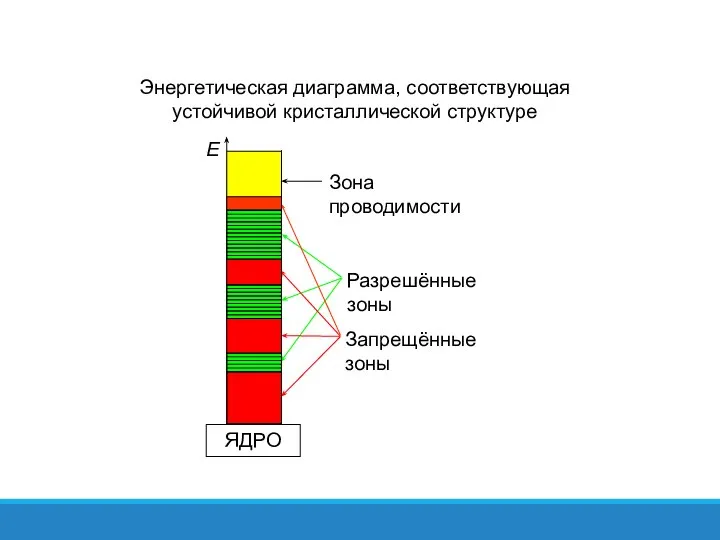
- 38. Устойчивой кристаллической структуре соответствует энергетическая диаграмма, показанная на рисунке. Разрешённые зоны отделены друг от друга запрещёнными
- 39. Энергетическая диаграмма, соответствующая устойчивой кристаллической структуре
- 40. Большинство материалов, применяемых в электронике, в нормальных условиях находятся в твердом агрегатном состоянии. Твердые тела подразделяют
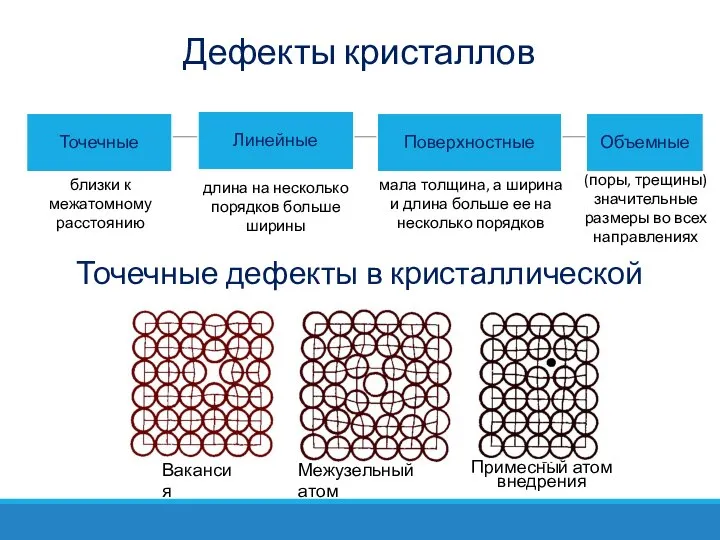
- 41. Дефекты кристаллов близки к межатомному расстоянию длина на несколько порядков больше ширины мала толщина, а ширина
- 42. Точечные дефекты в кристаллической решетке Вакансией называется пустой узел кристаллической решетки; Межузельным атомом называется атом, перемещенный
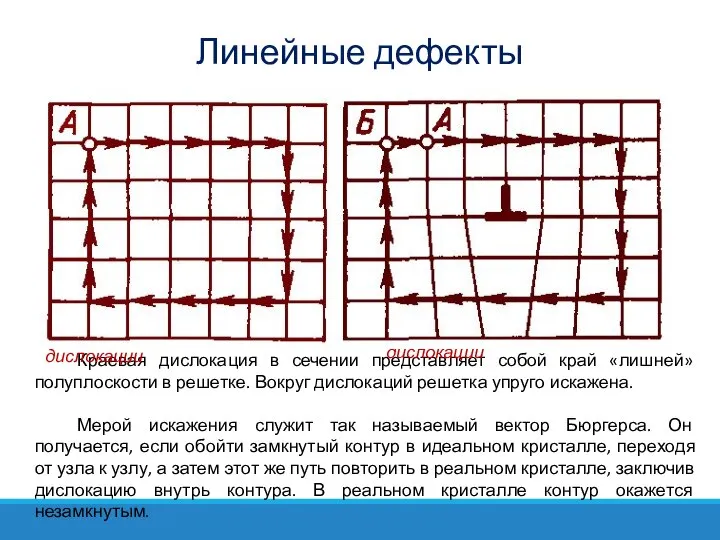
- 43. Краевая дислокация в сечении представляет собой край «лишней» полуплоскости в решетке. Вокруг дислокаций решетка упруго искажена.
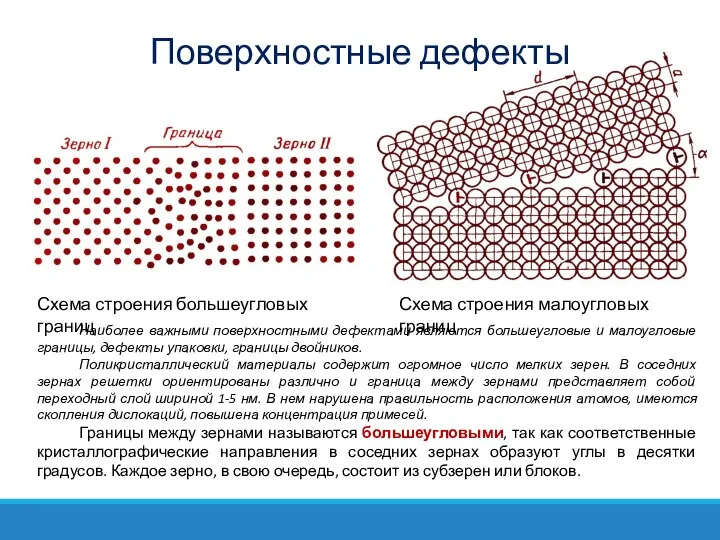
- 44. Поверхностные дефекты Схема строения большеугловых границ Схема строения малоугловых границ Наиболее важными поверхностными дефектами являются большеугловые
- 45. Кремний Элемент IV группы таблицы Менделеева. Один из самых распространенных в природе. В природе встречается в
- 46. Получение технического кремния Восстановление в электрической дуге между графитовыми электродами. Технический кремний содержит около 1 %
- 47. Достоинства кремния большое содержание кремния в виде минералов в земной коре (25 % от ее массы);
- 48. Достоинства кремниевой технологии Si p-n переходы обладают низкими токами утечки, что определяет более высокие пробивные напряжения
- 49. Технология получения чистого кремния Технический кремний растворяют в летучей жидкости и получают летучее соединение кремния (легковосстановимое,
- 50. Виды кристаллов Монокристалл – отдельный однородный кристалл, имеющий во всем объеме единую кристаллическую решетку и зависимость
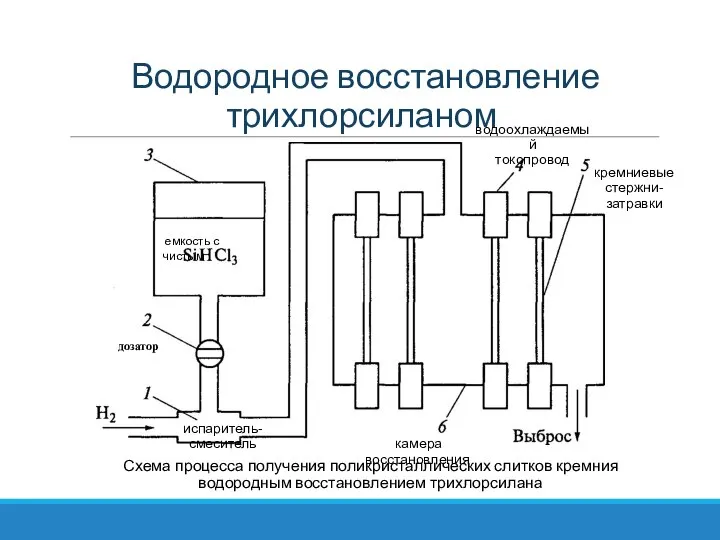
- 51. Водородное восстановление трихлорсиланом Схема процесса получения поликристаллических слитков кремния водородным восстановлением трихлорсилана испаритель-смеситель дозатор емкость с
- 52. Водородное восстановление трихлорсиланом Пар очищенного хлорсилана потоком водорода доставляют от испарителя в камеру восстановления, в которой
- 53. Поликремний
- 54. Монокремний Для изготовления микросхем требуются полупроводниковые материалы в виде пластин, вырезанных из монокристаллических слитков, имеющих форму
- 55. Выращивание кристаллов монокремния
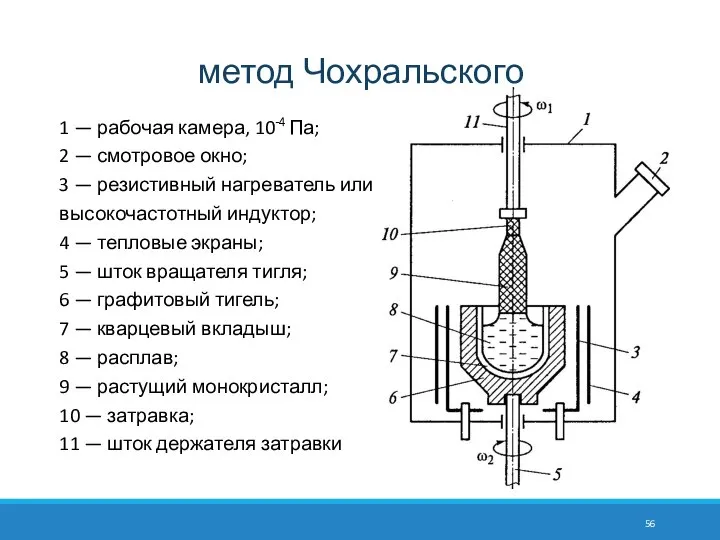
- 56. метод Чохральского 1 — рабочая камера, 10-4 Па; 2 — смотровое окно; 3 — резистивный нагреватель
- 57. Поликристаллический кремний, прошедший предварительную очистку, помещают в тигель из оптического кварцевого стекла. Разогрев тигля осуществляется индукционным
- 58. Сырьё Необожженный поликристаллический кремний
- 59. Расплавление кремния Поликремний нагревается до 1420 ˚С в специальной герметичной печи, очищенной от воздуха инертным газом
- 60. Погружение в расплав затравочного кристалла Расплавленный кремний раскручивается в тигле, а затравочный кристалл кремния, размером и
- 61. Постепенное вытягивание кристалла из расплава
- 62. Остывание кристалла Пока расплавленный монокристаллический кремний остывает, затравочный кристалл медленно извлекают, увлекая за собой монокристалл полупроводникового
- 63. Итог выращивания В результате получается сплошной кремниевый кристалл нужной длины и диаметром
- 64. Калибровка и травление Монокристалл после охлаждения калибруют по диаметру до заданного размера (300 мм) с точностью
- 65. Готовый кристалл
- 66. Материал тигля Расплавленный кремний обладает высокой химической активностью, поэтому подбор для него контейнерного и тигельного материалов
- 67. Демонстрация процесса
- 68. Характеристики получаемых слитков Диаметр слитка – от 50 до 450 мм. Длина слитка – до 6
- 69. Бестигельная зонная плавка Заготовка – поликристаллический кремний. Оборудование – одновитковый индуктор.
- 70. Последовательность операций Слиток закрепляется в индукторе. Напротив кондуктора происходит локальный нагрев вращающегося слитка. Слиток начинает перемещаться.
- 71. Демонстрация процесса
- 72. Резка дисков Резка диском с алмазной внутренней кромкой Резка проволокой с применением абразива
- 74. Скачать презентацию

















































 Законы Ньютона
Законы Ньютона Презентация на тему Ускорение
Презентация на тему Ускорение  Сборка, регулировка и испытание системы питания карбюраторных двигателей
Сборка, регулировка и испытание системы питания карбюраторных двигателей Конденсатор в цепи переменного тока
Конденсатор в цепи переменного тока Автор: Тараканова Светлана школа № 14, 8 А класс
Автор: Тараканова Светлана школа № 14, 8 А класс Конкурс Интерактивная мозаика. 7 - 8 классы
Конкурс Интерактивная мозаика. 7 - 8 классы Основы динамики
Основы динамики Презентация на тему Условия плавания тел
Презентация на тему Условия плавания тел  Блоки. Простые механизмы
Блоки. Простые механизмы Измеряем длину взвешиванием
Измеряем длину взвешиванием Презентация на тему Телевизор
Презентация на тему Телевизор  Сила трения. Ответы к заданию №1
Сила трения. Ответы к заданию №1 Определение магнитных сил
Определение магнитных сил Центр тяжести
Центр тяжести Статика. Условие равновесия
Статика. Условие равновесия Линзы. Виды линз. Условное обозначение линз. Собирающие линзы
Линзы. Виды линз. Условное обозначение линз. Собирающие линзы Статика и димамика
Статика и димамика Тепловые двигатели и охрана окружающей среды
Тепловые двигатели и охрана окружающей среды ЭДС индукции в движущихся проводниках. Решение задач
ЭДС индукции в движущихся проводниках. Решение задач Электрический ток
Электрический ток Решение задач по теме МКТ и термодинамика
Решение задач по теме МКТ и термодинамика Принципи на механиката. Задачи. 8 клас
Принципи на механиката. Задачи. 8 клас Определение, обозначение, единицы измерения равнодействующей сил
Определение, обозначение, единицы измерения равнодействующей сил Физические термины. Наблюдения и опыты
Физические термины. Наблюдения и опыты Урок решения задач на закон Архимеда (7 класс)
Урок решения задач на закон Архимеда (7 класс) Проектирование компрессорных установок горных предприятий. Занятие 7
Проектирование компрессорных установок горных предприятий. Занятие 7 Подготовка к контрольной работе №2. Динамика
Подготовка к контрольной работе №2. Динамика Основы молекулярной физики
Основы молекулярной физики