Слайд 33Общая физика. ЭЛЕМЕНТЫ АТОМНОЙ ФИЗИКИ
Притча научная
Преподаватель университета обратился к сэру Эрнесту

Резерфорду, президенту Королевской Академии и лауреату Нобелевской премии по физике за помощью. Он собирался поставить самую низкую оценку по физике одному из своих студентов, в то время как тот утверждал, что заслуживает высшего балла. Оба — преподаватель и студент — согласились положиться на суждение третьего лица, незаинтересованного арбитра. Выбор пал на Резерфорда. Экзаменационный вопрос гласил: «Объясните, каким образом можно измерить высоту здания с помощью барометра?»
Ответ студента был таким: «Нужно подняться с барометром на крышу здания, спустить барометр вниз на длинной верёвке, а затем втянуть его обратно и измерить длину верёвки, которая и покажет точную высоту здания».
Случай был и впрямь сложный, так как ответ был абсолютно полным и верным! С другой стороны, экзамен был по физике, а ответ имел мало общего с применением знаний в этой области. Резерфорд предложил студенту попытаться ответить ещё раз. Дав ему шесть минут на подготовку, он предупредил его, что ответ должен демонстрировать знание физических законов. По истечении пяти минут студент так и не написал ничего в экзаменационном листе. Резерфорд спросил его, сдаётся ли он, но тот заявил, что у него есть несколько решений проблемы, и он просто выбирает лучшее. Заинтересовавшись, Резерфорд попросил молодого человека приступить к ответу, не дожидаясь истечения отведённого срока. Новый ответ на вопрос гласил: «Поднимитесь с барометром на крышу и бросьте его вниз, замеряя время падения. Затем, используя формулу, вычислите высоту здания». Тут Резерфорд спросил своего коллегу преподавателя, доволен ли он этим ответом. Тот, наконец, сдался, признав ответ удовлетворительным. Однако студент упоминал, что знает несколько ответов, и его попросили открыть их.
— Есть несколько способов измерить высоту здания с помощью барометра, — начал студент. — Например, можно выйти на улицу в солнечный день и измерить высоту барометра и его тени, а также измерить длину тени здания. Затем, решив несложную пропорцию, определить высоту самого здания.
— Неплохо, — сказал Резерфорд. — Есть и другие способы?
— Да. Есть очень простой способ, который, уверен, вам понравится. Вы берёте барометр в руки и поднимаетесь по лестнице, прикладывая барометр к стене и делая отметки. Сосчитав количество этих отметок и умножив его на размер барометра, вы получите высоту здания. Вполне очевидный метод.
— Если вы хотите более сложный способ, — продолжал он, — то привяжите к барометру шнурок и, раскачивая его, как маятник, определите величину гравитации у основания здания и на его крыше. Из разницы между этими величинами, в принципе, можно вычислить высоту здания. В этом же случае, привязав к барометру шнурок, вы можете подняться с вашим маятником на крышу и, раскачивая его, вычислить высоту здания по периоду прецессии. — Наконец, — заключил он, — среди множества прочих способов решения данной проблемы лучшим, пожалуй, является такой: возьмите барометр с собой, найдите управляющего и скажите ему: «Господин управляющий, у меня есть замечательный барометр. Он ваш, если вы скажете мне высоту этого здания».
Тут Резерфорд спросил студента, неужели он действительно не знал общепринятого решения этой задачи. Тот признался, что знал, но сказал при этом, что сыт по горло школой и колледжем, где учителя навязывают ученикам свой способ мышления.
Студент этот был Нильс Бор (1885 – 1962), датский физик, лауреат Нобелевской премии 1922 г.

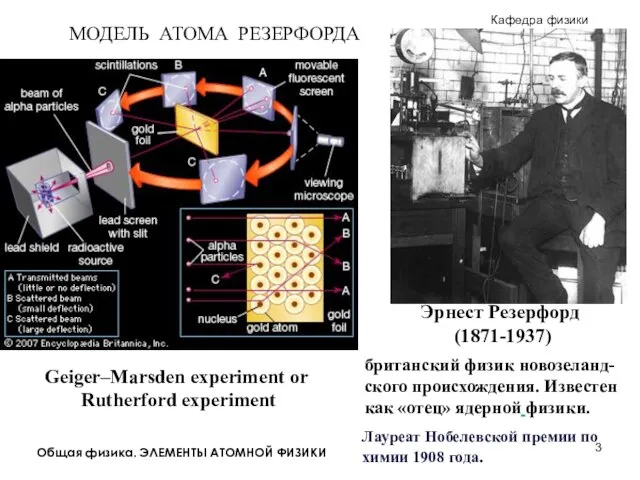


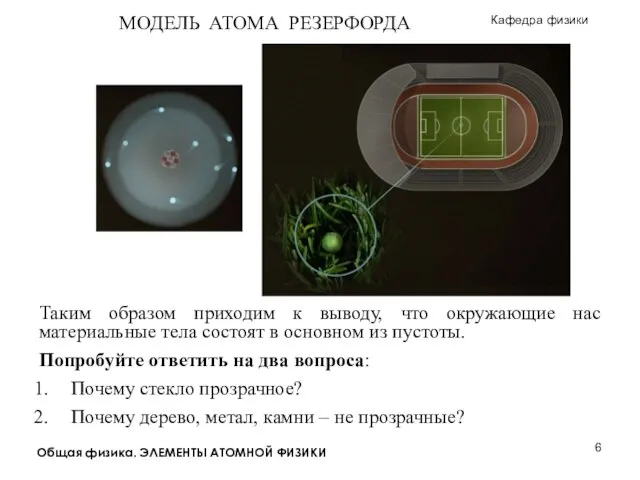





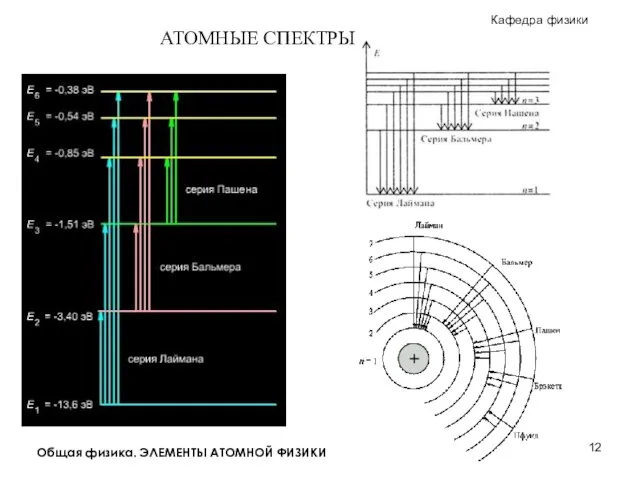



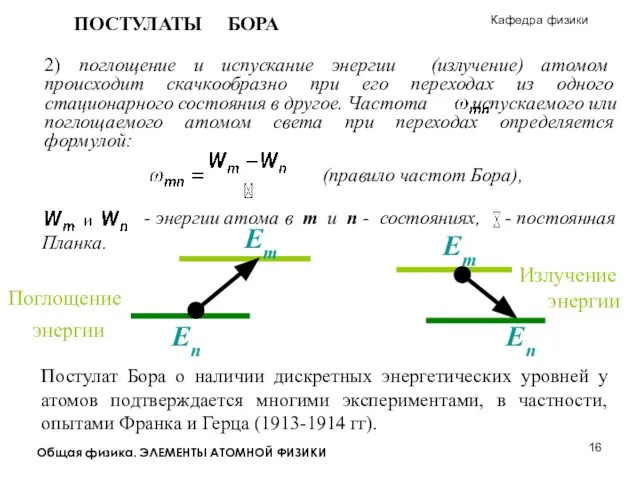










 Пузырьковая камера
Пузырьковая камера Вещества и явления в окружающем мире
Вещества и явления в окружающем мире Колебания математического и пружинного маятников
Колебания математического и пружинного маятников Паровая машина Ползунова
Паровая машина Ползунова Дополнительное оборудование
Дополнительное оборудование Автономные инверторы
Автономные инверторы T1klsAl4UwZclqq9KGDB6w
T1klsAl4UwZclqq9KGDB6w Сравнение эксплуатационных характеристик lada vestaи и lada xray
Сравнение эксплуатационных характеристик lada vestaи и lada xray Гальванические источники
Гальванические источники Сравнение сил. 7класс
Сравнение сил. 7класс Модели молекул простого и сложного вещества
Модели молекул простого и сложного вещества Гидродинамика. Движение жидкости
Гидродинамика. Движение жидкости Особенности гидродинамики потока во входном участке активной зоны реактора PWR с тепловыделяющими сборками ТВС-Квадрат
Особенности гидродинамики потока во входном участке активной зоны реактора PWR с тепловыделяющими сборками ТВС-Квадрат Работа, мощность и энергия
Работа, мощность и энергия Недомолвки в теории и недостатки в практике регистрации частичных разрядов
Недомолвки в теории и недостатки в практике регистрации частичных разрядов Полупроводниковые лазеры, их особенности
Полупроводниковые лазеры, их особенности Космология Ньютона. Часть 2. Физика космоса
Космология Ньютона. Часть 2. Физика космоса Напряжения в эллиптической оболочке, соединенной с цилиндром
Напряжения в эллиптической оболочке, соединенной с цилиндром Сцепление ГАЗ 53-12. Урок №70
Сцепление ГАЗ 53-12. Урок №70 Презентация на тему: основы термодинамики
Презентация на тему: основы термодинамики Автомобили III
Автомобили III Виды ионизирующего излучения и основные понятия дозиметрии
Виды ионизирующего излучения и основные понятия дозиметрии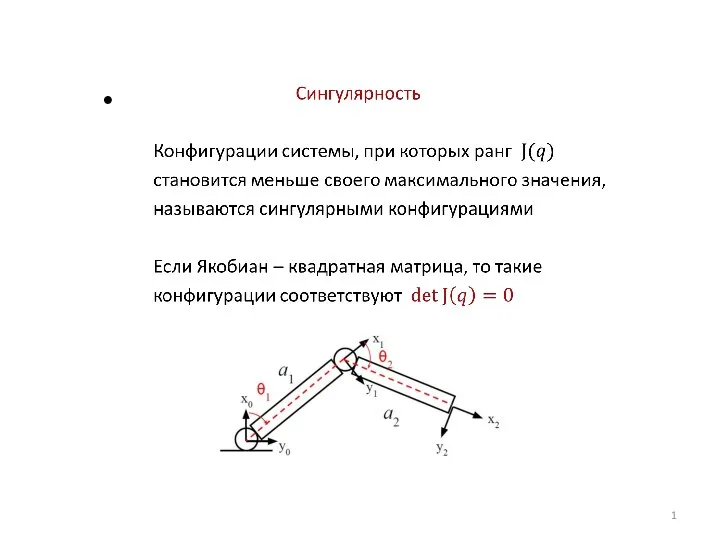 Сингулярность. Сингулярные конфигурации
Сингулярность. Сингулярные конфигурации Давление газа
Давление газа Дирижаблестроение. Тема № 1
Дирижаблестроение. Тема № 1 Криволинейное движение. Движение тела по окружности
Криволинейное движение. Движение тела по окружности Внутренняя энергия
Внутренняя энергия Колесный бульдозер
Колесный бульдозер