Содержание
- 2. Перед тем как показывать презентацию учащимся, внимательно изучите переходы анимаций в каждом слайде. Обратите внимание на
- 3. С помощью уравнения состояния идеального газа можно исследовать процессы, в которых масса газа и один из
- 4. Изохорный процесс - процесс изменения состояния термодинамической системы при постоянном давлении (от греческого слова «хорема» -
- 5. Газовые законы p = const T = const Зависимость объема от температуры при постоянном давлении графически
- 6. На рисунке дан график изменения состояния идеального газа в координатах V,p. Представить этот процесс в координатных
- 7. На рисунке дан график изменения состояния идеального газа в координатах T,V. Представить этот процесс в координатных
- 8. Газовые законы Резюме Газовые законы - частный случай уравнения состояния идеального газа, один из параметров которого
- 10. Скачать презентацию
Слайд 2Перед тем как показывать презентацию учащимся, внимательно изучите переходы анимаций в каждом

Обратите внимание на использование «мышки» при работе с анимированными слайдами.
!
Слайд 3 С помощью уравнения состояния идеального газа можно исследовать процессы, в которых
С помощью уравнения состояния идеального газа можно исследовать процессы, в которых

Газовые законы
Количественные зависимости между двумя параметрами газа при фиксированном значении третьего называют газовыми законами.
Правда, в действительности ни один процесс не может протекать при строго фиксированном значении какого-либо параметра. Всегда имеются те или иные воздействия, нарушающие постоянство температуры, давления или объема. Лишь в лабораторных условиях удается поддерживать постоянство того или иного параметра с высокой точностью, но в действующих технических устройствах и в природе это практически неосуществимо.
Процессы, протекающие при неизменном значении одного из параметров, называют изопроцессами (от греческого слова «изос» равный).
Процессы
Масса газа неизменна
Const
Меняется
p
T,V
p,V
p,T
T
V
Изопроцесс - это идеализированная модель реального процесса, которая только приближенно отражает действительность.
Изороцессы
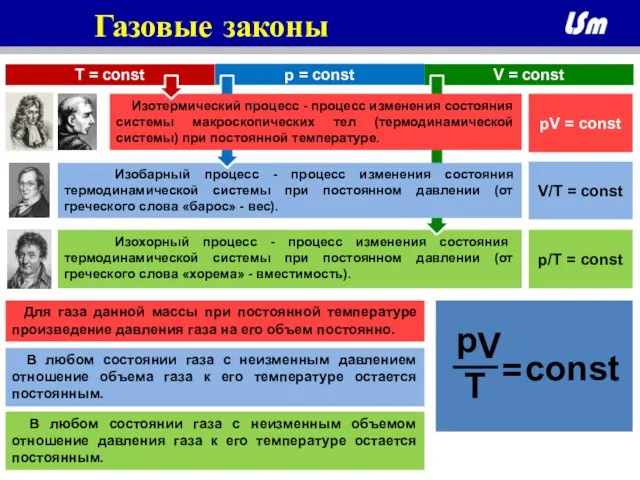
Слайд 4 Изохорный процесс - процесс изменения состояния термодинамической системы при постоянном давлении
Изохорный процесс - процесс изменения состояния термодинамической системы при постоянном давлении
V = const
Изобарный процесс - процесс изменения состояния термодинамической системы при постоянном давлении (от греческого слова «барос» - вес).
Газовые законы
p = const
T = const
Изотермический процесс - процесс изменения состояния системы макроскопических тел (термодинамической системы) при постоянной температуре.
pV = const
V/T = const
p/T = const
р
Т
=
const
V
В любом состоянии газа с неизменным объемом отношение давления газа к его температуре остается постоянным.
Для газа данной массы при постоянной температуре произведение давления газа на его объем постоянно.
В любом состоянии газа с неизменным давлением отношение объема газа к его температуре остается постоянным.
Слайд 5
Газовые законы
p = const
T = const
Зависимость объема от температуры при постоянном
Газовые законы
p = const
T = const
Зависимость объема от температуры при постоянном

Зависимость давления газа от объема при постоянной температуре графически изображают кривой, которую называют изотермой. Изотерма газа изображает обратно пропорциональную зависимость между давлением и объемом. Кривую такого рода в математике называют гиперболой.
p
V
T2
T1
T2 >T1
V
T
p2
p1
p2 >p1
p
T
V2
V1
v1 O O O Зависимость давления от температуры при постоянном давлении изображается прямой, называемой изохорой. V = const В соответствии с уравнением В области низких температур все изобары идеального газа сходятся в точке T = 0. Но это не означает, что объем реального газа обращается в нуль. Для того чтобы процесс происходил при постоянной температуре, сжатие или расширение газа должно происходить очень медленно. Дело в том, что, например, при сжатии газ нагревается, так как при движении поршня в сосуде скорость молекул после ударов о поршень увеличивается, а следовательно, увеличивается и температура газа. Именно поэтому для реализации изотермического процесса надо после небольшого смещения поршня подождать, когда температура газа в сосуде опять станет равной температуре окружающего воздуха.
p = const ·T все изохоры идеального газа начинаются в точке T=0. Значит, давление идеального газа при абсолютном нуле равно нулю.
Все газы при сильном охлаждении превращаются в жидкости, а к жидкостям уравнение состояния идеального газа неприменимо. Именно поэтому, начиная с некоторого значения температуры, зависимость объема от температуры проводится на графике штриховой линией. В действительности таких значений температуры и давления у вещества в газообразном состоянии быть не может.
Слайд 6 На рисунке дан график изменения состояния идеального газа в координатах V,p.
На рисунке дан график изменения состояния идеального газа в координатах V,p.

Газовые законы
Алгоритм решения графических задач
●
●
●
●
1
2
3
4
1 – 2:
T = const, p ,V
2 – 3: p = const, V ,T
3 – 4: T = const, V , p
4 – 1: p = const, V , p
●
1
●
2
●
●
3
4
2
3
4
1
●
●
Обратите внимание.
При построении изотерм зависимость параметров p от V или V от p обратно пропорциональная. Изотерма представляет гиперболу.
№1
Слайд 7
На рисунке дан график изменения состояния идеального газа в координатах
На рисунке дан график изменения состояния идеального газа в координатах

Газовые законы
Алгоритм решения графических задач
●
●
1
2
3
1 – 2:
p = const, T ,V
2 – 3: T = const, V ,p
3 – 1: V = const, T , p
1
●
2
3
2
3
1
●
●
Обратите внимание.
При построении изотерм зависимость параметров p от V или V от p обратно пропорциональная. Изотерма представляет гиперболу.
Изобары и изохоры сходятся в точке T = 0.
№2
●
●
Слайд 8Газовые законы
Резюме
Газовые законы - частный случай уравнения состояния идеального газа, один
Газовые законы
Резюме
Газовые законы - частный случай уравнения состояния идеального газа, один

 Удельное электрическое сопротивление горных пород со сложной структурой пористого пространства
Удельное электрическое сопротивление горных пород со сложной структурой пористого пространства Фазовые диаграммы состояния вещества
Фазовые диаграммы состояния вещества Презентация по физике "Решение задач на расчет работы и мощности" -
Презентация по физике "Решение задач на расчет работы и мощности" -  Устройство, работа, возможные неисправности системы охлаждения двигателя КамАЗ -740. ТО системы охлаждения
Устройство, работа, возможные неисправности системы охлаждения двигателя КамАЗ -740. ТО системы охлаждения Основы физической органической химии. Сигма-ро анализ
Основы физической органической химии. Сигма-ро анализ Плоская задача теории упругости
Плоская задача теории упругости Сборка механического манипулятора
Сборка механического манипулятора Основы ядерной физики и дозиметрии
Основы ядерной физики и дозиметрии Дефекты машинной строчки (технология, 7 класс)
Дефекты машинной строчки (технология, 7 класс) Презентация на тему Звуковые волны в различных средах
Презентация на тему Звуковые волны в различных средах  Ophthalmic and Physiological Optics, Volume
Ophthalmic and Physiological Optics, Volume Константа
Константа Аморфные тела
Аморфные тела Электрическая свеча Ябочкова
Электрическая свеча Ябочкова Фундаментальные опыты в молекулярной физике
Фундаментальные опыты в молекулярной физике Строение атома
Строение атома Порядок решения задач по динамике МТ
Порядок решения задач по динамике МТ Что такое энергия?
Что такое энергия? Повышение КПД ГТУ путём внедрения регенеративного цикла
Повышение КПД ГТУ путём внедрения регенеративного цикла Применение первого закона термодинамики к изобарическому процессу
Применение первого закона термодинамики к изобарическому процессу Энергия топлива. Удельная теплота сгорания
Энергия топлива. Удельная теплота сгорания Конференция. Чёрная дыра
Конференция. Чёрная дыра Каналы связи по линиям электропередач
Каналы связи по линиям электропередач Основы термодинамики
Основы термодинамики Радиоактивность. Открытие
Радиоактивность. Открытие Оптика. Уравнения Максвелла. (Лекция 1)
Оптика. Уравнения Максвелла. (Лекция 1) Адсорбция комплексных соединений на нанопористых соединениях
Адсорбция комплексных соединений на нанопористых соединениях Изменение изотопного состава. Выгорание топлива
Изменение изотопного состава. Выгорание топлива