Содержание
- 2. 1.Что изучает молекулярно – кинетическая теория? 2.Какая физическая модель используется в МКТ? Дайте краткую характеристику этой
- 3. 1) Английский ученый Р. Бойль в 1662 г. и независимо от него французский ученый Э. Мариотт
- 4. Давление p, объем V и температура T идеального газа связаны между собой уравнением Менделеева–Клапейрона: pV =
- 5. Информатор Вы ответственны за поступление информации Регистратор Вы ответственны за сбор данных в ходе исследования и
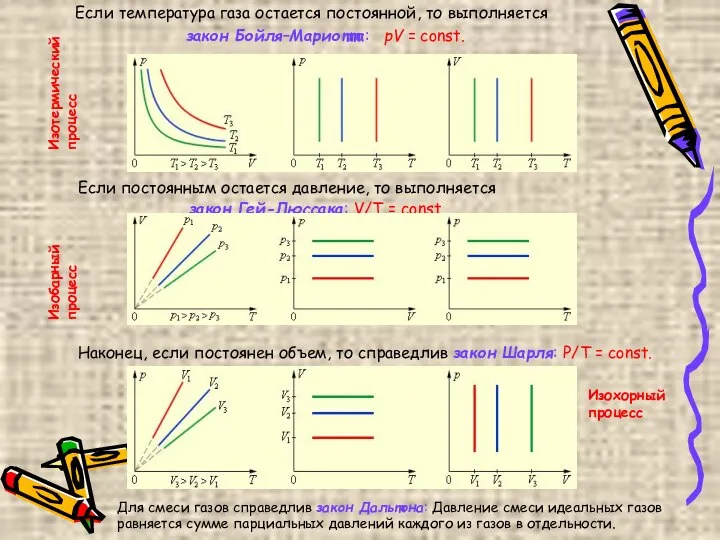
- 6. Если температура газа остается постоянной, то выполняется закон Бойля–Мариотта: pV = const. Если постоянным остается давление,
- 7. Изотермическим процессом можно считать приближенно процесс медленного сжатия воздуха или расширения газа под поршнем насоса при
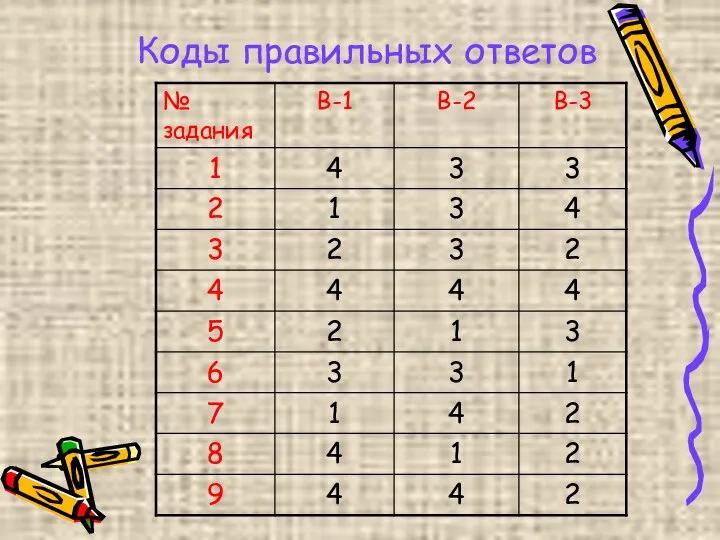
- 8. Коды правильных ответов
- 9. Критерии оценки знаний: Задания – баллы Достижения 1 - 10 Базовый уровень – 40 баллов -
- 10. Подведение итогов: Что было изучено сегодня на уроке? Как бы вы сформулировали тему урока? Что интересного
- 12. Скачать презентацию







 Взаимодействие тел. Масса. Инерция
Взаимодействие тел. Масса. Инерция КПД механизма
КПД механизма Уравнения математической физики
Уравнения математической физики Мощность. Единицы мощности
Мощность. Единицы мощности Магниты
Магниты Теплотехнические измерения
Теплотехнические измерения Конденсаторы. Подготовка к ЕГЭ
Конденсаторы. Подготовка к ЕГЭ Квантовая механика
Квантовая механика Основы обеспечения микроклимата
Основы обеспечения микроклимата Леонардо да Винчи, его вклад в развитие механики
Леонардо да Винчи, его вклад в развитие механики Определение периода дифракционной решетки
Определение периода дифракционной решетки Полное отражение
Полное отражение Тест по теме «Электромагнитные явления» Баскакова Т. И. Учитель физики МОУ ООШ № 48 г. Архангельск
Тест по теме «Электромагнитные явления» Баскакова Т. И. Учитель физики МОУ ООШ № 48 г. Архангельск Вращение шестеренки
Вращение шестеренки Кинетика роста островков оксидной фазы на поверхности Ni в окрестности точки Кюри
Кинетика роста островков оксидной фазы на поверхности Ni в окрестности точки Кюри Оптика и квантовая физика. Лекция 7
Оптика и квантовая физика. Лекция 7 Что изучает физика
Что изучает физика Презентация на тему Электронно-лучевая трубка (10 класс)
Презентация на тему Электронно-лучевая трубка (10 класс)  Преломление света
Преломление света Типовая задача терморегулирования
Типовая задача терморегулирования Шаговое напряжение
Шаговое напряжение Воздухоплавание
Воздухоплавание Презентация на тему Самоиндукция (9 класс)
Презентация на тему Самоиндукция (9 класс)  Презентация на тему Внутренняя энергия
Презентация на тему Внутренняя энергия  Сверхпроводимость материалов
Сверхпроводимость материалов Взаимодействие ионизирующего излучения с веществом
Взаимодействие ионизирующего излучения с веществом Эвольвента. Лекции 9
Эвольвента. Лекции 9 Закон всемирного тяготения
Закон всемирного тяготения