Содержание
- 2. Цели: 1. Образовательные: познакомить учащихся с газовыми законами; обобщить и систематизировать знания учащихся о свойствах газов.
- 3. Что является объектом изучения МКТ? Идеальный газ. Что в МКТ называется идеальным газом? Идеальный газ –
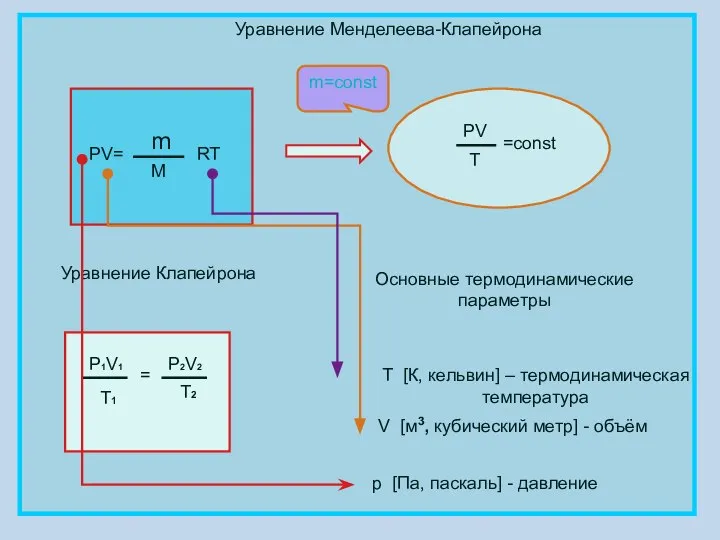
- 4. Уравнение Менделеева-Клапейрона PV= m M RT PV T =const Уравнение Клапейрона P1V1 T1 = P2V2 T2
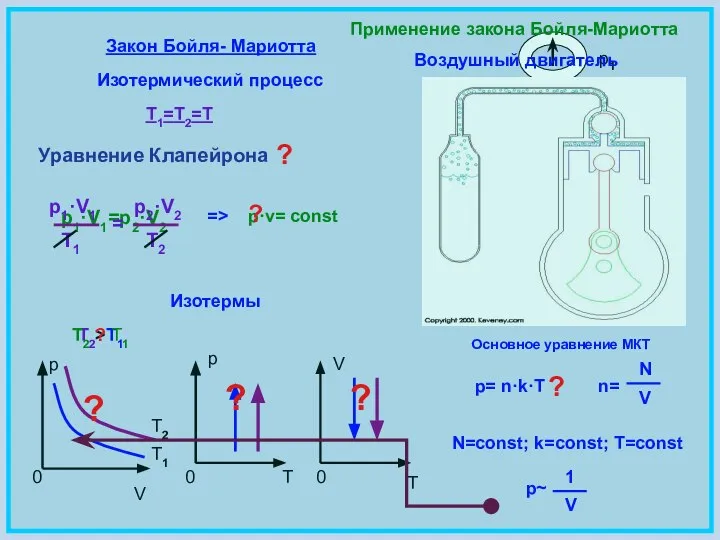
- 5. Закон Бойля- Мариотта Изотермический процесс T1=T2=T p·v= const p1·V1=p2·V2 p V 0 p 0 T V
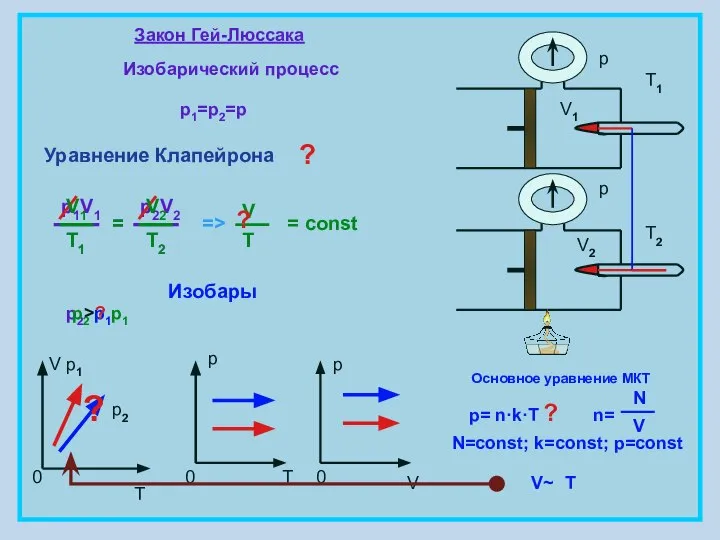
- 6. Закон Гей-Люссака Изобарический процесс p1=p2=p = const V T 0 p 0 T p 0 V
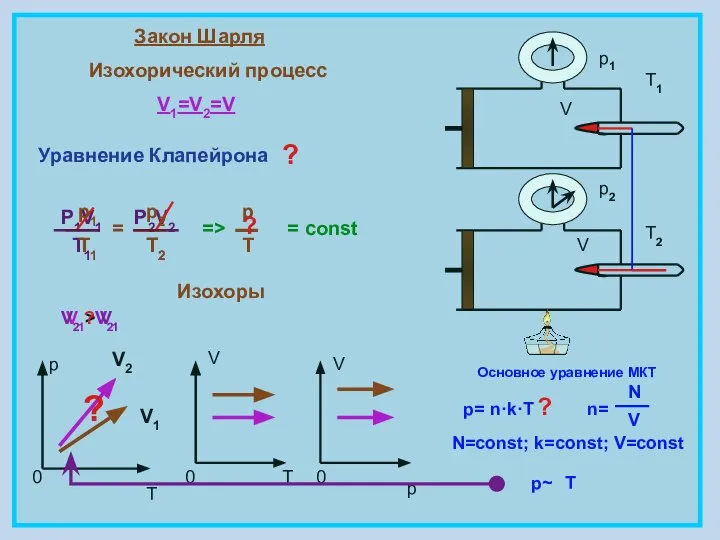
- 7. Закон Шарля Изохорический процесс V1=V2=V = const p T 0 V 0 T V 0 p
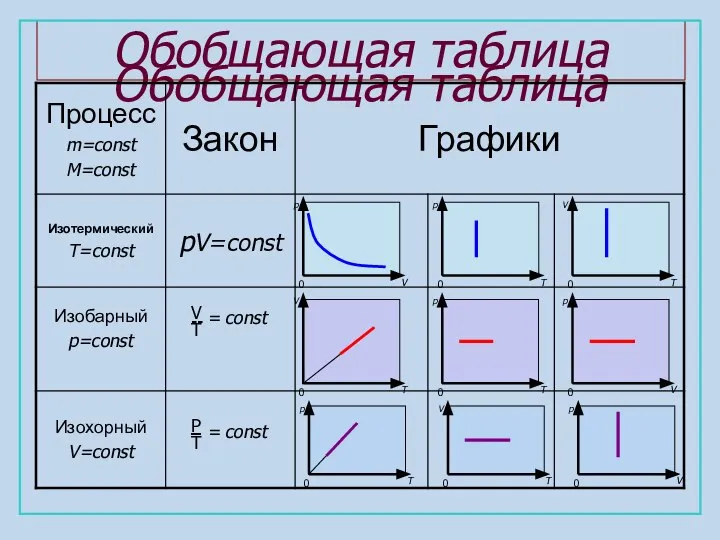
- 8. Обобщающая таблица Обобщающая таблица V T -- = const P T const =
- 10. Скачать презентацию


 Технологии беспроводной передачи энергии методом электромагнитной индукции
Технологии беспроводной передачи энергии методом электромагнитной индукции Способы соединения частей: шестеренки
Способы соединения частей: шестеренки Единицы массы: центнер, тонна
Единицы массы: центнер, тонна Архімедова сила. Плавання тіл. Виштовхування тіла
Архімедова сила. Плавання тіл. Виштовхування тіла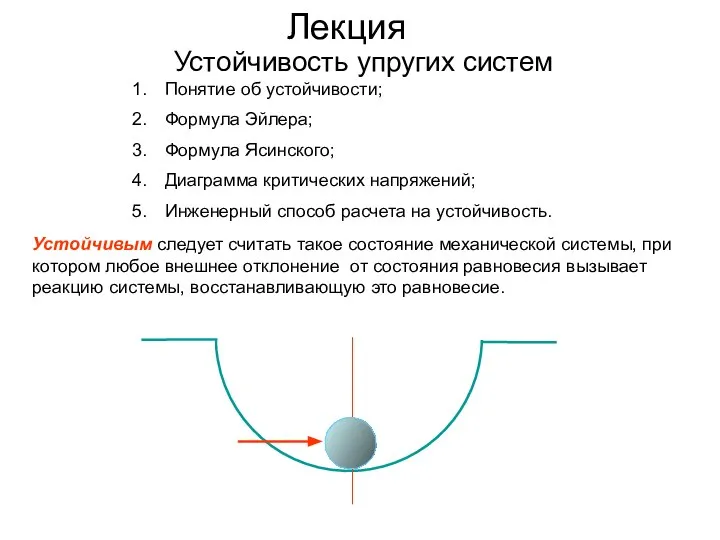 Устойчивость упругих систем
Устойчивость упругих систем Теория относительности. (Лекция 1)
Теория относительности. (Лекция 1) Тематический состав ВсОШ по физике для 10-ого класса
Тематический состав ВсОШ по физике для 10-ого класса Грозозащита воздушных линий электропередачи
Грозозащита воздушных линий электропередачи Расчет эффективности установки теплоотражающего экрана за отопительным прибором
Расчет эффективности установки теплоотражающего экрана за отопительным прибором Все о нагрузках. Практическое занятие
Все о нагрузках. Практическое занятие Сила Архимеда
Сила Архимеда Квантовая радиофизика
Квантовая радиофизика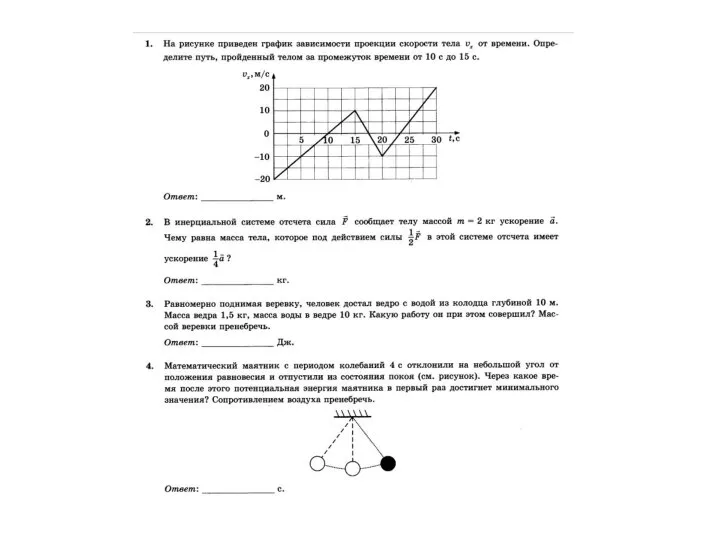 График зависимости скорости проекции тела от времени
График зависимости скорости проекции тела от времени Движение частиц в экспериментах ЯМР
Движение частиц в экспериментах ЯМР Fizika - sila
Fizika - sila Силы в механике
Силы в механике Относительность движения
Относительность движения Управляющие процессы и их формализованное описание
Управляющие процессы и их формализованное описание Закон Архимеда
Закон Архимеда Инструментальные методы анализа: хроматографические методы
Инструментальные методы анализа: хроматографические методы Презентация Microsoft PowerPoint
Презентация Microsoft PowerPoint Лабораторные работы по курсу Математическое моделирование технических систем
Лабораторные работы по курсу Математическое моделирование технических систем Открытие и наблюдение элементарных частиц
Открытие и наблюдение элементарных частиц Презентация на тему Закон преломления света (8 класс)
Презентация на тему Закон преломления света (8 класс)  Динамика точки. Законы Галилея – Ньютона
Динамика точки. Законы Галилея – Ньютона Соединение проводников
Соединение проводников Автоматическое управление движением судном
Автоматическое управление движением судном ВКР: Совершенствование системы ТО с разработкой приспособления для обслуживания тормозной системы
ВКР: Совершенствование системы ТО с разработкой приспособления для обслуживания тормозной системы