Содержание
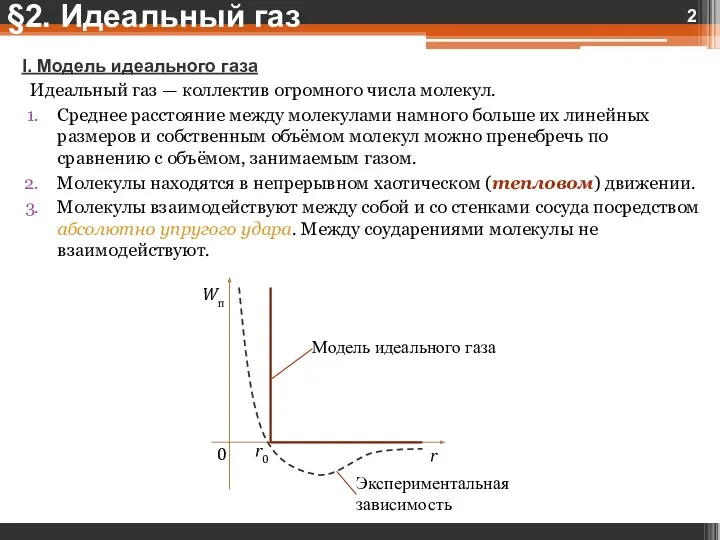
- 2. I. Модель идеального газа Идеальный газ — коллектив огромного числа молекул. Среднее расстояние между молекулами намного
- 3. §2. Идеальный газ II. Уравнение состояния идеального газа. Газовые законы Уравнение состояния идеального газа: Частные случаи
- 4. §2. Идеальный газ — постоянная Больцмана Концентрация молекул — ФВ — характеристика макросистемы, равная числу частиц
- 5. III. Основное уравнение МКТ Рассмотрим равновесный идеальный газ, состоящий из одинаковых молекул массой m0. Все молекулы
- 6. 2. Число ударов о стенку за время Δt >> τ i-я скоростная группа молекул: v =
- 7. 4. Учёт давления всех скоростных групп молекул Закон Дальтона: — средняя квадратичная скорость молекулы идеального газа
- 9. Скачать презентацию





 I закон термодинамики
I закон термодинамики Каты җисемнәр,сыеклыклар һәм газларның басымы
Каты җисемнәр,сыеклыклар һәм газларның басымы Третий закон Ньютона
Третий закон Ньютона Тепловые двигатели
Тепловые двигатели Принцип работы 4-х тактного дизельного двигателя
Принцип работы 4-х тактного дизельного двигателя Презентация на тему Перспективы развития физики
Презентация на тему Перспективы развития физики  Оптика
Оптика Решение задач Агрегатные состояния
Решение задач Агрегатные состояния Фотоэффект
Фотоэффект Механическая работа и мощность
Механическая работа и мощность Что и как изучает физика
Что и как изучает физика Температура и тепловое равновесие. Определение температуры
Температура и тепловое равновесие. Определение температуры Физические величины. Измерение физических величин. Точность и погрешность измерений
Физические величины. Измерение физических величин. Точность и погрешность измерений Перспективы применения мономолекулярных магнитов (МMM) (single molecule magnets – SMM)
Перспективы применения мономолекулярных магнитов (МMM) (single molecule magnets – SMM) Җылылык күренешләре
Җылылык күренешләре Звук
Звук Основные понятия электродинамики
Основные понятия электродинамики Закон сохранения энергии
Закон сохранения энергии Растяжение-сжатие статически неопределимого прямого бруса
Растяжение-сжатие статически неопределимого прямого бруса Расчёт пути и времени движения
Расчёт пути и времени движения Скорость. Единицы скорости
Скорость. Единицы скорости Влажность воздуха
Влажность воздуха Единицы работы электрического тока, применяемые на практике
Единицы работы электрического тока, применяемые на практике Атомное ядро
Атомное ядро Доклад о История водоплавания
Доклад о История водоплавания Концептуальные основы современной химии. Синергетика и самоорганизация
Концептуальные основы современной химии. Синергетика и самоорганизация Презентация на тему Основные понятия и законы динамики
Презентация на тему Основные понятия и законы динамики  mehanicheskie_kolebaniya
mehanicheskie_kolebaniya