Содержание
- 2. Что такое агрегатное состояние вещества? Агрегатное состояние вещества – это состояние в котором тело находится при
- 3. Жидкое и твердое состояние вещества В жидкостях и твёрдых телах молекулы расположены ближе друг к другу
- 4. Газообразное состояние вещества. В газах при атмосферном давлении расстояние между молекулами намного больше размера самих молекул.
- 5. Важно! Молекулы одного и того же вещества в твёрдом, жидком и газообразном состоянии ничем не отличаются
- 6. Для чего используется переход вещества из одного агрегатного состояния в другое. Переход вещества из одного агрегатного
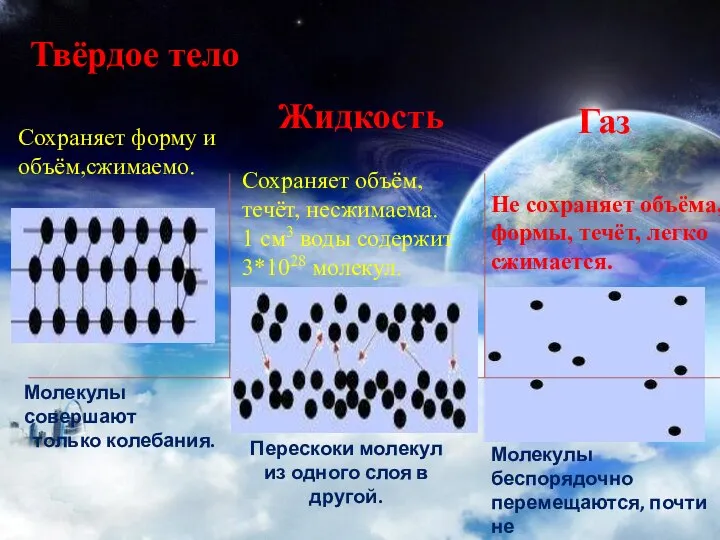
- 7. Твёрдое тело Сохраняет форму и объём,сжимаемо. Жидкость Газ Сохраняет объём, течёт, несжимаема. 1 см3 воды содержит
- 8. Плавление Кристаллизация Испарение Кипение Конденсация
- 9. Плавление – это переход вещества из твердого состояния в жидкое. Характеристика плавления. Температура, при которой вещество
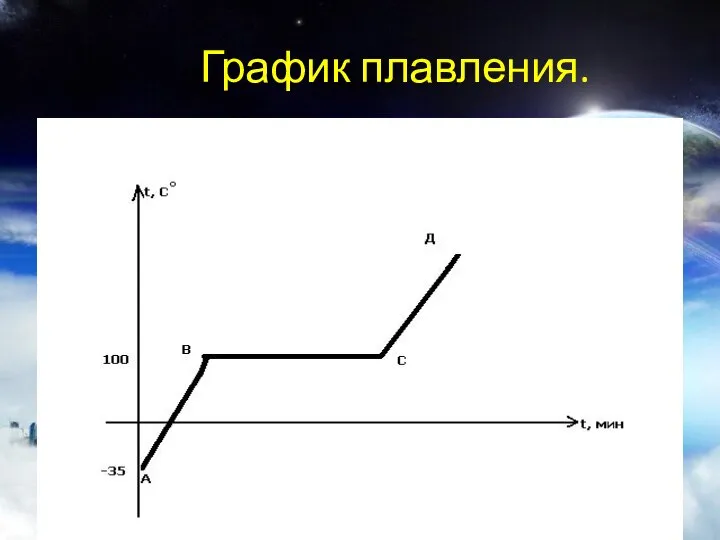
- 10. График плавления.
- 11. Вычисления количества теплоты для плавления вещества. Q=Y m Q – количество теплоты ,Дж Y – удельная
- 12. Обратный процесс плавления – кристаллизация. Это переход вещества из жидкого состояния в твердое. Температура, при которой
- 13. График кристаллизации.
- 14. Парообразование – это явление превращения жидкости в пар. Испарение. Кипение.
- 15. Испарение - -это парообразование, происходящее с поверхности жидкости. Испарение происходит при любой температуре. Скорость испарения зависит:
- 16. Кипение – это интенсивный переход жидкости в пар. Отличия от испарения: Объем жидкости. Температура. Время.
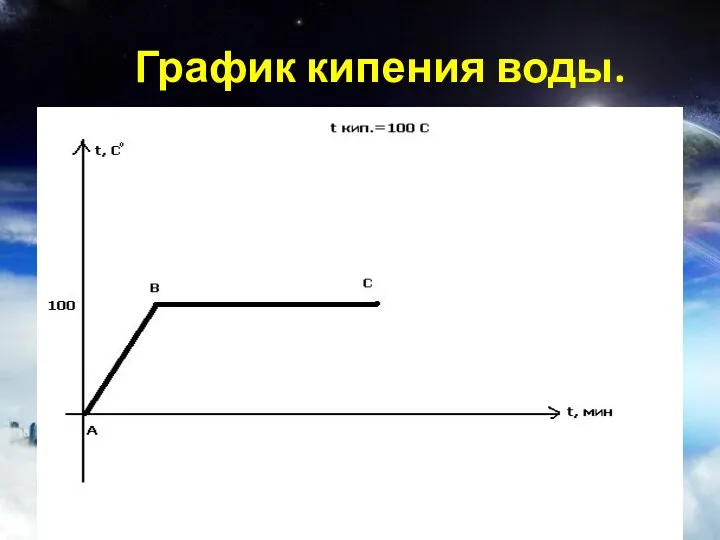
- 17. График кипения воды.
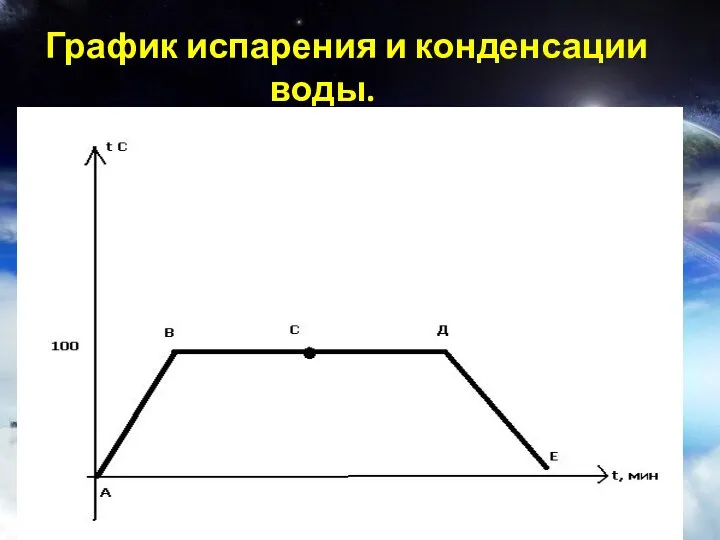
- 18. График испарения и конденсации воды.
- 19. Q = Lm Q- количество теплоты, Дж L- удельная теплота парообразования, Дж\кг m- масса, кг
- 21. Скачать презентацию














 Формообразование на станках
Формообразование на станках Идеальный физический маятник
Идеальный физический маятник Адиабатическое приближение
Адиабатическое приближение Перепад давления
Перепад давления Мощность. Единицы мощности
Мощность. Единицы мощности Свет. Источники света. Звезда-Солнце. Солнечные и лунные затмения
Свет. Источники света. Звезда-Солнце. Солнечные и лунные затмения Электростатика. Закон Кулона. 10 класс
Электростатика. Закон Кулона. 10 класс Перемещение. Проекции перемещения
Перемещение. Проекции перемещения Закон Джоуля-Ленца
Закон Джоуля-Ленца Приготовьтесь к построению! Урок физики
Приготовьтесь к построению! Урок физики Найдем правильную дорогу
Найдем правильную дорогу Физика и техника
Физика и техника Зависимость сопротивления проводников и полупроводников от температуры
Зависимость сопротивления проводников и полупроводников от температуры ВСР №20. Голография и ее применение
ВСР №20. Голография и ее применение Тепловые явления
Тепловые явления Нанотехнологии и наноматериалы
Нанотехнологии и наноматериалы 7_Sily_v_prirode_sila_tyazhesti_ves (1)
7_Sily_v_prirode_sila_tyazhesti_ves (1) Симметрия молекулярных систем
Симметрия молекулярных систем Тепловые явления. Задание 2
Тепловые явления. Задание 2 Konsultatsia_2 (1)
Konsultatsia_2 (1) Кинематика
Кинематика Система движения тележек. Виды тележек
Система движения тележек. Виды тележек Трубчатый ферментёр
Трубчатый ферментёр Внутренняя энергия и способы её изменения
Внутренняя энергия и способы её изменения Презентация на тему Люминесцентный анализ
Презентация на тему Люминесцентный анализ  10.09.2022
10.09.2022 Постоянный ток. Сила тока. Сопротивление. Закон Ома для участка цепи. Виды соединения проводников
Постоянный ток. Сила тока. Сопротивление. Закон Ома для участка цепи. Виды соединения проводников Фотографии для иллюстрации закономерностей оптики
Фотографии для иллюстрации закономерностей оптики