Слайд 2ИЗОТОП
— разновидности атомов какого-либо химического элемента, которые имеют одинаковый атомный (порядковый) номер, но при

этом разные массовые числа. Название связано с тем, что все изотопы одного атома помещаются в одно и то же место (в одну клетку) таблицы Менделеева.
Слайд 3Химические свойства атома зависят от строения электронной оболочки, которая, в свою очередь, определяется

в основном зарядом ядра Z (то есть количеством протонов в нём), и почти не зависят от его массового числа A (то есть суммарного числа протонов Z и нейтронов N).
Слайд 4ИСТОРИЯ ОТКРЫТИЯ
Первое доказательство того, что вещества, имеющие одинаковое химическое поведение, могут иметь

различные физические свойства, было получено при исследовании радиоактивных превращений атомов тяжёлых элементов. В 1906—1907 годах выяснилось, что продукт радиоактивного распада урана — ионий и продукт радиоактивного распада тория — радиоторий имеют те же химические свойства, что и торий, но отличаются от него атомной массой и характеристиками радиоактивного распада.
Слайд 5Было обнаружено позднее, что у всех трёх продуктов одинаковы оптические и рентгеновские спектры. Такие вещества, идентичные

по химическим свойствам, но различные по массе атомов и некоторым физическим свойствам, по предложению английского учёного Содди с 1910 г. стали называть изотопами




 Машиноведение
Машиноведение Методическая разработка по применению первого закона термодинамики к решению графических задач
Методическая разработка по применению первого закона термодинамики к решению графических задач Фотоэффект. Самостоятельная работа
Фотоэффект. Самостоятельная работа Прогнозирование изменения прочностных свойств резины при ее термическом старении
Прогнозирование изменения прочностных свойств резины при ее термическом старении Электромагнитное поле
Электромагнитное поле Проводники и диэлектрики
Проводники и диэлектрики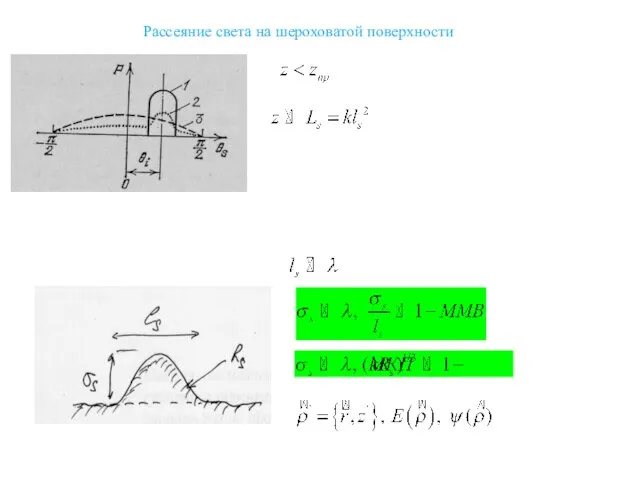 Рассеяние света на шероховатой поверхности
Рассеяние света на шероховатой поверхности Единицы времени. Час. Минута
Единицы времени. Час. Минута Геометрическая оптика. (Лекция 6)
Геометрическая оптика. (Лекция 6) Вес. Невесомость. Перегрузки
Вес. Невесомость. Перегрузки Презентация на тему Великое открытие Архимеда
Презентация на тему Великое открытие Архимеда  Презентация на тему Волны. Звуковые волны. Звук
Презентация на тему Волны. Звуковые волны. Звук  Изобретение радио
Изобретение радио Технические измерения
Технические измерения Источники, концентраторы, приемники излучения
Источники, концентраторы, приемники излучения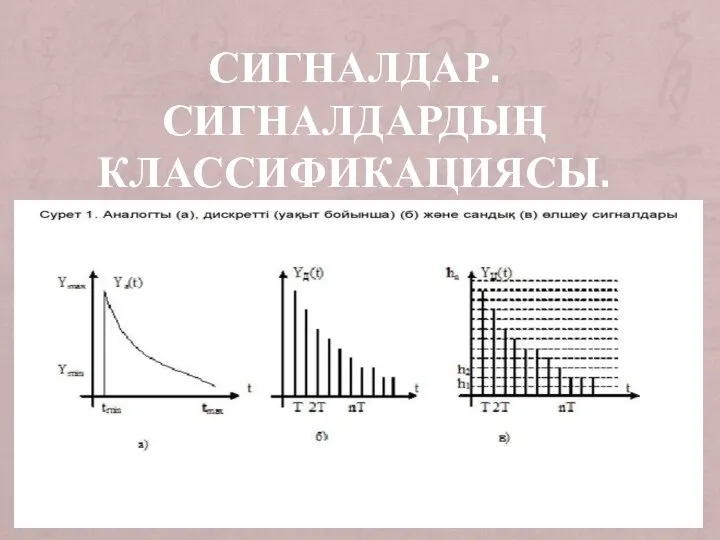 Сигналдар. Сигналдардың классификациясы
Сигналдар. Сигналдардың классификациясы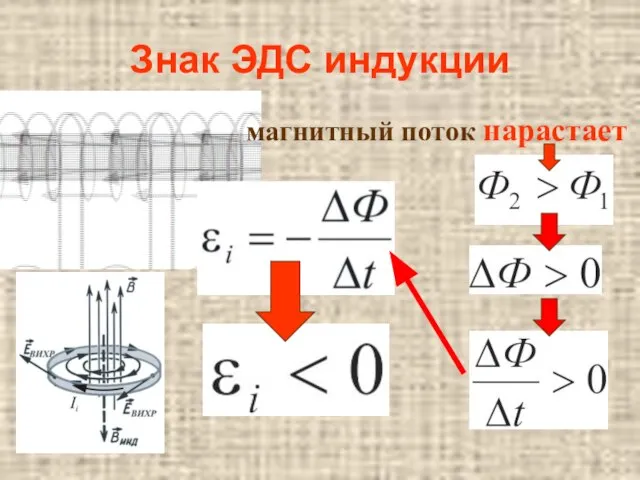 Закон электромагнитной индукции
Закон электромагнитной индукции Определение объёма твердого тела
Определение объёма твердого тела Законы постоянного тока
Законы постоянного тока Основные детали остова двигателя. Станина и цилиндры. Картеры, крепление. Вентиляция. Урок № 7. Тема 2.4
Основные детали остова двигателя. Станина и цилиндры. Картеры, крепление. Вентиляция. Урок № 7. Тема 2.4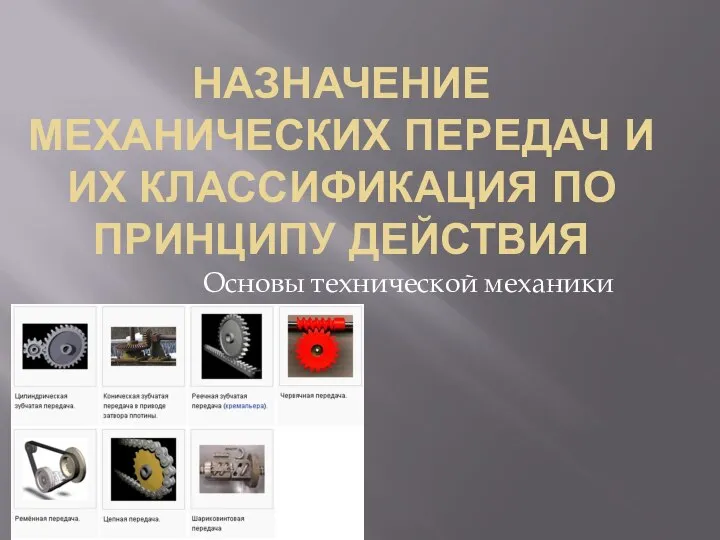 Назначение механических передач и их классификация по принципу действия
Назначение механических передач и их классификация по принципу действия Исследование оптических свойств халькогенидных стеклообразных полупроводников
Исследование оптических свойств халькогенидных стеклообразных полупроводников Сопротивление материалов
Сопротивление материалов IRS-P6 - усовершенствованный спутник дистанционного зондирования
IRS-P6 - усовершенствованный спутник дистанционного зондирования Силы. Сила тяжести
Силы. Сила тяжести Спектры. Устройство спектроскопа
Спектры. Устройство спектроскопа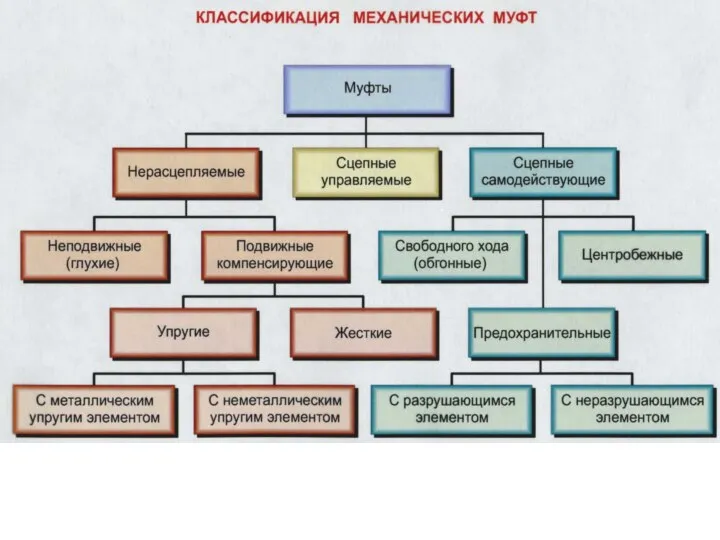 Классификация механических муфт
Классификация механических муфт Частотные методы оценки качества регулирования
Частотные методы оценки качества регулирования