Содержание
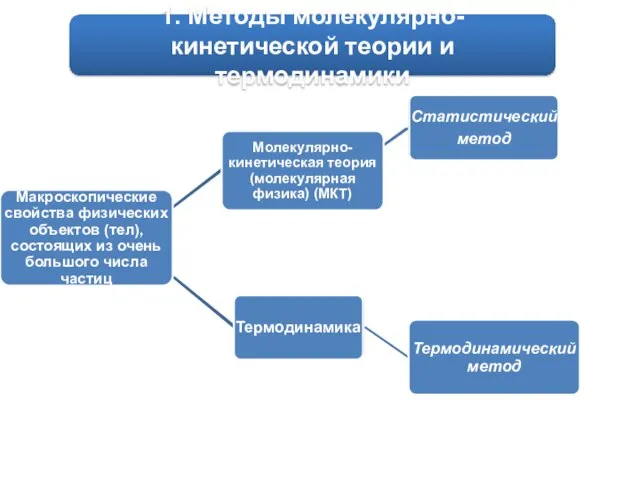
- 2. 1. Методы молекулярно-кинетической теории и термодинамики
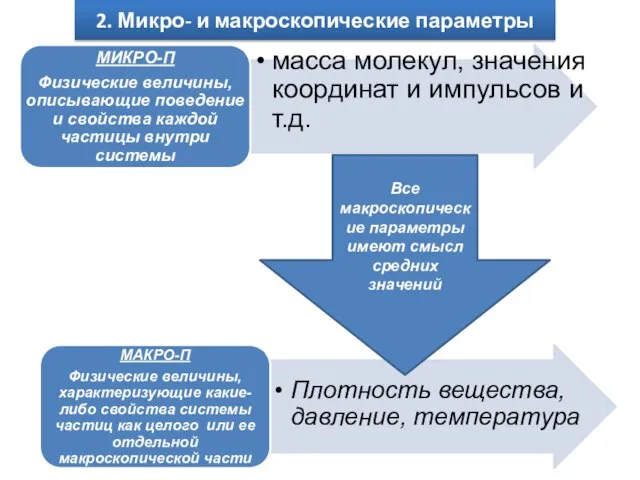
- 3. 2. Микро- и макроскопические параметры Все макроскопические параметры имеют смысл средних значений
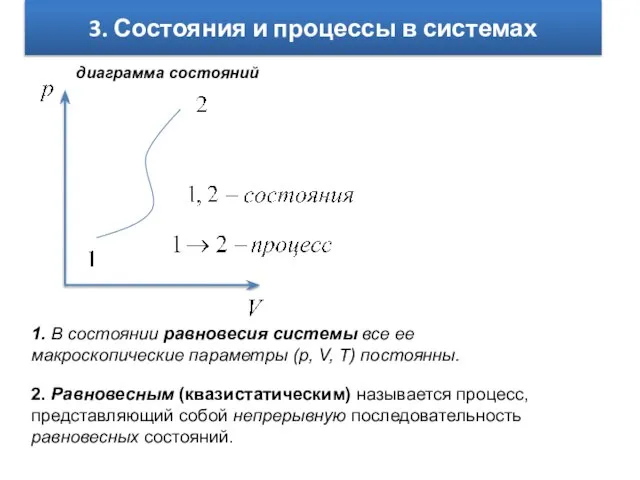
- 4. 3. Состояния и процессы в системах 1. В состоянии равновесия системы все ее макроскопические параметры (p,
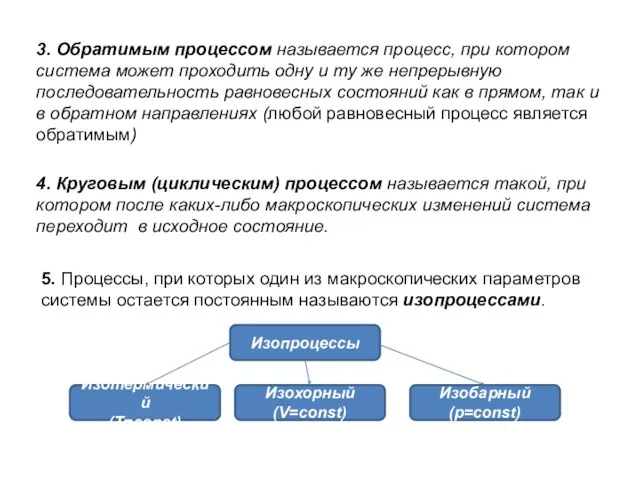
- 5. 3. Обратимым процессом называется процесс, при котором система может проходить одну и ту же непрерывную последовательность
- 6. 4. Идеальный газ. Уравнение состояния Идеальным газом называется система частиц, собственными размерами которых по сравнению со
- 7. 1) все тела состоят из атомов или молекул; 2) между ними существуют силы взаимодействия; 3) атомы
- 8. 6. Уравнение состояния идеального газа основное уравнение молекулярно-кинетической теории для давления идеального газа - уравнение Менделеева-Клапейрона
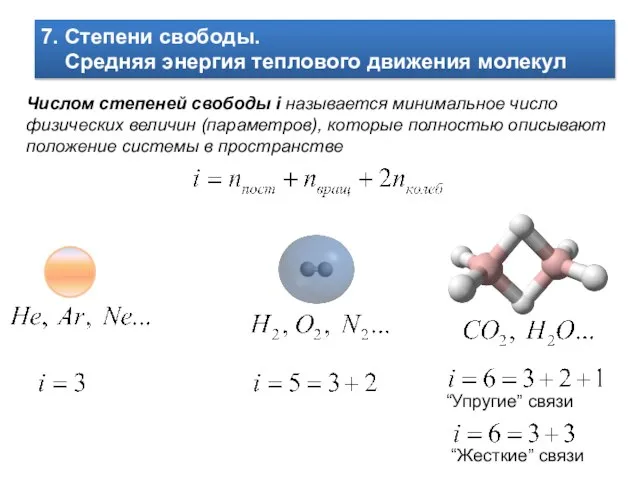
- 9. 7. Степени свободы. Средняя энергия теплового движения молекул Числом степеней свободы i называется минимальное число физических
- 11. Скачать презентацию



 Кинетическая и потенциальная энергия. Открытый урок по физике
Кинетическая и потенциальная энергия. Открытый урок по физике Фазовые переходы
Фазовые переходы Определить импульс фотона с энергией
Определить импульс фотона с энергией Энергия. Работа. Мощность
Энергия. Работа. Мощность Физикалық шама
Физикалық шама Электромагнитные волны
Электромагнитные волны Стартовый ускоритель
Стартовый ускоритель Явления тяготения. Сила тяжести
Явления тяготения. Сила тяжести Электрическая винто-моторная установка для БПЛА С
Электрическая винто-моторная установка для БПЛА С Эрнест Резерфорд
Эрнест Резерфорд Физика в эпоху античности
Физика в эпоху античности Исследование цепей с последовательным и параллельным соединением резисторов
Исследование цепей с последовательным и параллельным соединением резисторов Параметры сопряжения деталей
Параметры сопряжения деталей Системы АРУ. Примеры и реализация
Системы АРУ. Примеры и реализация Биологическое действие радиоактивных излучений
Биологическое действие радиоактивных излучений Механическая работа
Механическая работа Электромагнитные явления
Электромагнитные явления Использование электромагнитной индукции
Использование электромагнитной индукции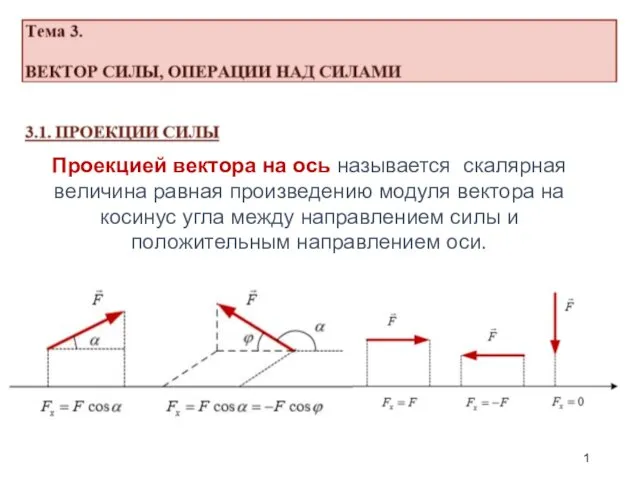 Вектор силы, операции над силами
Вектор силы, операции над силами M_P_Rezistivnye_M (1)
M_P_Rezistivnye_M (1) Радіо. Історія виникнення радіозв'язку
Радіо. Історія виникнення радіозв'язку Математическое введение
Математическое введение Фотоэффект
Фотоэффект Презентация ученицы 11 «А» класса Очеретиной Александры
Презентация ученицы 11 «А» класса Очеретиной Александры Последовательность операций
Последовательность операций Измерение температуры
Измерение температуры Шалаев Хиггс
Шалаев Хиггс Три состояния вещества
Три состояния вещества