Содержание
- 2. Внутренняя энергия U – общий запас энергии, включая движение молекул, колебания связей, движение электронов, ядер и.д.,
- 3. Количество выделенной или поглощенной теплоты Q называется тепловым эффектом реакции. Изучением тепловых эффектов занимается термохимия.
- 4. Процессы могут протекать либо при постоянном объеме V=const, либо при постоянном давлении p=const. Поэтому и тепловые
- 5. ΔН – энтальпия (кДж/моль) – первая термодинамическая величина Тогда Q = - ν·ΔНхим.реакции , где ν=m/M=V/Vm
- 6. Zn(к) + H2SO4 (ж) = ZnSO4 (ж) + Н2 (г) ΔН = - 1 63 ,2
- 7. Стандартные условия - р = 1 атм (101 кПа), температура 25°С (298 К) -отличие от нормальных
- 8. 1)Закон Лавуазье-Лапласа. Тепловой эффект обратной реакции равен тепловому эффекту прямой, с противоположным знаком. 2)Закон Гесса .
- 9. Тепловой эффект реакции равен сумме теплот образования продуктов реакции за вычетом суммы теплот образования начальных (исходных)
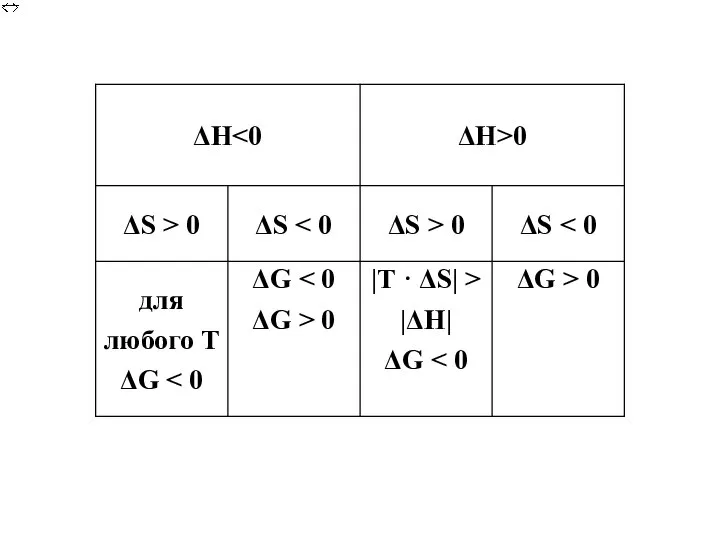
- 10. Возможность самопроизвольного протекания процесса и его направление. Энтропия S: S = R•lnW [Дж / моль •
- 11. Постулат Нернста: при абсолютном нуле температуры энтропия любого совершенного кристалла равна нулю. (Третье начало термодинамики).
- 12. Равновесие: ΔН = Т · ΔS Функцией состояния, одновременно отражающей влияние энтропии и энтальпии на направление
- 14. Так, для реакции типа A + В2—>АВ2 закон действия масс выражается следующим образом: v = k
- 16. Скачать презентацию












 Метрология
Метрология Применение фотоэффекта
Применение фотоэффекта Вес тела. Невесомость
Вес тела. Невесомость Автоколебания. Транзистор. Генератор незатухающих колебаний
Автоколебания. Транзистор. Генератор незатухающих колебаний С днём радио!
С днём радио! Сила тяжести
Сила тяжести Гидростатика
Гидростатика Техническое обслуживание и ремонт двигателей, систем и агрегатов автомобилей
Техническое обслуживание и ремонт двигателей, систем и агрегатов автомобилей Постулаты Бора. Модель атома водорода по Бору
Постулаты Бора. Модель атома водорода по Бору Магнитная цепь
Магнитная цепь Электрическая свеча Ябочкова
Электрическая свеча Ябочкова 5 урок свободное падение тела
5 урок свободное падение тела Роль физики в современном мире
Роль физики в современном мире Атом станциясы энергетикасын дамыту
Атом станциясы энергетикасын дамыту Система управления двигателем
Система управления двигателем Электроосветительные приборы. Лампы накаливания и регулировка освещенности
Электроосветительные приборы. Лампы накаливания и регулировка освещенности Магнитный поток. 11 класс
Магнитный поток. 11 класс Волновая оптика
Волновая оптика Презентация на тему Вращательное движение
Презентация на тему Вращательное движение  Виды теплопередачи
Виды теплопередачи Закон сохранения и превращения механической энергии. 10 класс
Закон сохранения и превращения механической энергии. 10 класс Особенности плавания в условиях ограниченной видимости на участке поселок Шиморское- поселок Елатьма
Особенности плавания в условиях ограниченной видимости на участке поселок Шиморское- поселок Елатьма Основы технологического конструированияя
Основы технологического конструированияя Законы постоянного тока. Лекция 10
Законы постоянного тока. Лекция 10 Закон сохранения электрического заряда. Закон Кулона
Закон сохранения электрического заряда. Закон Кулона Термическое разупрочнение деформированного металла
Термическое разупрочнение деформированного металла Презентация на тему Колебательное движение. Свободные колебания. Маятники (9 класс)
Презентация на тему Колебательное движение. Свободные колебания. Маятники (9 класс)  Типология транспорта для уборки улиц и общественнх учреждений
Типология транспорта для уборки улиц и общественнх учреждений