Содержание
- 2. Цель урока: научить обучающихся применять основные положения МКТ к объяснению различий в строении и свойствах различных
- 3. Содержание: Агрегатные состояния вещества Основные положения МКТ. Агрегатные превращения. Сублимация и десублимация. Таблица 1 «Агрегатные состояния
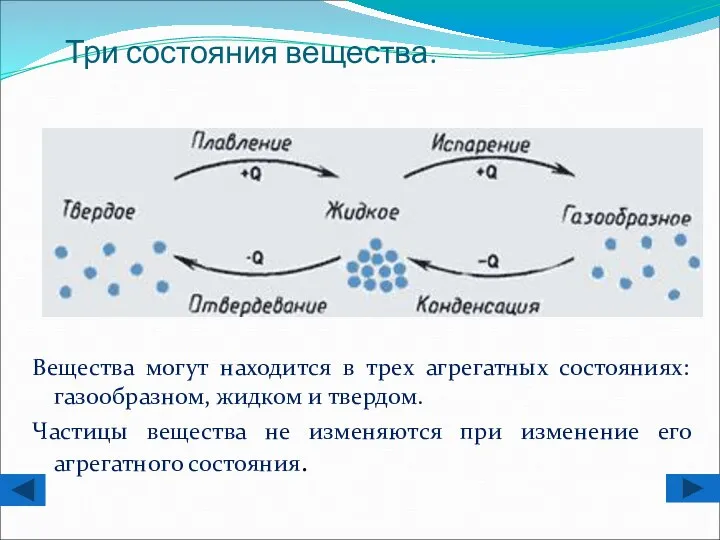
- 4. Три состояния вещества. Вещества могут находится в трех агрегатных состояниях: газообразном, жидком и твердом. Частицы вещества
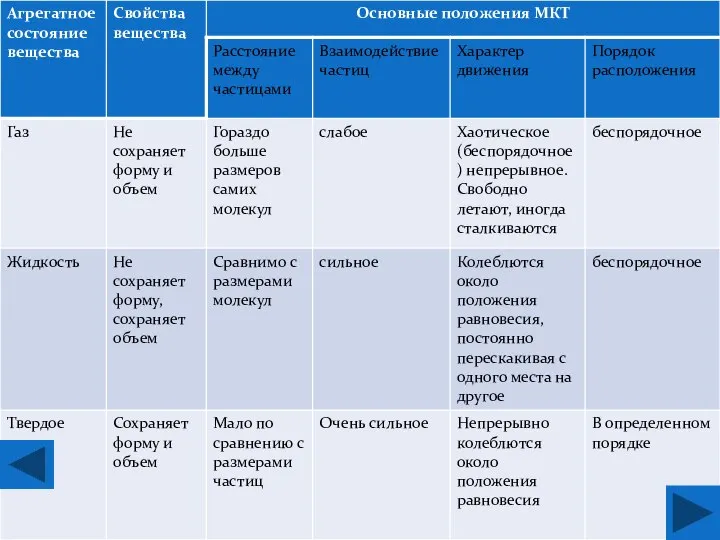
- 5. Основные положения МКТ: Все тела состоят из частиц (молекул, атомов); частицы непрерывно хаотически движутся; скорость движения
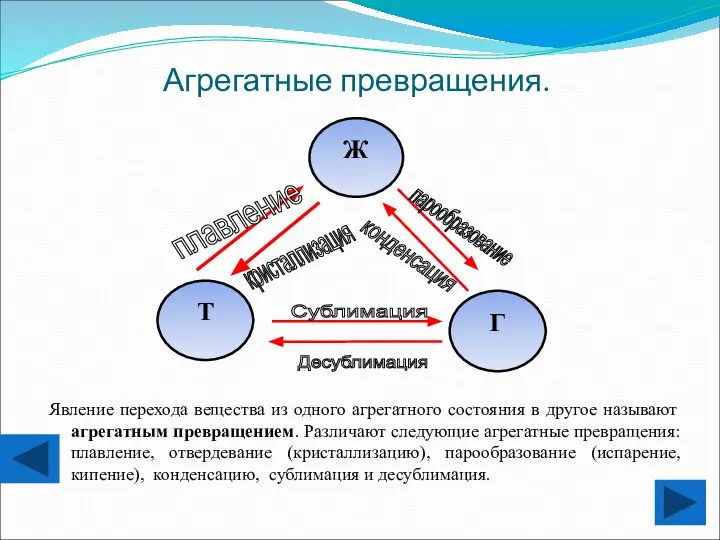
- 6. Агрегатные превращения. Явление перехода вещества из одного агрегатного состояния в другое называют агрегатным превращением. Различают следующие
- 8. Процесс плавления и отвердевания. Переход твердого тела в жидкое состояние называется плавлением. Обратное явление называется отвердеванием.
- 9. Температура плавления и кристаллизации. Температурой плавления данного вещества называют температуру, при которой одновременно сосуществуют твердое и
- 10. Сублимация и десублимация. Например, графит можно нагреть до тысячи градусов, и тем не менее в жидкость
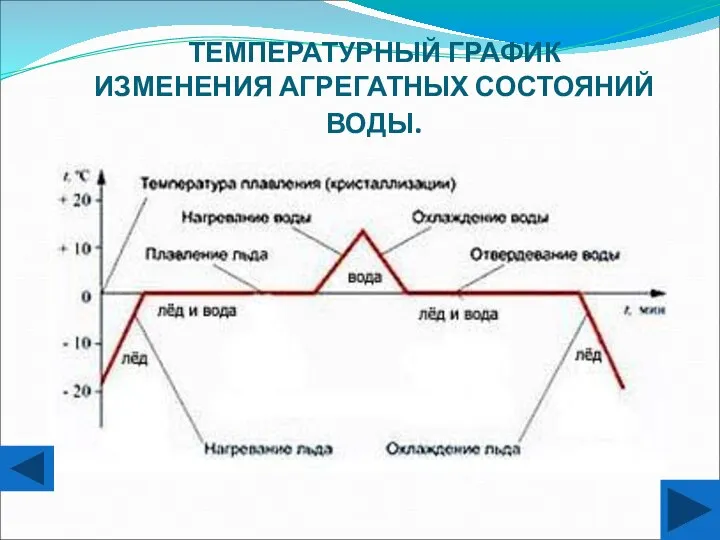
- 11. ТЕМПЕРАТУРНЫЙ ГРАФИК ИЗМЕНЕНИЯ АГРЕГАТНЫХ СОСТОЯНИЙ ВОДЫ.
- 12. Объяснение процесса плавления. Жидкому состоянию вещества по сравнению с твердым кристаллическим присущи : большая скорость движения
- 13. Молекулярный механизм плавления: При нагревании тела возрастает кинетическая энергия колебательного движения молекул. Она начинает превышать их
- 14. При охлаждении расплава до температуры кристаллизации за счет уменьшения потенциальной энергии взаимодействия частиц среде отдается такое
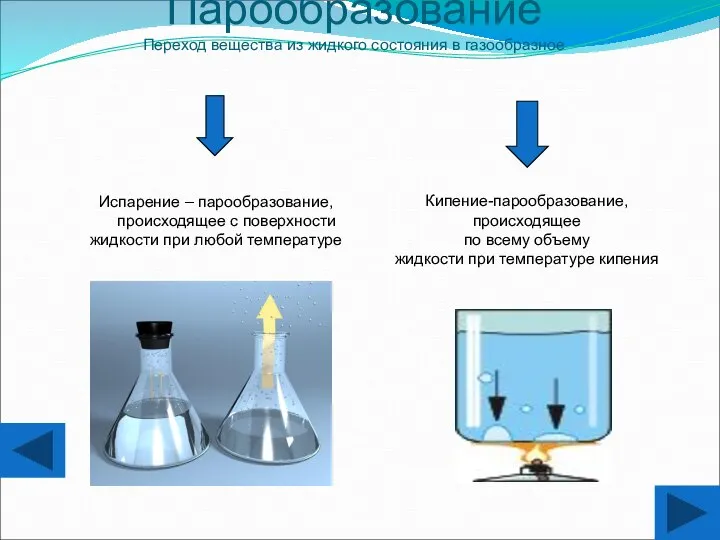
- 15. Парообразование Переход вещества из жидкого состояния в газообразное Испарение – парообразование, происходящее с поверхности жидкости при
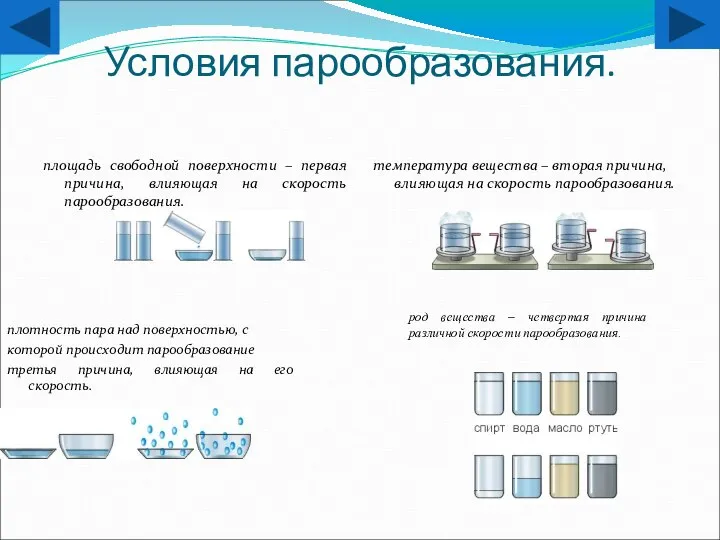
- 16. Условия парообразования. площадь свободной поверхности – первая причина, влияющая на скорость парообразования. температура вещества – вторая
- 17. Кипение. Парообразование, происходящее по всему объему жидкости вследствие возникновения и всплытия на поверхность многочисленных пузырей насыщенного
- 18. Температура кипения. Во время кипения температура жидкости не меняется.. Температура кипения зависит от давления, оказываемого на
- 19. Молекулярный механизм парообразования: Наиболее быстрые молекулы, которые всегда есть в теле, имеют кинетическую энергию, превышающую их
- 21. Скачать презентацию












 Консультация ГИА-9 по физике
Консультация ГИА-9 по физике Внедрение гибридных солнечно-ветровых систем электропитания для развития ИКТ в предгорных населенных пунктах и регионах
Внедрение гибридных солнечно-ветровых систем электропитания для развития ИКТ в предгорных населенных пунктах и регионах Оптика. Законы отражения
Оптика. Законы отражения РАДУГА
РАДУГА Критерии прочности при изгибе. Распространение критериев прочности на случай циклического нагружения
Критерии прочности при изгибе. Распространение критериев прочности на случай циклического нагружения Бесконтактный метод передачи электрической энергии
Бесконтактный метод передачи электрической энергии Расчет по деформациям
Расчет по деформациям Простые механизмы
Простые механизмы Построение и исследование физических моделей в Delphi 7
Построение и исследование физических моделей в Delphi 7 АТОМНЫЕ ЭЛЕКТРОСТАНЦИИ С РЕАКТОРАМИ НА БЫСТРЫХ НЕЙТРОНАХ
АТОМНЫЕ ЭЛЕКТРОСТАНЦИИ С РЕАКТОРАМИ НА БЫСТРЫХ НЕЙТРОНАХ Подвеска. Техническое обслуживание, ремонт и эксплуатация автомобильного транспорта
Подвеска. Техническое обслуживание, ремонт и эксплуатация автомобильного транспорта Рабочие вещества холодильных машин и тепловых насосов
Рабочие вещества холодильных машин и тепловых насосов Импульс тела. Решение задач
Импульс тела. Решение задач Презентация на тему Расчёт массы тела по его плотности
Презентация на тему Расчёт массы тела по его плотности  2. Постоянный электрический ток (1)
2. Постоянный электрический ток (1) Электростатика. Электродинамика
Электростатика. Электродинамика Электрическая винто-моторная установка для БПЛА С
Электрическая винто-моторная установка для БПЛА С Магнитное поле. Вектор магнитной индукции
Магнитное поле. Вектор магнитной индукции Проводники, диэлектрики и полупроводники
Проводники, диэлектрики и полупроводники Наблюдение интерференции и дифракции свет
Наблюдение интерференции и дифракции свет Рубка металла
Рубка металла Нелинейные электрические цепи постоянного тока
Нелинейные электрические цепи постоянного тока 4-3 القوى المتوازنة والقوى غير المتوازنة
4-3 القوى المتوازنة والقوى غير المتوازنة Вещества. Науки о природе
Вещества. Науки о природе Основы радиосвязи
Основы радиосвязи Расчет скорости, пути и времени механического движения
Расчет скорости, пути и времени механического движения Оптические явления
Оптические явления Законы сохранения в механике. Лекция № 5
Законы сохранения в механике. Лекция № 5