Содержание
- 2. Объем производства пигментного диоксида титана в мире в 2019 году составил 7,66 миллионов тонн. Цена пигментного
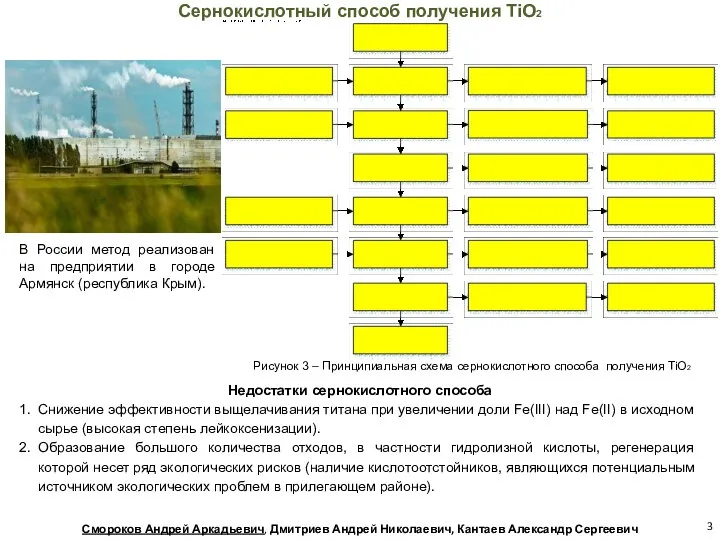
- 3. В России метод реализован на предприятии в городе Армянск (республика Крым). Недостатки сернокислотного способа Снижение эффективности
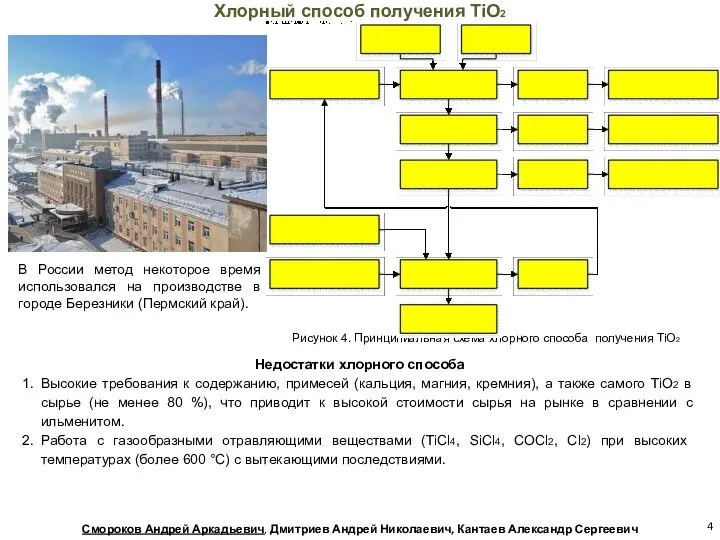
- 4. В России метод некоторое время использовался на производстве в городе Березники (Пермский край). Недостатки хлорного способа
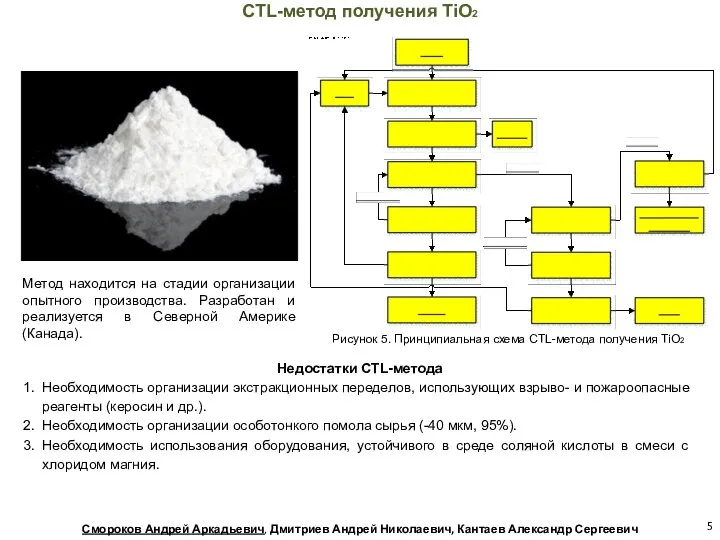
- 5. Метод находится на стадии организации опытного производства. Разработан и реализуется в Северной Америке (Канада). Недостатки CTL-метода
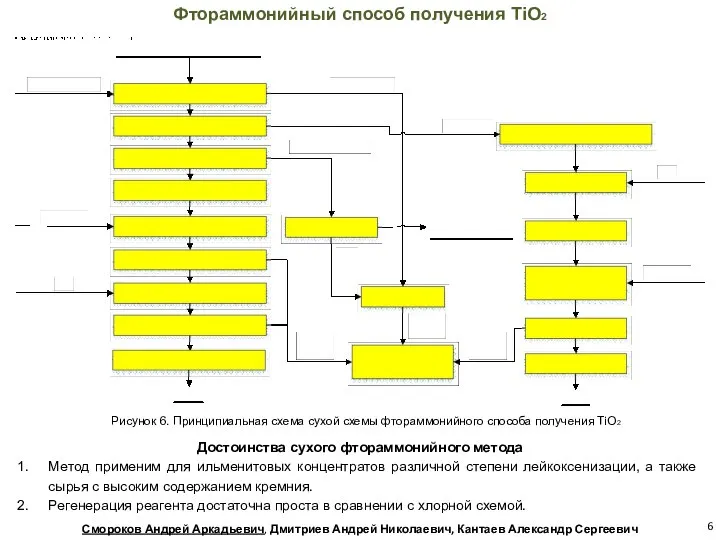
- 6. Фтораммонийный способ получения TiO2 Рисунок 6. Принципиальная схема сухой схемы фтораммонийного способа получения TiO2 Достоинства сухого
- 7. Фтораммонийный способ получения TiO2 Таблица 2 – Химический состав титанового шлака Существенным недостатком сухого фтораммонийного способа
- 8. Фтораммонийный способ получения TiO2 Гидродифторид аммония (NH4HF2) – это кислая аммонийная соль фтороводородной кислоты, представляющая собой
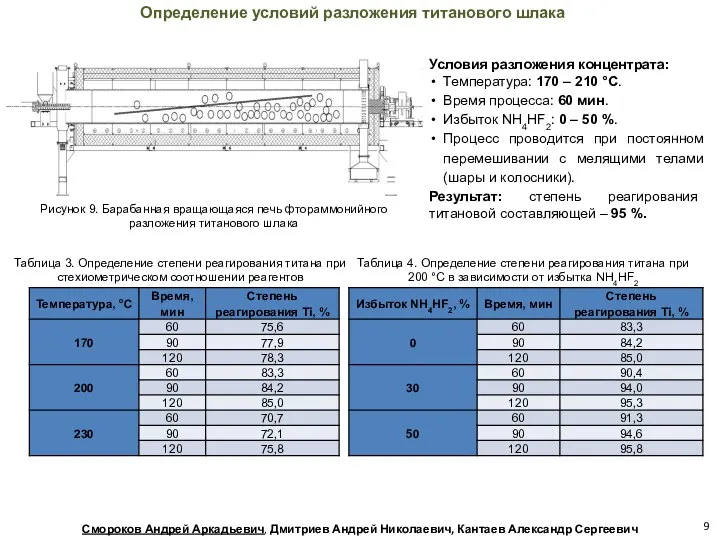
- 9. Рисунок 9. Барабанная вращающаяся печь фтораммонийного разложения титанового шлака Определение условий разложения титанового шлака Таблица 3.
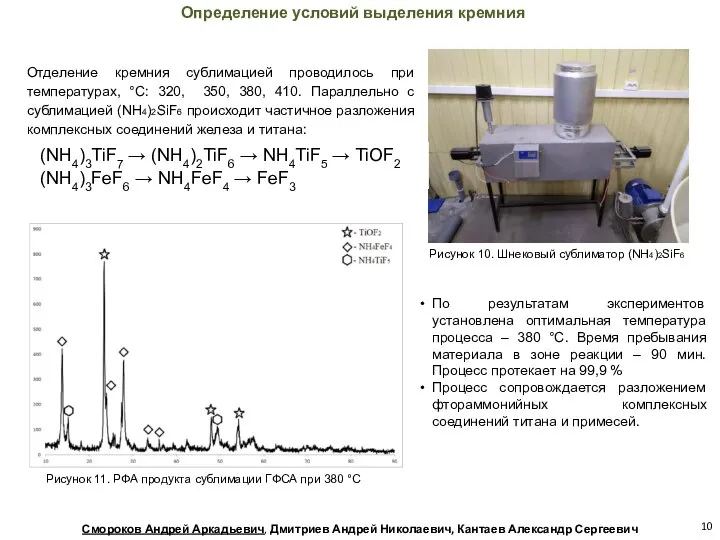
- 10. Рисунок 11. РФА продукта сублимации ГФСА при 380 °С Отделение кремния сублимацией проводилось при температурах, °С:
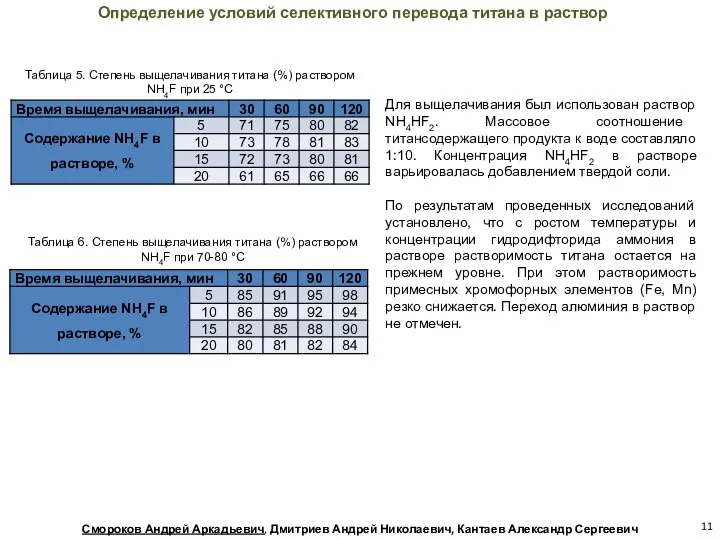
- 11. Таблица 5. Степень выщелачивания титана (%) раствором NH4F при 25 °С Определение условий селективного перевода титана
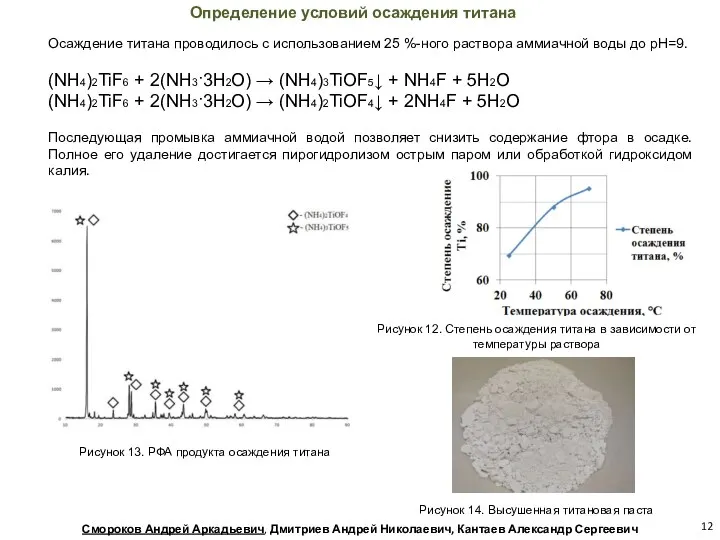
- 12. Рисунок 12. Степень осаждения титана в зависимости от температуры раствора Определение условий осаждения титана Осаждение титана
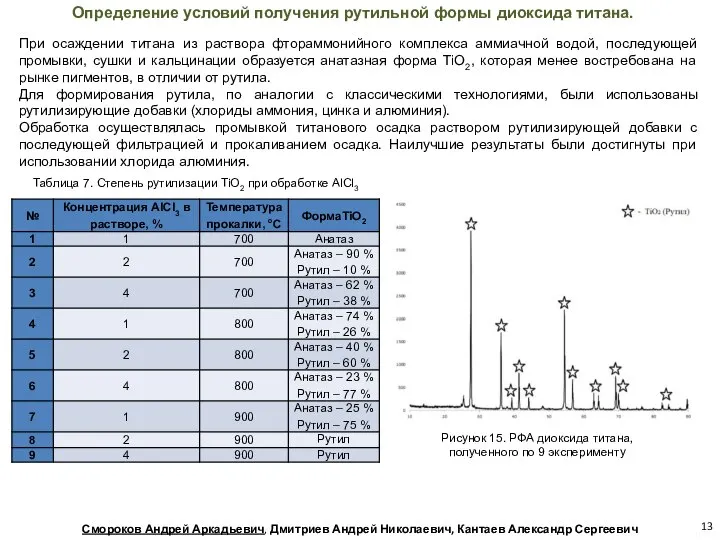
- 13. Таблица 7. Степень рутилизации TiО2 при обработке AlCl3 Определение условий получения рутильной формы диоксида титана. При
- 14. Таблица 8. Состав полученного диоксида титана Характеристика полученного продукта Полученный в результате работ диоксид титана может
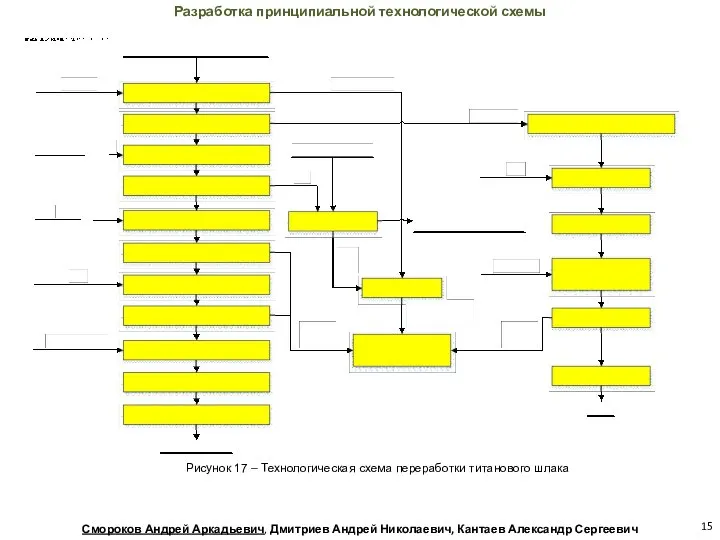
- 15. Разработка принципиальной технологической схемы Рисунок 17 – Технологическая схема переработки титанового шлака Смороков Андрей Аркадьевич, Дмитриев
- 16. Выводы Существующие в промышленности методы получения диоксида титана имеют ряд требований к сырью, что вносит существенные
- 18. Скачать презентацию





 Переходные процессы в электроэнергетических системах. Приведение магнитосвязанных цепей к одному уровню напряжения
Переходные процессы в электроэнергетических системах. Приведение магнитосвязанных цепей к одному уровню напряжения Решение задач. Термодинамика
Решение задач. Термодинамика Молярная масса вещества
Молярная масса вещества Двигатель внутреннего сгорания
Двигатель внутреннего сгорания Сила трения
Сила трения Постоянный_электрический_ток
Постоянный_электрический_ток Трехфазные электрические цепи. Основные положения. Лекция 09
Трехфазные электрические цепи. Основные положения. Лекция 09 Механические волны. Лекция 9
Механические волны. Лекция 9 Определите вид движения
Определите вид движения Явление механического резонанса
Явление механического резонанса Физические основы ЭТП
Физические основы ЭТП Дефекты в кристаллах
Дефекты в кристаллах Физика лазера
Физика лазера Магнитное поле электрического тока
Магнитное поле электрического тока Исследование фазового равновесия
Исследование фазового равновесия Адаптивная подвеска РТС
Адаптивная подвеска РТС Винайдення фотографий
Винайдення фотографий Звездный час. Мероприятие по физике
Звездный час. Мероприятие по физике Электромагнитное поле. История открытия. Компьютер как источник переменного электромагнитного поля
Электромагнитное поле. История открытия. Компьютер как источник переменного электромагнитного поля Освещение помещения. Оптимизация энергозатрат
Освещение помещения. Оптимизация энергозатрат OVZ_Zanyatie_3
OVZ_Zanyatie_3 Сила Архимеда и условие плавания тел
Сила Архимеда и условие плавания тел Наклонная плоскость
Наклонная плоскость Lection28
Lection28 Физическая лихорадка. Методические указания
Физическая лихорадка. Методические указания Знатоки физики О, сколько нам открытий чудных Готовит просвещенья дух И опыт, сын ошибок трудных И гений, парадоксов дру
Знатоки физики О, сколько нам открытий чудных Готовит просвещенья дух И опыт, сын ошибок трудных И гений, парадоксов дру Радиоактивные превращения атомных ядер. Закон радиоактивного распада
Радиоактивные превращения атомных ядер. Закон радиоактивного распада 3_ЭМКолебания
3_ЭМКолебания