Содержание
- 2. Открытие плутония Открытие плутония группой сотрудников Калифорнийского университета в Беркли под руководством Г. Т. Сиборга было
- 3. Происхождение названия Первое Печатное Упоминание Термина Плутоний Датируется 21 Марта 1942 Года. Название 94-му Химическому Элементу
- 4. Тринити и Толстяк Первое ядерное испытание под названием Тринити, проведённое 16 июля 1945 г. возле города
- 5. Бомба Толстяк была сброшена на Нагасаки 9 августа 1945. В результате взрыва моментально погибло 70 тыс.
- 6. Физические свойства Плутоний имеет аномально низкую для металлов температуру плавления (примерно 640 °C) и необычно высокую
- 7. Химические свойства Плутоний проявляет четыре степени окисления в водных растворах и одну очень редкую: PuIII, в
- 8. Применение плутония Промышленный химический элемент принято классифицировать на оружейный и реакторный («энергетический») плутоний. Так, для производства
- 9. Первая атомная бомба, созданная в мире, имела плутониевый заряд. Ядерный плутоний (Pu 239) востребован как ядерное
- 10. Изотопы плутония Из изотопов плутония на данный момент известно о существовании 19-ти его нуклидов с массовыми
- 11. Токсичность плутония Все соединения плутония являются чрезвычайно ядовитыми веществами, сильнейшими радиоактивными ядами . Данные свойства проявляются
- 12. При ингаляции плутоний обладает канцерогенными свойствами и способен вызвать рак лёгкого. Однако следует помнить, что при
- 13. Денатурированный плутоний Если извлеченный из отработавшего топлива плутоний повторно использовать в реакторах на быстрых нейтронах, его
- 14. Воспламеняемость Металлический плутоний является пожароопасным, особенно если материал тонко измельчен. Во влажной среде плутоний образует на
- 16. Скачать презентацию
Слайд 2Открытие плутония
Открытие плутония группой сотрудников Калифорнийского университета в Беркли под руководством Г. Т. Сиборга было совершено с помощью
Открытие плутония
Открытие плутония группой сотрудников Калифорнийского университета в Беркли под руководством Г. Т. Сиборга было совершено с помощью

Слайд 3Происхождение названия
Первое Печатное Упоминание Термина Плутоний Датируется 21 Марта 1942 Года. Название 94-му Химическому Элементу
Происхождение названия
Первое Печатное Упоминание Термина Плутоний Датируется 21 Марта 1942 Года. Название 94-му Химическому Элементу

Первоначально Сиборг Предложил Назвать Новый Элемент «Плутием», Однако Позже Решил, Что Название «Плутоний» Звучит Лучше. Для Обозначения Элемента Он В Шутку Привёл Две Буквы «Pu» — Это Обозначение Представилось Ему Наиболее Приемлемым В Периодической Таблице.Также Сиборгом Были Предложены Некоторые Другие Варианты Названий, Например, Ультимий (Англ. Ultimium От Лат. Ultimus — Последний), Экстремий (Extremium От Лат. Extremus — Крайний), Из-за Ошибочного В То Время Суждения, Что Плутоний Станет Последним Химическим Элементом В Периодической Таблице. Однако Элемент Назвали «Плутоний» В Честь Последней Планеты Солнечной Системы.
Слайд 4Тринити и Толстяк
Первое ядерное испытание под названием Тринити, проведённое 16 июля 1945 г.
Тринити и Толстяк
Первое ядерное испытание под названием Тринити, проведённое 16 июля 1945 г.

Слайд 5 Бомба Толстяк была сброшена на Нагасаки 9 августа 1945. В результате взрыва моментально погибло 70 тыс.
Бомба Толстяк была сброшена на Нагасаки 9 августа 1945. В результате взрыва моментально погибло 70 тыс.

Слайд 6Физические свойства
Плутоний имеет аномально низкую для металлов температуру плавления (примерно 640 °C) и необычно высокую температуру кипения (3235 °C). Свинец является
Физические свойства
Плутоний имеет аномально низкую для металлов температуру плавления (примерно 640 °C) и необычно высокую температуру кипения (3235 °C). Свинец является

Как и у остальных металлов, коррозия плутония увеличивается с увеличением влажности. Некоторые исследования утверждают, что влажный аргон может быть более корродирующим элементом, чем кислород; это связано с тем, что аргон не реагирует с плутонием, и, как следствие, плутоний начинает растрескиваться[110][~ 10].
Альфа-распад, который сопровождается испусканием ядер гелия, является наиболее распространённым видом радиоактивного распада изотопов плутония. Типичный ядерный боеприпас имеет около 5 кг плутония, в котором находится примерно 12,5⋅1024 атомов. С учётом периода полураспада 24000 лет каждую секунду в таком заряде распадается около 11,5⋅1012 атомов, выделяя 5,157 МэВ благодаря альфа-частицам. В пересчёте на количество энергии это составляет 9,58 Вт. Тепло, производимое благодаря распаду ядер и испусканию ими альфа-частиц, делает плутоний тёплым на ощупь[56][112]. Плутоний обладает самым высоким удельным электрическим сопротивлением среди всех изученных актиноидов (на данный момент), которое составляет 150 мкОм·см (при +22 °C). Его твёрдость составляет 261 кг/мм³ (для α-Pu).
Благодаря тому, что плутоний радиоактивен, он со временем претерпевает изменения в своей кристаллической решётке. Плутоний претерпевает некое подобие отжига также благодаря самооблучению из-за повышения температуры выше 100 K.
Слайд 7Химические свойства
Плутоний проявляет четыре степени окисления в водных растворах и одну очень редкую:
PuIII, в
Химические свойства
Плутоний проявляет четыре степени окисления в водных растворах и одну очень редкую:
PuIII, в

PuIV, в качестве Pu4+ (шоколадный),
PuV, в качестве PuO2+ (светлый),
PuVI, в качестве PuO22+ (светло-оранжевый),
PuVII, в качестве PuO53− (зелёный) — также присутствуют семивалентные ионы.
Металлический плутоний получается благодаря реакции его тетрафторида с барием, кальцием или литием при температуре 1200 °C:
PuF4 + 2Ca > Pu + 2CaF2 (1200 °C)
Он реагирует с кислотами, кислородом и их парами, но только не с щелочами (в растворах которых заметно не растворяется, как и большинство актиноидов). Быстро растворяется в хлороводороде, иодоводороде, бромоводороде, 72 % хлорной кислоте, 85 % ортофосфорной кислоте, концентрированной CCl3COOH, сульфаминовой кислоте и кипящей концентрированной азотной кислоте. Плутоний инертен к концентрированным серной и уксусной кислотам; в их растворах медленно растворяется, то есть реагирует и образует соответствующие соли. При температуре 135 °C металл самовоспламенится благодаря реакции с кислородом, а если его поместить в атмосферу тетрахлорметана, то взорвётся.
Слайд 8Применение плутония
Промышленный химический элемент принято классифицировать на оружейный и реакторный («энергетический») плутоний.
Применение плутония
Промышленный химический элемент принято классифицировать на оружейный и реакторный («энергетический») плутоний.

Так, для производства ядерного вооружения из всех существующих изотопов допустимо применять только плутоний 239, в котором не должно быть более 4.5% плутония 240, так как он подвержен самопроизвольному делению, что значительно затрудняет изготовление боевых снарядов.
Плутоний-238 находит применение для функционирования малогабаритных радиоизотопных источников электрической энергии, к примеру, в качестве источника энергии для космической техники.
Несколько десятилетий тому назад плутоний применяли в медицине в кардиостимуляторах (приборы для поддержания сердечного ритма).
Первая атомная бомба, созданная в мире, имела плутониевый заряд. Ядерный плутоний (Pu 239) востребован как ядерное топливо для обеспечения функционирования энергетических реакторов. Также этот изотоп служит источником для получения в реакторах трансплутониевых элементов.
Слайд 9 Первая атомная бомба, созданная в мире, имела плутониевый заряд. Ядерный плутоний (Pu
Первая атомная бомба, созданная в мире, имела плутониевый заряд. Ядерный плутоний (Pu

Если провести сравнение ядерного плутония с чистым металлом, изотоп обладает более высокими металлическими параметрами, не имеет фаз перехода, поэтому его широко используют в процессе получения элементов топлива.
Оксиды изотопа Плутония 242 также востребованы как источник питания для космических летальных агрегатов, техники, в ТВЭЛах.
Оружейный плутоний – это элемент, который представлен в виде компактного металла, в котором содержится не меньше 93% изотопа Pu239.
Данный вид радиоактивного металла применяют про производстве различных видов ядерного вооружения. (На заднем фоне изображена атомная бомба «малыш»)
Получают оружейный плутоний в специализированных промышленных атомных реакторах, которые функционируют на природном или на низкообогащенном уране, в результате захвата им нейтронов.
Слайд 10Изотопы плутония
Из изотопов плутония на данный момент известно о существовании 19-ти его
Изотопы плутония
Из изотопов плутония на данный момент известно о существовании 19-ти его

Министерство энергетики США делит смеси плутония на три вида:
оружейный плутоний (содержание 240Pu в 239Pu менее 7 %)
топливный плутоний (от 7 до 18 % 240Pu) и
реакторный плутоний (содержание 240Pu более 18 %)
Всего два изотопа этого элемента (239Pu и 241Pu) являются более способными к ядерному делению, нежели остальные; более того, это единственные изотопы, которые подвергаются ядерному делению при действии тепловых нейтронов. Среди продуктов взрыва термоядерных бомб обнаружены также 247Рu и 255Рu, периоды полураспада которых несоизмеримо малы.
Слайд 11Токсичность плутония
Все соединения плутония являются чрезвычайно ядовитыми веществами, сильнейшими радиоактивными ядами . Данные свойства проявляются как следствие
Токсичность плутония
Все соединения плутония являются чрезвычайно ядовитыми веществами, сильнейшими радиоактивными ядами . Данные свойства проявляются как следствие

Плутоний самый радиотоксичный элемент из всех актиноидов, однако считается отнюдь не самым опасным элементом
Слайд 12 При ингаляции плутоний обладает канцерогенными свойствами и способен вызвать рак лёгкого. Однако следует
При ингаляции плутоний обладает канцерогенными свойствами и способен вызвать рак лёгкого. Однако следует

Самой вероятной формой попадания плутония в организм является его практически не растворимый в воде диоксид. Он применяется на АЭС в качестве источника электроэнергии. Следовательно, плутоний, из-за нерастворимости его оксида, имеет большие показатели полувыведения из организма.
Слайд 13Денатурированный плутоний
Если извлеченный из отработавшего топлива плутоний повторно использовать в реакторах на
Денатурированный плутоний
Если извлеченный из отработавшего топлива плутоний повторно использовать в реакторах на

Слайд 14Воспламеняемость
Металлический плутоний является пожароопасным, особенно если материал тонко измельчен. Во влажной среде
Воспламеняемость
Металлический плутоний является пожароопасным, особенно если материал тонко измельчен. Во влажной среде

 Давление газов. Закон Паскаля
Давление газов. Закон Паскаля Электрический ток
Электрический ток ПЗ подготовка к КР
ПЗ подготовка к КР Магнитное поле в вакууме. Лекция 5
Магнитное поле в вакууме. Лекция 5 Буровые машины и оборудование. Лекция 5
Буровые машины и оборудование. Лекция 5 Атом - сложная частица
Атом - сложная частица Лекция 1. Цели и задачи дисциплины
Лекция 1. Цели и задачи дисциплины Допуски и посадки
Допуски и посадки Преломление света. Закон преломления
Преломление света. Закон преломления Диагностирование генератора
Диагностирование генератора 9 класс
9 класс Необыкновенные оптические явления
Необыкновенные оптические явления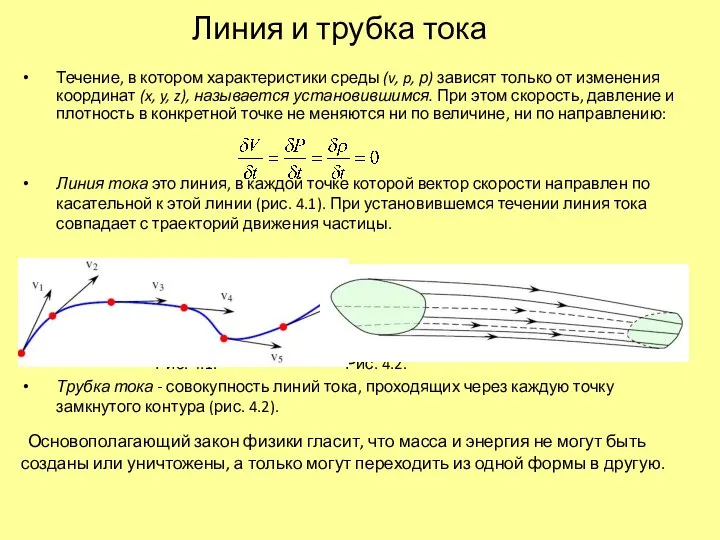 Линия и трубка тока
Линия и трубка тока IRS-P6 - усовершенствованный спутник дистанционного зондирования
IRS-P6 - усовершенствованный спутник дистанционного зондирования Качественные задачи
Качественные задачи Малоугловое рассеяние рентгеновских лучей или тепловых нейтронов. Рентгеновская микроскопия
Малоугловое рассеяние рентгеновских лучей или тепловых нейтронов. Рентгеновская микроскопия Презентация на тему Философские аспекты физики в работах М.А.Маркова
Презентация на тему Философские аспекты физики в работах М.А.Маркова  Светодиодный светильник
Светодиодный светильник Взаимодействие проводников с током
Взаимодействие проводников с током Второй закон термодинамики
Второй закон термодинамики Определение показателей маневренности при проведении испытаний. Лабораторная работа
Определение показателей маневренности при проведении испытаний. Лабораторная работа Свойства материалов
Свойства материалов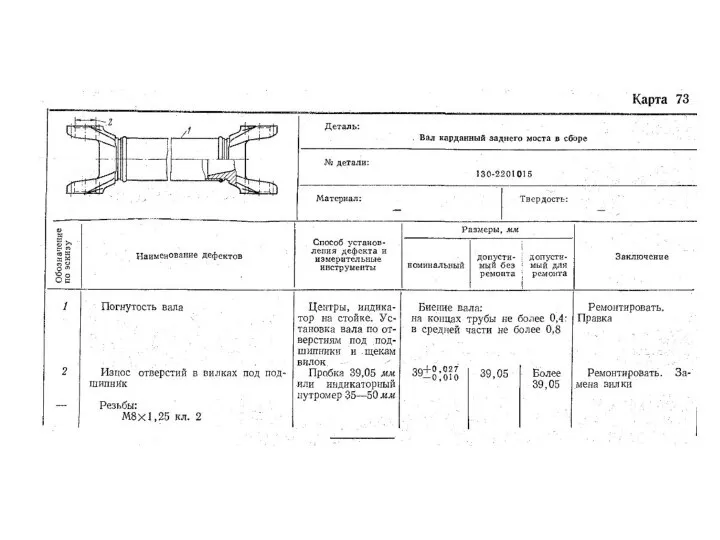 Ремонт автомобилей. Детали
Ремонт автомобилей. Детали Оптика. Структура раздела Оптика
Оптика. Структура раздела Оптика Задачи небесной механики
Задачи небесной механики Молекулярная физика
Молекулярная физика Ядерно-магнитный резонанс
Ядерно-магнитный резонанс Приближенное подобие и моделирование
Приближенное подобие и моделирование