Содержание
- 2. 1. Коэффициенты переноса и их зависимость от давления Сопоставим N = −D gradU или Уравнение Фика
- 3. Эта теория позволила установить, что внешнее сходство уравнений обусловлено общностью лежащих в их основе молекулярного механизма
- 4. Но это конечно не так. Все выше указанные коэффициенты связаны между собой и все выводы молекулярно
- 5. Рассмотрим зависимость коэффициента переноса от давления p. Так как скорость теплового движения молекул и не зависит
- 6. С увеличением p и ρ, повышается число молекул переносящих импульс из слоя в слой, но даёт
- 7. Молекулярное течение. Эффузия газов Молекулярное течение – течение газов в условиях вакуума. То есть, когда молекулы
- 8. Как при молекулярном течении, так и при эффузии количество протекающего в единицу времени газа обратно пропорционально
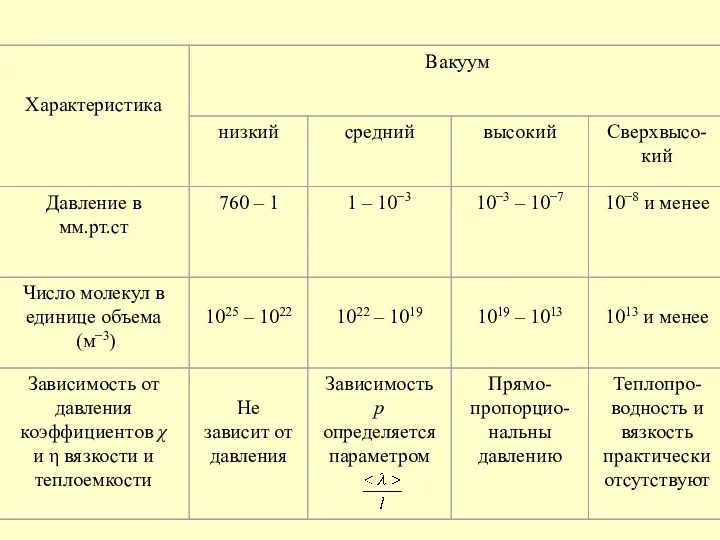
- 9. 2. Понятие о вакууме Газ называется разреженным (разреженный газ), если его плотность столь мала, что средняя
- 11. В состоянии высокого вакуума уменьшение плотности разреженного газа приводит к соответствующей убыли частиц без изменения 〈λ〉
- 12. Удельный тепловой поток в сильно разреженных газах пропорционален разности температур и плотности газа. Стационарное состояние разреженного
- 13. Если Т1 и Т2 – температуры газа в сосудах, то предыдущее условие стационарности можно переписать в
- 14. Вопросы создания вакуума имеют большое значение в технике, так как например, во многих современных электронных приборах
- 15. Лекция 22. ПЕРВОЕ НАЧАЛО ТЕРМОДИНАМИКИ. ВНУТРЕННЯЯ ЭНЕРГИЯ. РАБОТА И ТЕПЛОТА 1. Внутренняя энергия. Работа и теплота.
- 16. 1. Внутренняя энергия. Работа и теплота Наряду с механической энергией любое тело (или система) обладает внутренней
- 17. В термодинамических процессах изменяется только кинетическая энергия движущихся молекул (тепловой энергии недостаточно, чтобы изменить строение атома,
- 18. Изменение внутренней энергии U равно разности внутренней энергии в этих состояниях, независимо от пути, по которому
- 19. Например. Зимой вы бросили в снег горячий камень,
- 20. за счёт запаса потенциальной энергии (механическая) совершена работа по смятию снега, а за счёт запаса внутренней
- 21. Если же камень был холодный, т.е. температура камня равна температуре среды, то будет совершена только работа,
- 22. Опыт показывает, что во всех случаях превращение механической энергии в тепловую и обратно совершается всегда в
- 23. Учитывая правило знаков можно записать: U=Q–А (22.3) изменение внутренней энергии тела равно разности сообщаемой телу теплоты
- 25. Скачать презентацию





















 Лекция 3
Лекция 3 Презентация на тему Закон всемирного тяготения. Движение планет
Презентация на тему Закон всемирного тяготения. Движение планет  Соединения заформовкой
Соединения заформовкой Международная система единиц. Скалярные и векторные физические величины. 7 класс
Международная система единиц. Скалярные и векторные физические величины. 7 класс з-н сохр.имп
з-н сохр.имп Способы измерения размеров малых тел
Способы измерения размеров малых тел Характеристики электрического поля
Характеристики электрического поля 50_ottenkov_sinego
50_ottenkov_sinego Свинцово-кислотные аккумуляторы
Свинцово-кислотные аккумуляторы Трехфазные электрические цепи переменного тока
Трехфазные электрические цепи переменного тока Силы в природе Выполнил ученик 7 «А» класса Лабутин Никита, руководитель учитель физики Братушка А.Д.
Силы в природе Выполнил ученик 7 «А» класса Лабутин Никита, руководитель учитель физики Братушка А.Д. Тренажер формул по физике. Электромагнетизм
Тренажер формул по физике. Электромагнетизм Выпускная бакалаврская работа Повышение безопасности труда при ремонте сельскохозяйственной техники
Выпускная бакалаврская работа Повышение безопасности труда при ремонте сельскохозяйственной техники Kental. Profesional presentation template
Kental. Profesional presentation template Измеряем площадь взвешиванием
Измеряем площадь взвешиванием Электризация тел. Взаимодействие заряженных тел. Два рода зарядов
Электризация тел. Взаимодействие заряженных тел. Два рода зарядов Колебательный контур. Получение электромагнитных колебаний
Колебательный контур. Получение электромагнитных колебаний Равномерное движение по окружности
Равномерное движение по окружности Приходченко ФЕР-2032и
Приходченко ФЕР-2032и Измерение микрометрическим инструментом
Измерение микрометрическим инструментом Освещение. Свет и тень
Освещение. Свет и тень Интеллектуальные технологии смешанной реальности для аэрокосмических систем
Интеллектуальные технологии смешанной реальности для аэрокосмических систем Двигатель внутреннего сгорания (ДВС)
Двигатель внутреннего сгорания (ДВС) Строение атомов химических элементов
Строение атомов химических элементов Классификации тормозов
Классификации тормозов Закон всемирного тяготения, Сила тяжести, невесомость, вес тела
Закон всемирного тяготения, Сила тяжести, невесомость, вес тела Презентация на тему Первоначальные сведения о строении вещества
Презентация на тему Первоначальные сведения о строении вещества  Плотность вещества
Плотность вещества