Содержание
- 2. 1. Понятие об энтропии, расчет изменения энтропии в различных равновесных процессах 2. Объединенное уравнение первого и
- 6. 3.Энтропия изобарного процесса При р=const Если в данном температурном интервале Ср=const, то 4. Энтропия изохорного процесса.
- 7. 5. Если в системе, состоящей из идеального газа изменяется одновременно несколько параметров, то
- 8. 6.Энтропия смешения идеальных газов. Пусть смешивание идет при p= const и Т= const, V1–объем одного газа,
- 9. 7. Изменение энтропии в результате проведения химических реакций можно рассчитать, зная абсолютные значения энтропии всех участвующих
- 10. Известно что, математическое выражение первого закона термодинамики для макро- и микропроцессов имеет следующий вид: С учетом
- 11. Для изохорно-изотермического процесса: а) Обозначим Тогда
- 12. Для изобарно-изотермического процесса: б) Обозначим Тогда
- 14. Скачать презентацию











 Швейная машина. История и устройсво
Швейная машина. История и устройсво Инструменты, механизмы и технические устройства
Инструменты, механизмы и технические устройства Аномальність фізичних властивостей води
Аномальність фізичних властивостей води Законы постоянного тока
Законы постоянного тока Презентация на тему Строение вещества
Презентация на тему Строение вещества  Формульный диктант Кинематика, законы Ньютона, сохранения, статика
Формульный диктант Кинематика, законы Ньютона, сохранения, статика Механика. Повторение. Занятие 7
Механика. Повторение. Занятие 7 Машиноведение
Машиноведение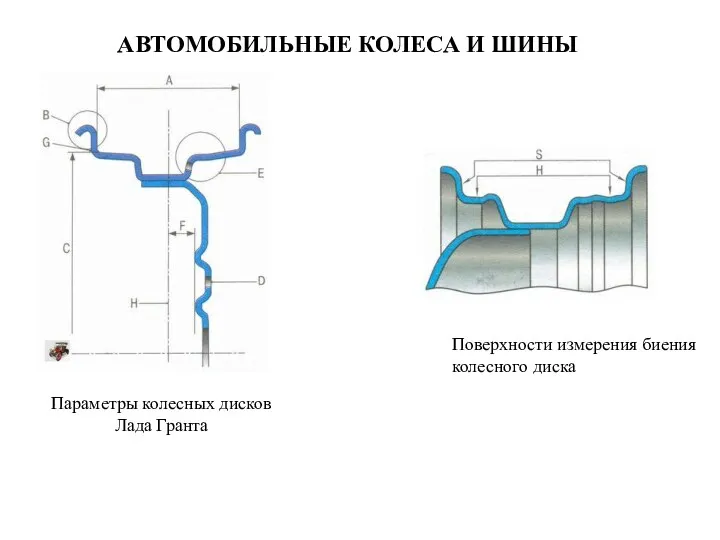 Автомобильные колеса и шины. Поверхности измерения биения колесного диска. Параметры колесных дисков Лада Гранта
Автомобильные колеса и шины. Поверхности измерения биения колесного диска. Параметры колесных дисков Лада Гранта Инновационная концепция электронного корабля
Инновационная концепция электронного корабля Решение задач по теме Тепловые явления. Агрегатные состояния вещества
Решение задач по теме Тепловые явления. Агрегатные состояния вещества Электрическое поле. Лекция № 1
Электрическое поле. Лекция № 1 Волокна большого диаметра. Анализ фазового состава, макро- и микроструктуры полуфабрикатов и готовых изделий из B-Al
Волокна большого диаметра. Анализ фазового состава, макро- и микроструктуры полуфабрикатов и готовых изделий из B-Al Теория деформаций. Практическое занятие
Теория деформаций. Практическое занятие Сцепление. Тесты к теоретическим занятиям
Сцепление. Тесты к теоретическим занятиям Сила трения. Опыт №1. Наблюдение явления трения
Сила трения. Опыт №1. Наблюдение явления трения Презентация на тему КПД тепловых двигателей (8 класс)
Презентация на тему КПД тепловых двигателей (8 класс)  Акустичне явище грім
Акустичне явище грім Механика и элементы специальной теории относительности
Механика и элементы специальной теории относительности Бионика. Аэродинамические прототипы
Бионика. Аэродинамические прототипы давл жидк
давл жидк Электризация. Взаимодействие заряженных тел
Электризация. Взаимодействие заряженных тел Цепь переменного тока с индуктивностью
Цепь переменного тока с индуктивностью Машины и механизмы
Машины и механизмы Общие принципы инженерных расчетов
Общие принципы инженерных расчетов Škoda Octavia. Кузов. Оборудование кузова
Škoda Octavia. Кузов. Оборудование кузова Драйвер двигателя постоянного тока. Вспомогательные функции
Драйвер двигателя постоянного тока. Вспомогательные функции Викторина по физике
Викторина по физике