Содержание
- 2. Большую роль в развитии атомистической теории сыграл Д. И. Менделеев, разработавший в 1869 г. Периодическую систему
- 3. Первая попытка создания на основе накопленных экспериментальных данных модели атома принадлежит Дж. Дж. Томсону (1903). Согласно
- 4. В развитии представлений о строении атома велико значение опытов английского физика Э. Резерфорда (1871—1937) по рассеянию
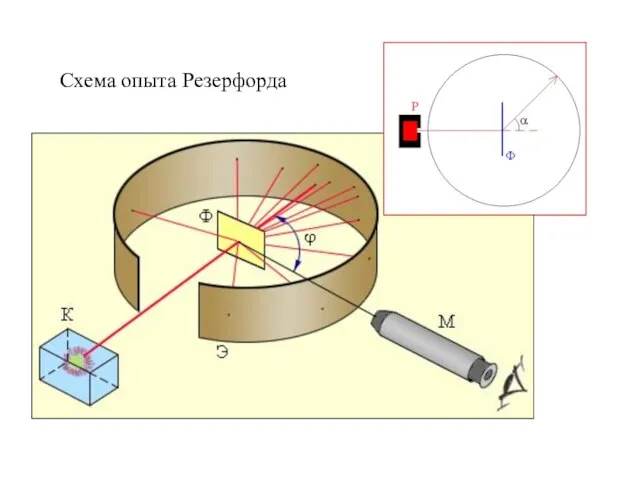
- 5. Схема опыта Резерфорда
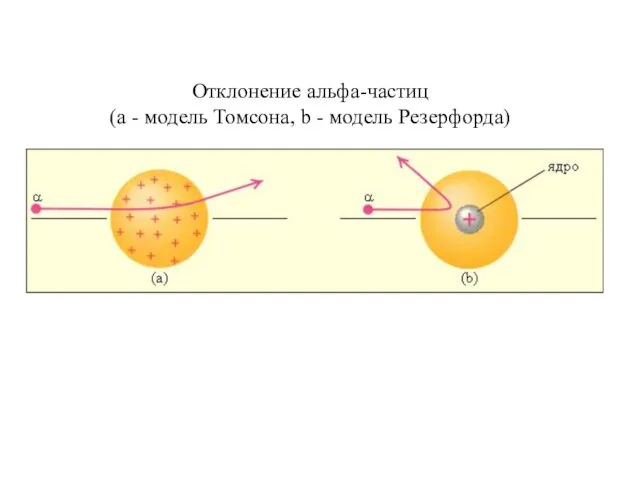
- 6. Резерфорд, исследуя прохождение α-частиц в веществе (через золотую фольгу толщиной примерно 1 мкм), показал, что основная
- 7. Отклонение альфа-частиц (а - модель Томсона, b - модель Резерфорда)
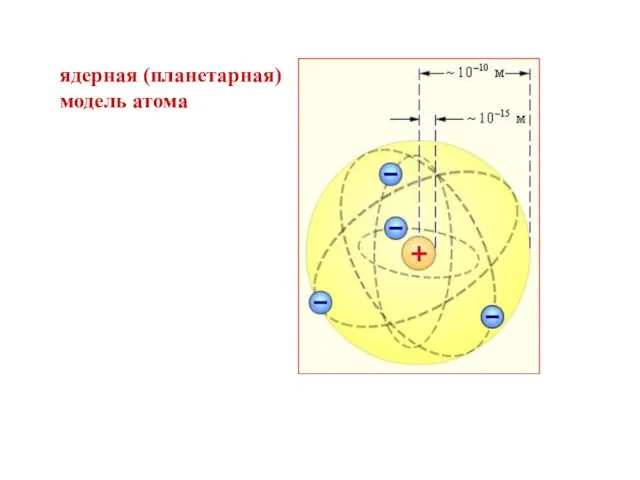
- 8. На основании своих исследований Резерфорд в 1911 г. предложил ядерную (планетарную) модель атома. Согласно этой модели,
- 9. ядерная (планетарная) модель атома
- 10. В модели Резерфорда радиус орбиты электрона и его энергия могут меняться непрерывно, т. е. может испускаться
- 11. Попытки построить модель атома в рамках классической физики не привели к успеху: модель Томсона была опровергнута
- 12. ПОСТУЛАТЫ БОРА. Первая попытка построения неклассической теории была предпринята Н. Бором в 1913 г. В теории
- 13. Тем не менее, такой принципиально непоследовательный путь привел к правильным результатам в некоторых вопросах, в частности,
- 14. Первый постулат Бора. В атоме существуют стационарные состояния, в которых он не излучает энергии. Стационарным состояниям
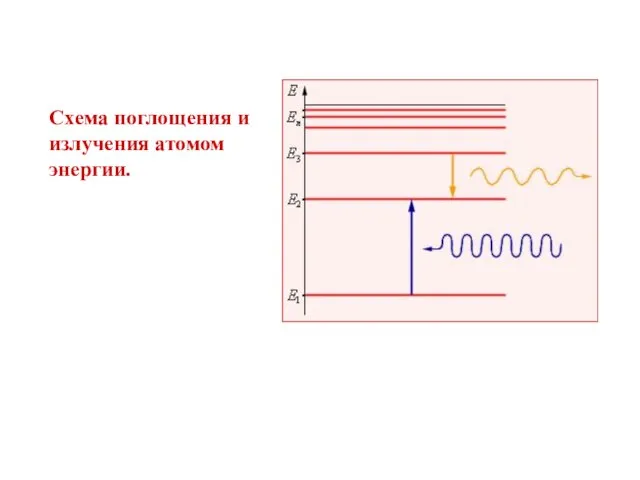
- 15. Второй постулат Бора. При переходе электрона с одной стационарной орбиты на другую излучается (поглощается) один фотон
- 16. Схема поглощения и излучения атомом энергии.
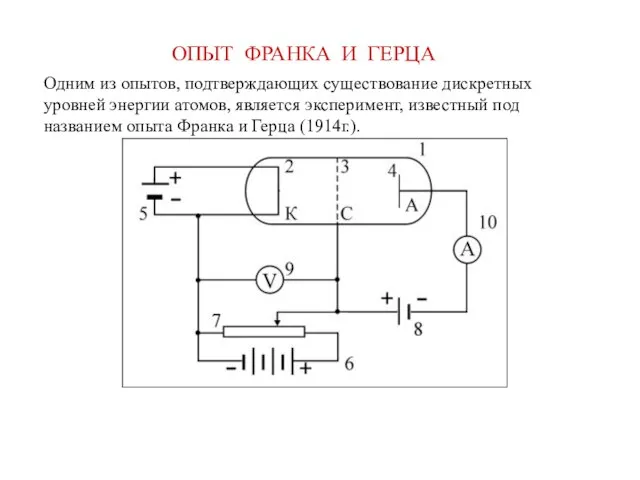
- 17. ОПЫТ ФРАНКА И ГЕРЦА Одним из опытов, подтверждающих существование дискретных уровней энергии атомов, является эксперимент, известный
- 18. В герметичную трубку 1 помещалось небольшое количество ртути. Воздух из трубки предварительно откачивался. Внутри трубки имелось
- 19. Между сеткой и анодом с помощью источника ЭДС 8 создавалось слабое электрическое поле, оказывающее тормозящее действие
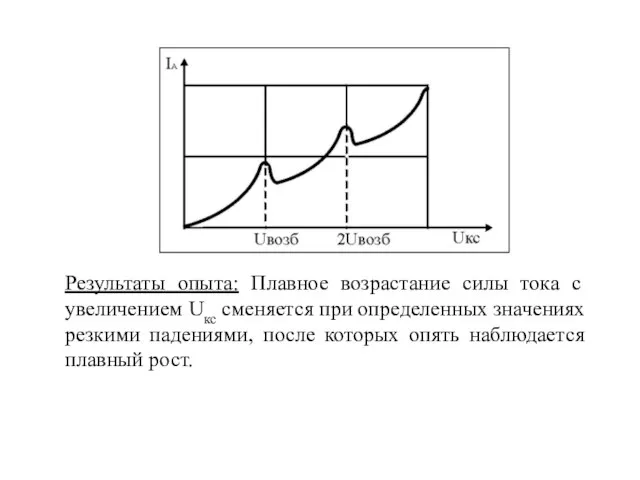
- 20. Результаты опыта: Плавное возрастание силы тока с увеличением Uкс сменяется при определенных значениях резкими падениями, после
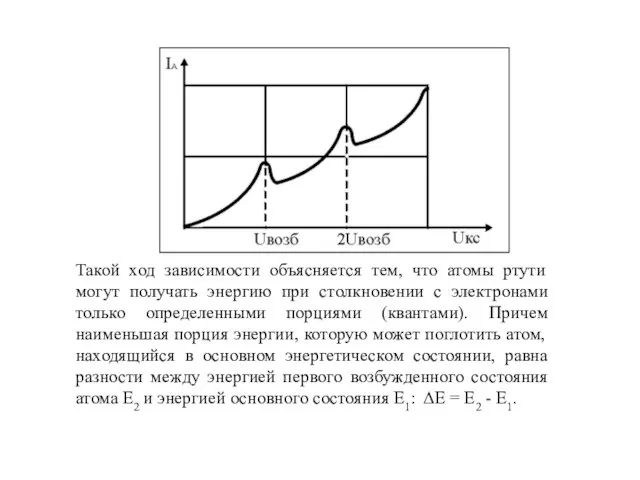
- 21. Такой ход зависимости объясняется тем, что атомы ртути могут получать энергию при столкновении с электронами только
- 22. Пока разность потенциалов Uкс (между катодом и сеткой) мала, кинетическая энергия электрона при его ускорении в
- 23. При дальнейшем увеличении Uкс сила тока опять возрастает: электроны, испытавшие неупругие соударения, успевают набрать энергию, достаточную
- 24. Вывод. Опыты Франка и Герца показали, что электроны при столкновении с атомами ртути передают атомам только
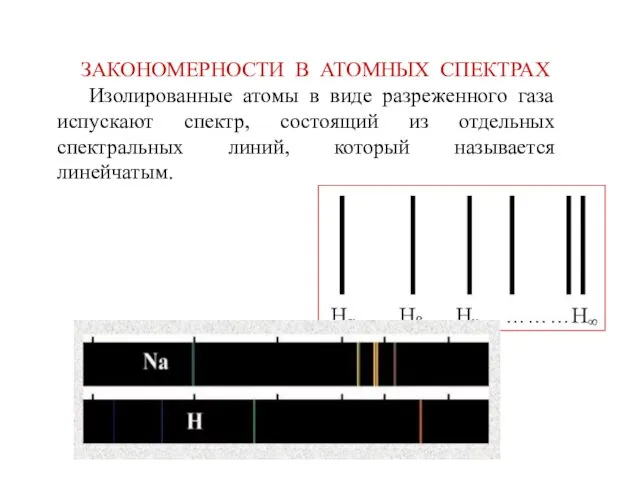
- 25. ЗАКОНОМЕРНОСТИ В АТОМНЫХ СПЕКТРАХ
- 26. Линии в спектрах расположены не беспорядочно, а объединяются в группы, или серии линий. Это отчетливо обнаруживается
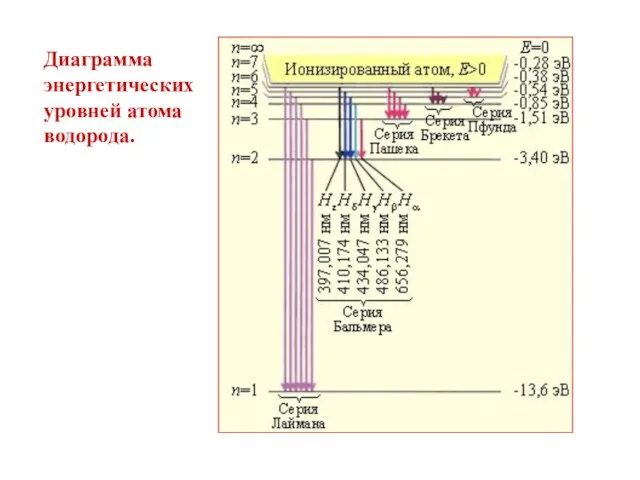
- 27. Дальнейшие исследования спектра водорода позволили открыть несколько различных серий: Серия Лаймана , n = 2,3,4,… УФ
- 28. Длины волн всех серий спектра водорода можно представить обобщенной формулой Бальмера: где m – 1, 2,
- 29. Диаграмма энергетических уровней атома водорода.
- 31. Скачать презентацию



















 Удивительная лошадка
Удивительная лошадка Червячные передачи
Червячные передачи Презентация на тему Радиоактивные превращения атомных ядер (9 класс)
Презентация на тему Радиоактивные превращения атомных ядер (9 класс)  Энергия. Потенциальная и кинетическая энергия
Энергия. Потенциальная и кинетическая энергия Откуда в наш дом приходит электричество?
Откуда в наш дом приходит электричество? Марковские процессы. Правило
Марковские процессы. Правило Векторы электрического поля
Векторы электрического поля Трехфазные цепи
Трехфазные цепи Закон всемирного тяготения
Закон всемирного тяготения Ворот-разновидность рычага
Ворот-разновидность рычага Квантовая криптография
Квантовая криптография Применение ядерной энергии в различных отраслях. Доза радиоактивного излучения. Развитие ядерной энергетики
Применение ядерной энергии в различных отраслях. Доза радиоактивного излучения. Развитие ядерной энергетики Расчет коленчатого вала. Лекция №11б
Расчет коленчатого вала. Лекция №11б Спектр электромагнитных волн
Спектр электромагнитных волн Globale Erwärmung
Globale Erwärmung Показатели надежности электроснабжения
Показатели надежности электроснабжения Прикладная механика. Лекция №1
Прикладная механика. Лекция №1 Мирный атом
Мирный атом Физика и познание мира
Физика и познание мира Технология монтажа и технического обслуживания измерительных приборов
Технология монтажа и технического обслуживания измерительных приборов Индукция магнитного поля
Индукция магнитного поля Реверберация. Лекция2
Реверберация. Лекция2 Циклогенез и антициклогенез. Гидродинамическая теория
Циклогенез и антициклогенез. Гидродинамическая теория Закон радиоактивного распада. Период полураспада
Закон радиоактивного распада. Период полураспада Механические колебания и волны. Звук
Механические колебания и волны. Звук Презентация (4)
Презентация (4) Политропные процессы. Лабораторная работа
Политропные процессы. Лабораторная работа Презентация на тему Влияние шума и музыки на здоровье человека
Презентация на тему Влияние шума и музыки на здоровье человека