Содержание
- 2. Гипотеза о том, что вещества состоят из большого числа атомов, зародилась свыше двух тысячелетий назад. Позиция
- 3. Конкретные представления о строении атома развивались по мере накопления физикой фактов о свойствах вещества 1887г. -
- 4. Сэр Джо́зеф Джон То́мсон (1856 - 1940) — английский физик, лауреат Нобелевской премии по физике 1906
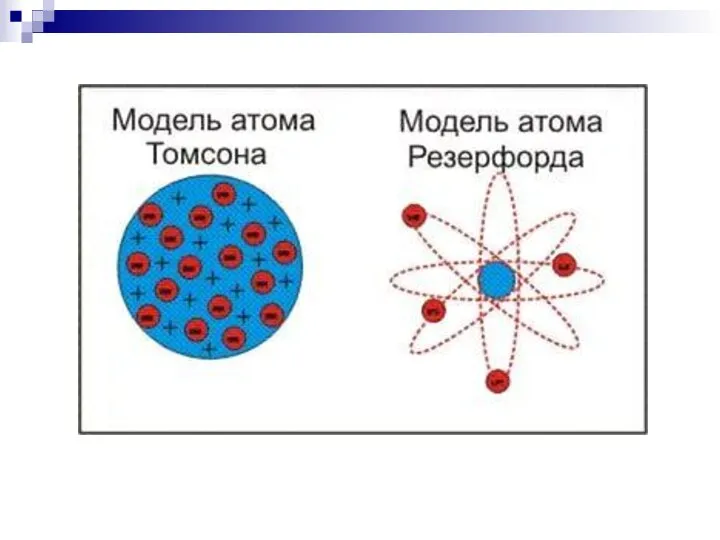
- 5. Модель строения атома Томсона Атом – шар, по всему объёму которого равномерно распределён положительный заряд. Внутри
- 6. Модель Томсона нуждалась в экспериментальной проверке. Важно было убедиться, действительно ли положительный заряд распределён по всему
- 7. Резерфорд Эрнест Резерфорд Эрнест (1871–1937) – английский физик, основоположник ядерной физики. Его исследования посвящены атомной и
- 8. Опыты Резерфорда 1906 г. Идея опыта Резерфорда: Зондировать атом альфа–частицами. Альфа-частицы возникают при распаде радия. Масса
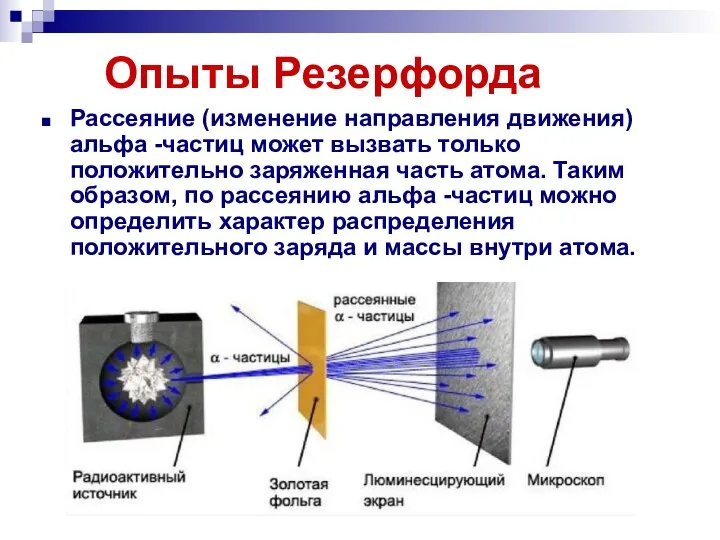
- 9. Опыты Резерфорда Рассеяние (изменение направления движения) альфа -частиц может вызвать только положительно заряженная часть атома. Таким
- 10. Опыты Резерфорда Модифицируя экспериментальную установку, Резерфорд попытался обнаружить отклонение альфа -частиц на большие углы. Для этого
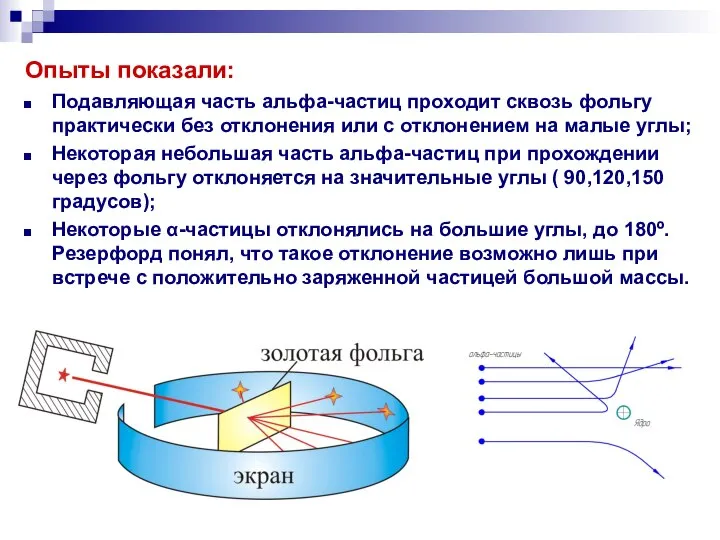
- 11. Опыты показали: Подавляющая часть альфа-частиц проходит сквозь фольгу практически без отклонения или с отклонением на малые
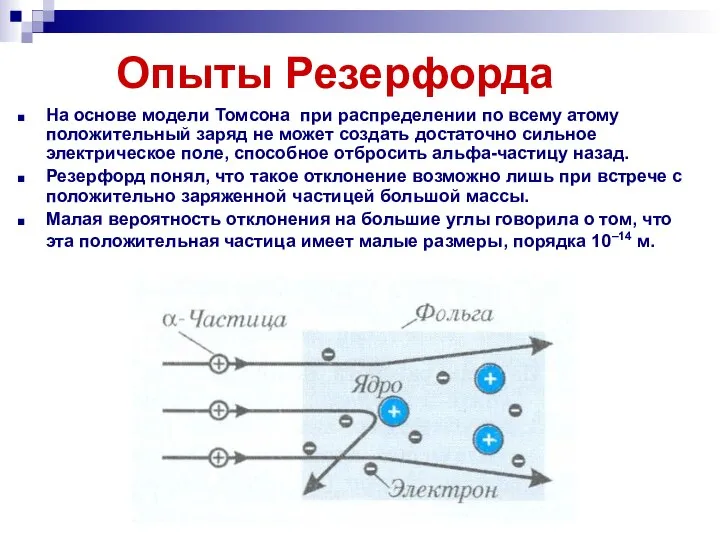
- 12. Опыты Резерфорда На основе модели Томсона при распределении по всему атому положительный заряд не может создать
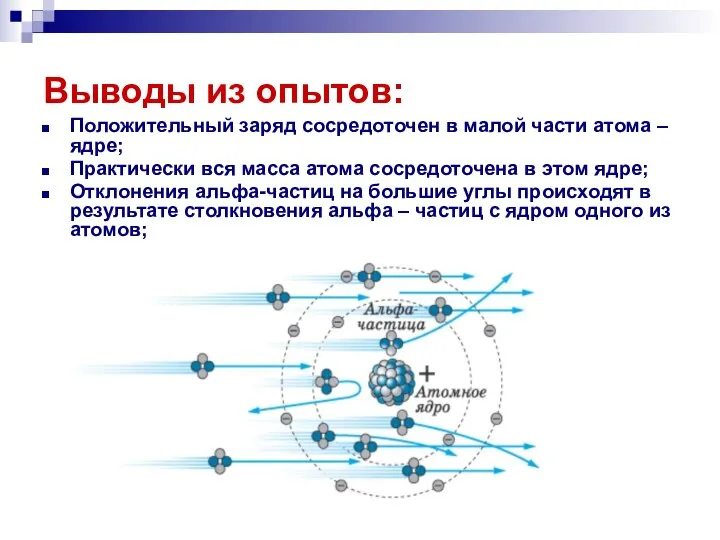
- 13. Выводы из опытов: Положительный заряд сосредоточен в малой части атома – ядре; Практически вся масса атома
- 14. Определение размеров атомного ядра Подсчитывая число альфа-частиц, рассеянных на различные углы, Резерфорд смог оценить размеры ядра.
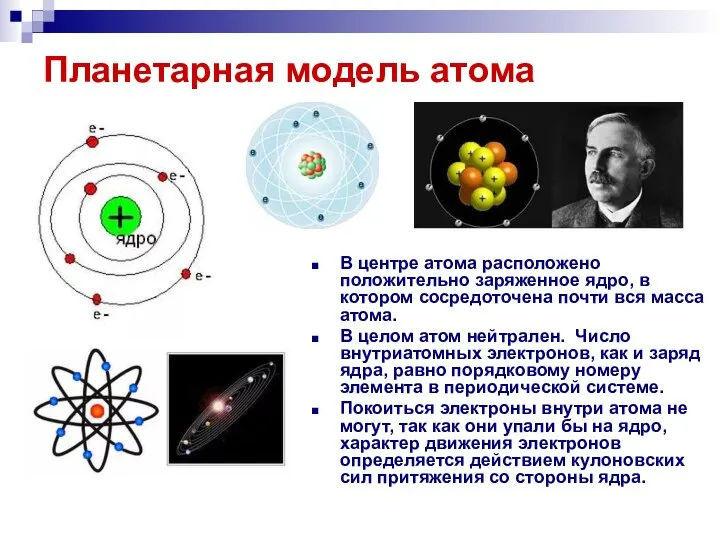
- 15. Планетарная модель атома В центре атома расположено положительно заряженное ядро, в котором сосредоточена почти вся масса
- 17. Недостатки модели атома Резерфорда Эта модель не согласуется с наблюдаемой стабильностью атомов. По законам классической электродинамики
- 18. Попыткой спасения планетарной модели атома стали постулаты Нильса Бора
- 19. Первый постулат Бора (постулат стационарных состояний) В атоме существуют стационарные состояния, в которых он не излучает
- 20. Второй постулат Бора (правило частот) При переходе электрона с одной стационарной орбиты на другую излучается (поглощается)
- 21. Границы применимости модели атома Резерфорда - Бора
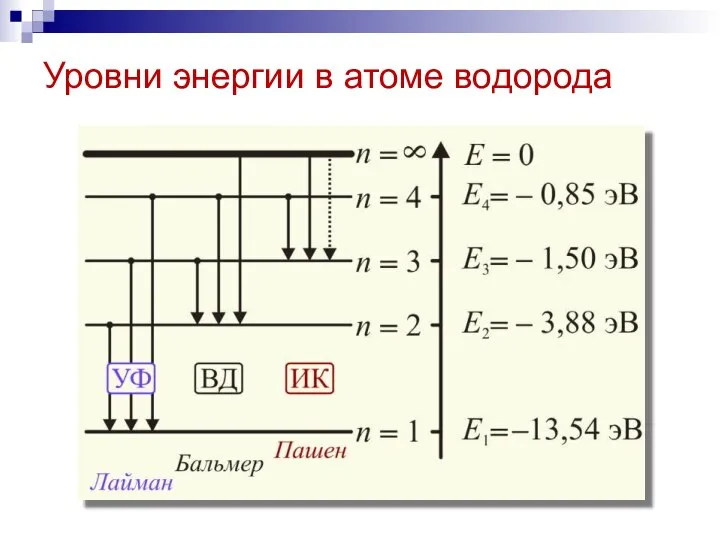
- 22. Уровни энергии в атоме водорода
- 24. Скачать презентацию














 Фундаментальные физические величины. Упражнения. Часть 2
Фундаментальные физические величины. Упражнения. Часть 2 Презентация урока физики в 8 классе «Параллельное соединение проводников ». Автор: Глазунова Лидия Ивановна, учитель физики МБО
Презентация урока физики в 8 классе «Параллельное соединение проводников ». Автор: Глазунова Лидия Ивановна, учитель физики МБО Электростатика. Сила Кулона
Электростатика. Сила Кулона Виды излучений. Источники света
Виды излучений. Источники света Основное оборудовние тепловых насосов
Основное оборудовние тепловых насосов Электрические машины. Вращающееся магнитное поле. Трехфазные асинхронные двигатели
Электрические машины. Вращающееся магнитное поле. Трехфазные асинхронные двигатели Сверхпроводимость. ВТСП структуры
Сверхпроводимость. ВТСП структуры Урок-конференция
Урок-конференция Закон Ома для последовательной электрической цепи переменного тока, содержащей активное и реактивное сопротивления
Закон Ома для последовательной электрической цепи переменного тока, содержащей активное и реактивное сопротивления Магнитное поле. Лекция 19. Закон Био-Савара-Лапласа. Теорема о циркуляции вектора магнитной индукции
Магнитное поле. Лекция 19. Закон Био-Савара-Лапласа. Теорема о циркуляции вектора магнитной индукции Ядерный реактор
Ядерный реактор Интегральные параметры переменного напряжения
Интегральные параметры переменного напряжения Двигуни внутрішнього згоряння
Двигуни внутрішнього згоряння Физика в картинках. Пирамиды в Гизе
Физика в картинках. Пирамиды в Гизе Что изучает физика
Что изучает физика Презентация на тему Электрические явления
Презентация на тему Электрические явления  Обратные задачи определения источника в уравнении теплопроводности
Обратные задачи определения источника в уравнении теплопроводности Ультразвук
Ультразвук Световое давление Урок для 11 класса.
Световое давление Урок для 11 класса. Изгиб. Основные понятия. Классификация видов изгибов
Изгиб. Основные понятия. Классификация видов изгибов Необходимость создания приемной антенно цифровой решетки для ультразвуковой безэховой камеры
Необходимость создания приемной антенно цифровой решетки для ультразвуковой безэховой камеры Параллельная работа одинаковых трубопроводов
Параллельная работа одинаковых трубопроводов قانون گاوس :کل شار الکتریکی که از یک سطح بسته عبور میکند،
قانون گاوس :کل شار الکتریکی که از یک سطح بسته عبور میکند، Основные понятия электродинамики
Основные понятия электродинамики Демонтаж тормозной системы автомобиля
Демонтаж тормозной системы автомобиля Презентация на тему Энергосбережение в быту (8 класс)
Презентация на тему Энергосбережение в быту (8 класс) 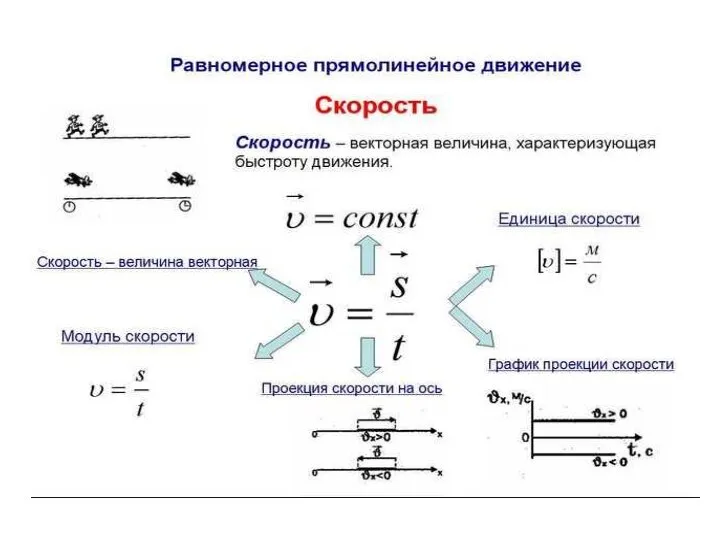 Равномерное прямолинейное движение
Равномерное прямолинейное движение Презентация по физике "Расчет стоимости электроэнергии. Электроприборы в быту. Техника электробезопасности" -
Презентация по физике "Расчет стоимости электроэнергии. Электроприборы в быту. Техника электробезопасности" -