Содержание
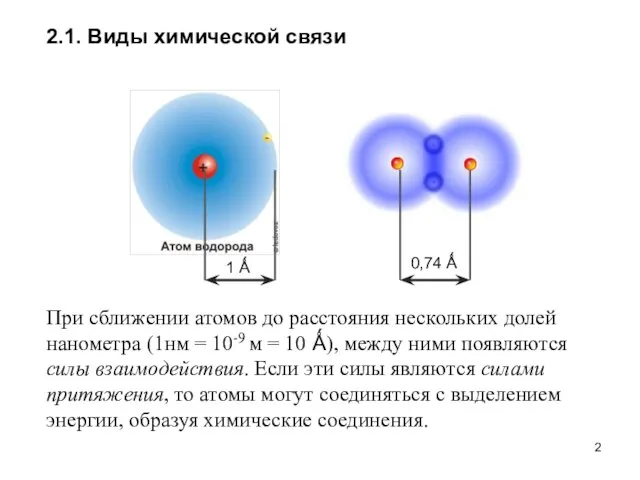
- 2. 2.1. Виды химической связи При сближении атомов до расстояния нескольких долей нанометра (1нм = 10-9 м
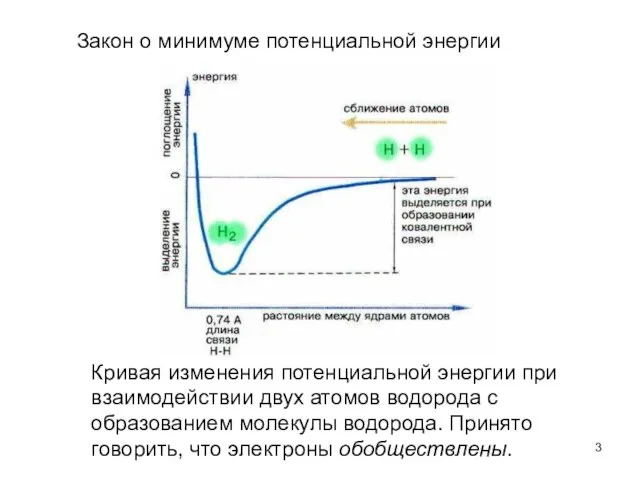
- 3. Кривая изменения потенциальной энергии при взаимодействии двух атомов водорода с образованием молекулы водорода. Принято говорить, что
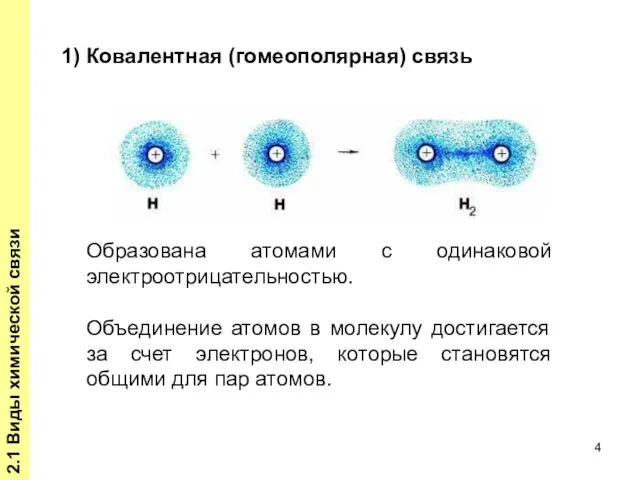
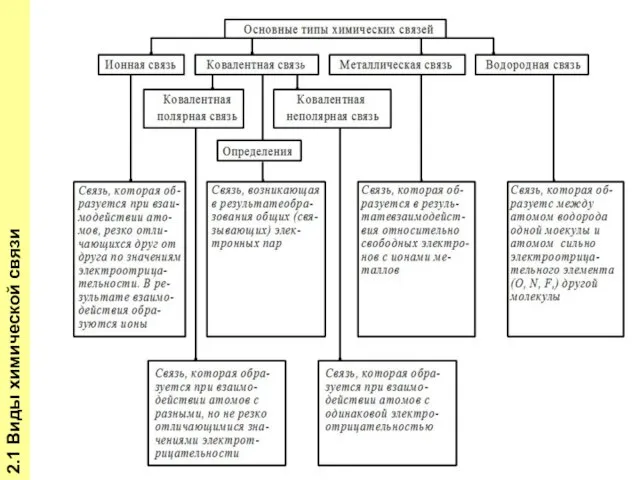
- 4. 2.1 Виды химической связи Образована атомами с одинаковой электроотрицательностью. Объединение атомов в молекулу достигается за счет
- 5. 2.1 Виды химической связи Ковалентная связь характерна как для органических, так и для неорганических соединений. К
- 6. 2.1 Виды химической связи Ковалентная неполярная связь центры положительных и отрицательных зарядов совпадают. Ковалентная полярная (дипольная)
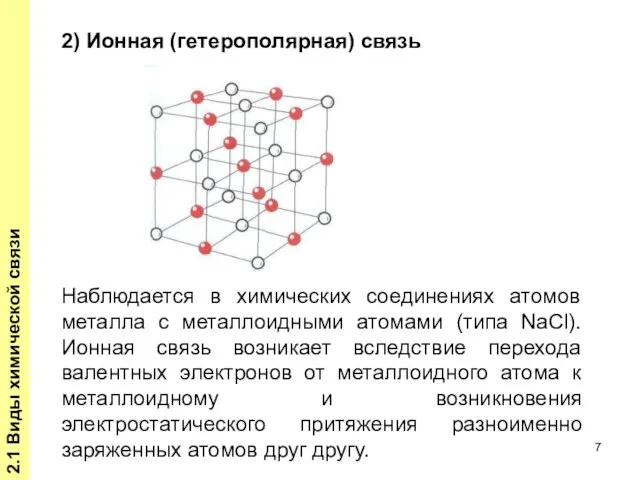
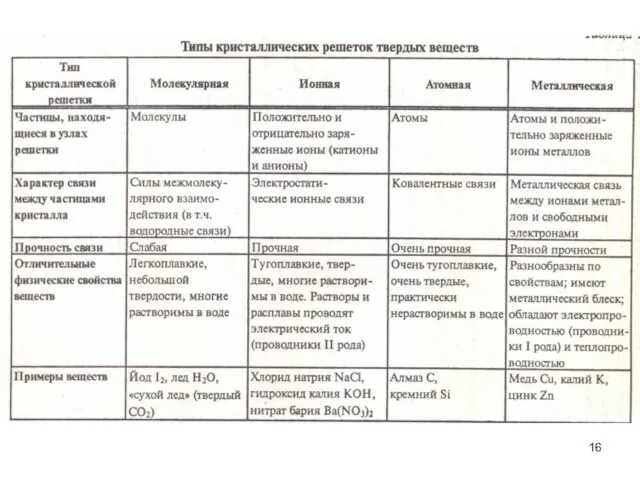
- 7. 2.1 Виды химической связи Наблюдается в химических соединениях атомов металла с металлоидными атомами (типа NaCl). Ионная
- 8. 2.1 Виды химической связи Сульфид свинца PbS Сульфид свинца — хороший материал полупроводниковой техники, фотоприемников и
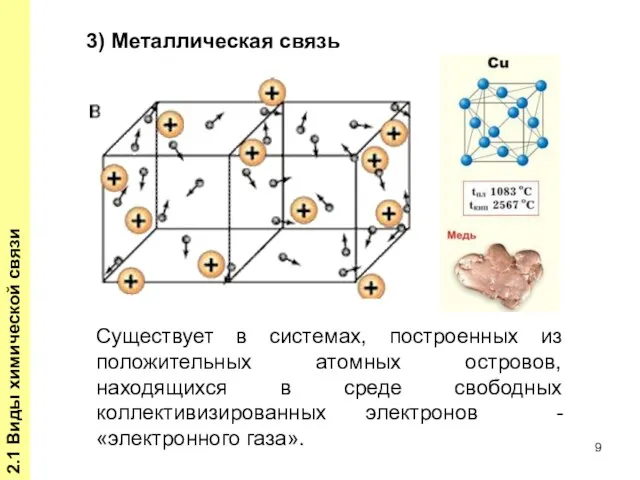
- 9. 2.1 Виды химической связи Существует в системах, построенных из положительных атомных островов, находящихся в среде свободных
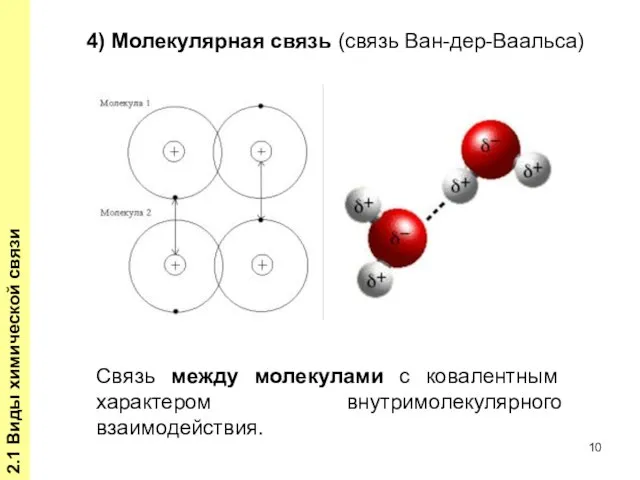
- 10. 2.1 Виды химической связи Связь между молекулами с ковалентным характером внутримолекулярного взаимодействия. 4) Молекулярная связь (связь
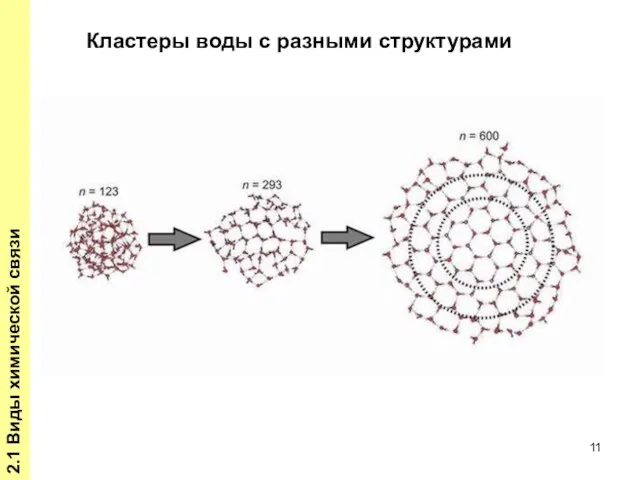
- 11. 2.1 Виды химической связи Кластеры воды с разными структурами
- 12. 2.1 Виды химической связи Парафины, компаунд Жидкие кристаллы
- 13. 2.1 Виды химической связи
- 14. Газообразное состояние молекул наиболее беспорядочное и структурно не устойчивое. Жидкое состояние вещества характеризуется определенным объемом, но
- 15. Твердое состояние характеризуется тремя признаками: упругостью, кристаллической структурой и скачкообразным изменением характеристик при плавлении. При медленном
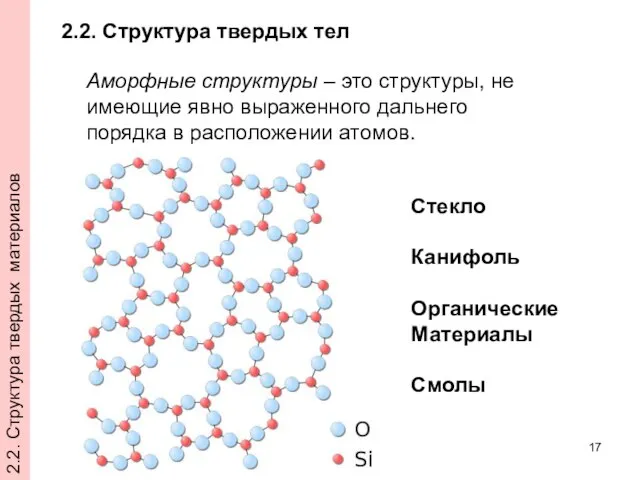
- 17. Аморфные структуры – это структуры, не имеющие явно выраженного дальнего порядка в расположении атомов. 2.2. Структура
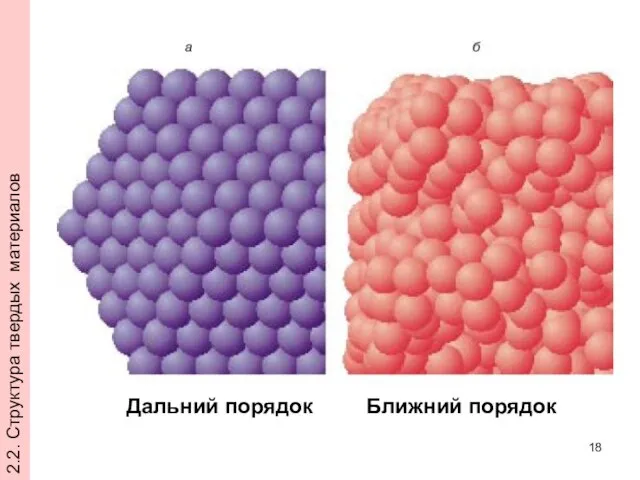
- 18. 2.2. Структура твердых материалов Дальний порядок Ближний порядок
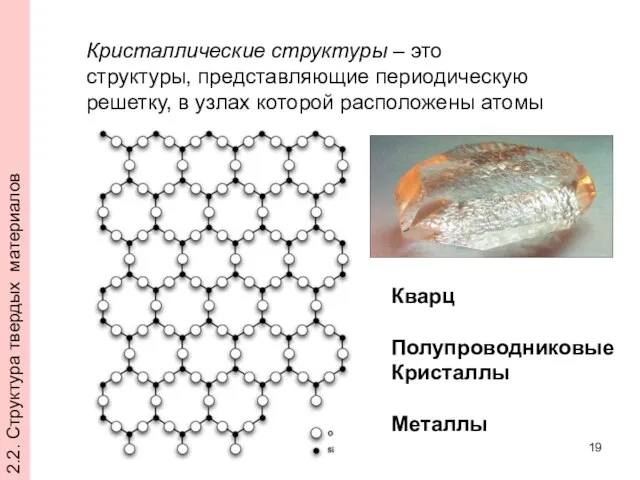
- 19. Кристаллические структуры – это структуры, представляющие периодическую решетку, в узлах которой расположены атомы Кварц Полупроводниковые Кристаллы
- 20. Монокристаллы – однородные анизотропные тела, которые характеризуются правильным порядком в расположении атомов во всем объеме и
- 21. Однако большинство кристаллических веществ являются поликристаллическими. Поликристаллические материалы состоят из множества сросшихся мелких кристаллов (кристаллитов), хаотически
- 22. Физические свойства: 1)Правильная форма. 2)Постоянная температура плавления 3)Изотропия. электротехническая сталь поликристалличский кремний 2.2. Структура твердых материалов
- 23. Если ориентацию кристаллитов упорядочить (мехобработкой металла, поляризацией сегнетокерамики), то материал становится анизотропным (такие тела называют текстурами).
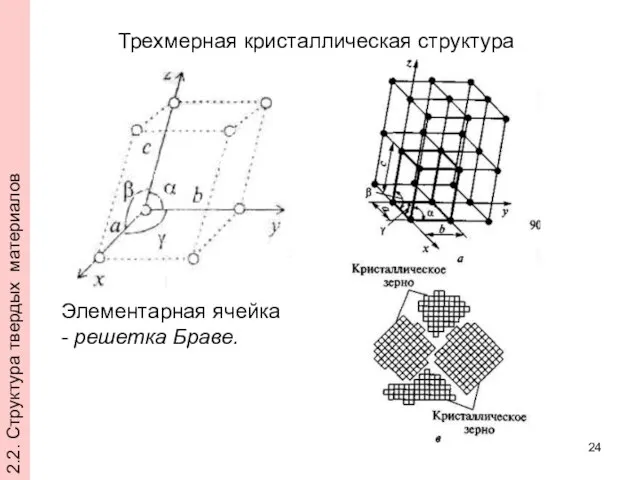
- 24. Трехмерная кристаллическая структура Элементарная ячейка - решетка Браве. 2.2. Структура твердых материалов
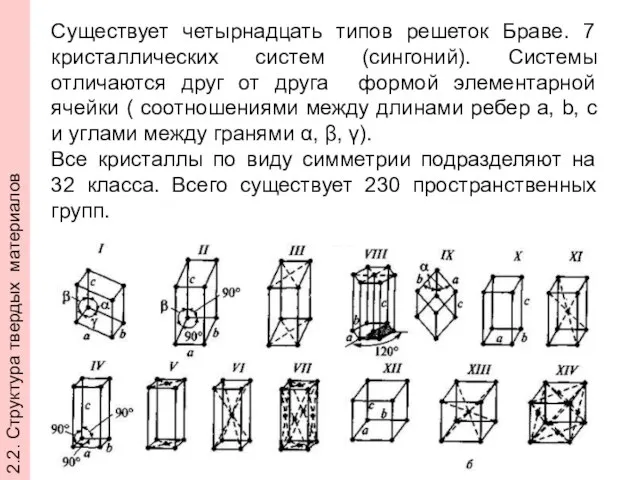
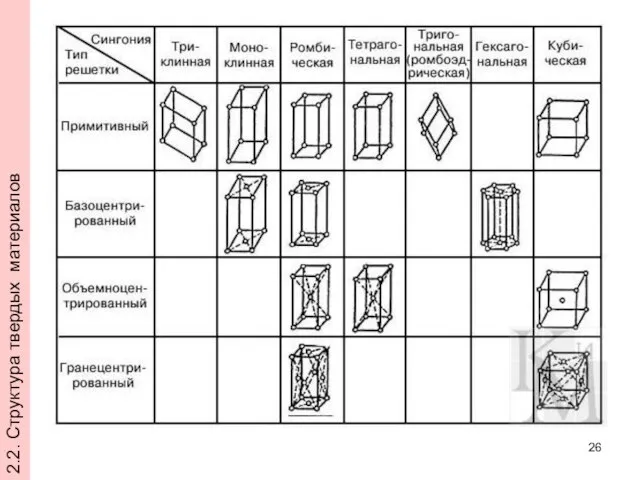
- 25. Существует четырнадцать типов решеток Браве. 7 кристаллических систем (сингоний). Системы отличаются друг от друга формой элементарной
- 26. 2.2. Структура твердых материалов
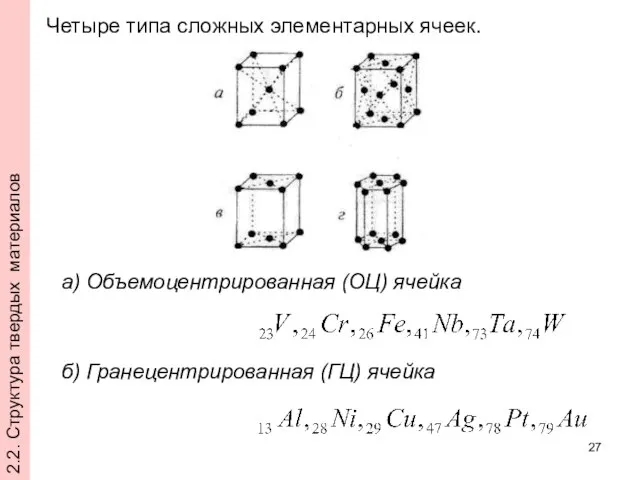
- 27. Четыре типа сложных элементарных ячеек. а) Объемоцентрированная (ОЦ) ячейка б) Гранецентрированная (ГЦ) ячейка 2.2. Структура твердых
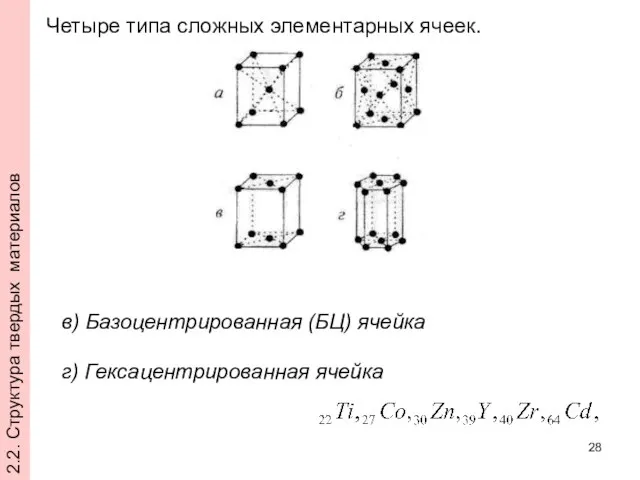
- 28. Четыре типа сложных элементарных ячеек. в) Базоцентрированная (БЦ) ячейка г) Гексацентрированная ячейка 2.2. Структура твердых материалов
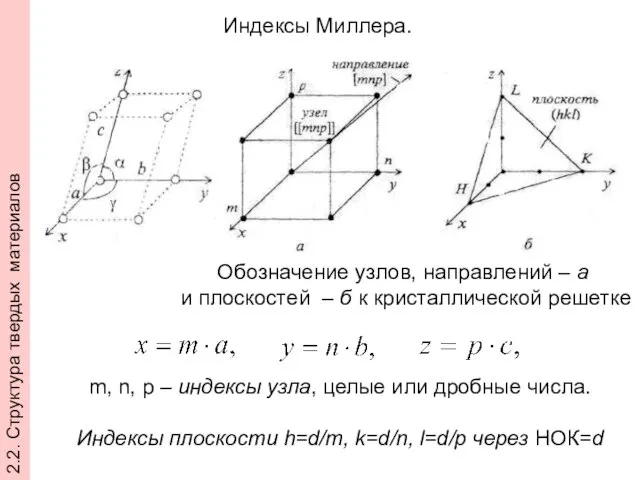
- 29. Индексы Миллера. Обозначение узлов, направлений – а и плоскостей – б к кристаллической решетке m, n,
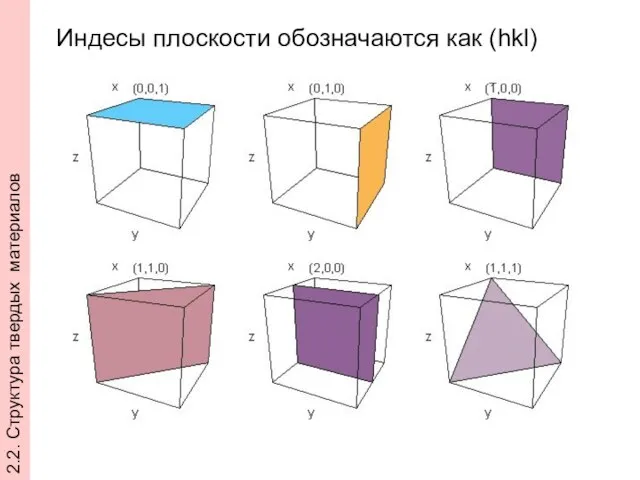
- 30. Индесы плоскости обозначаются как (hkl) 2.2. Структура твердых материалов
- 31. Полиморфизм (аллотропия) это способность образовывать не одну, а две и более кристаллические структуры, устойчивые при различных
- 32. 2.2. Структура твердых материалов α-Fe, β-Fe, γ-Fe Кривая охлаждения железа Fe
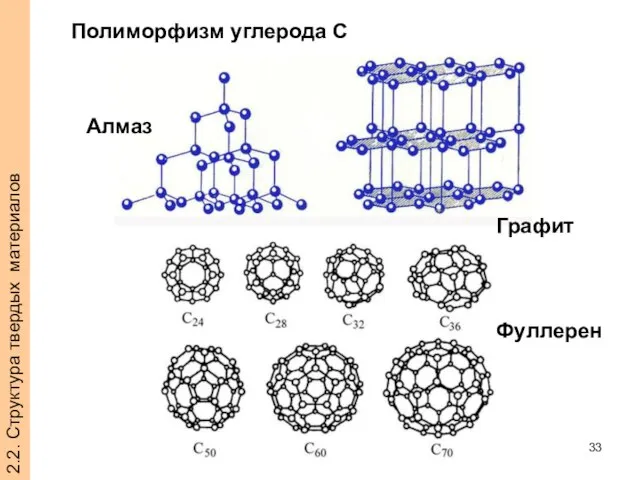
- 33. 2.2. Структура твердых материалов Полиморфизм углерода C Фуллерен Графит Алмаз
- 34. 2.2. Структура твердых материалов Полиморфизм углерода
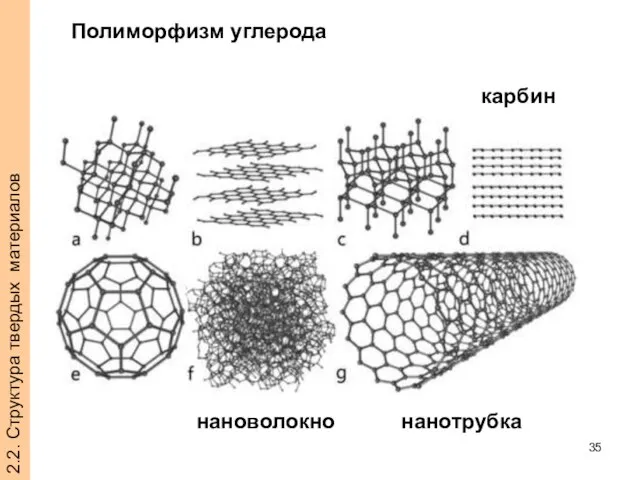
- 35. 2.2. Структура твердых материалов Полиморфизм углерода карбин нанотрубка нановолокно
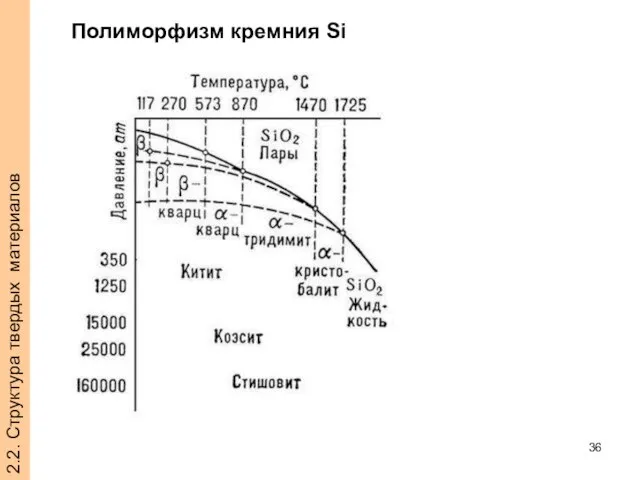
- 36. 2.2. Структура твердых материалов Полиморфизм кремния Si
- 37. 2.2. Структура твердых материалов Полиморфизм олова Sn T
- 38. 2.3. Структурные дефекты твердых тел. Дефекты – отклонения от регулярного расположения частиц в реальных кристаллах. 1)
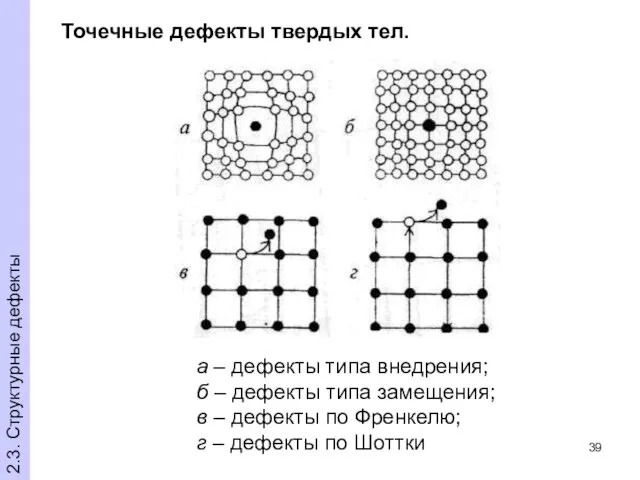
- 39. Точечные дефекты твердых тел. а – дефекты типа внедрения; б – дефекты типа замещения; в –
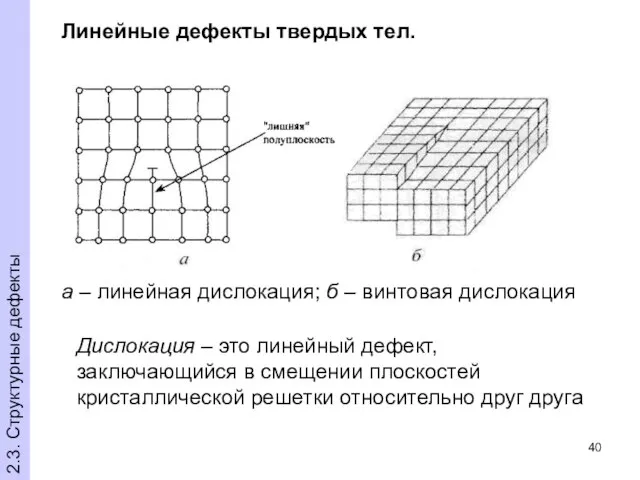
- 40. Линейные дефекты твердых тел. Дислокация – это линейный дефект, заключающийся в смещении плоскостей кристаллической решетки относительно
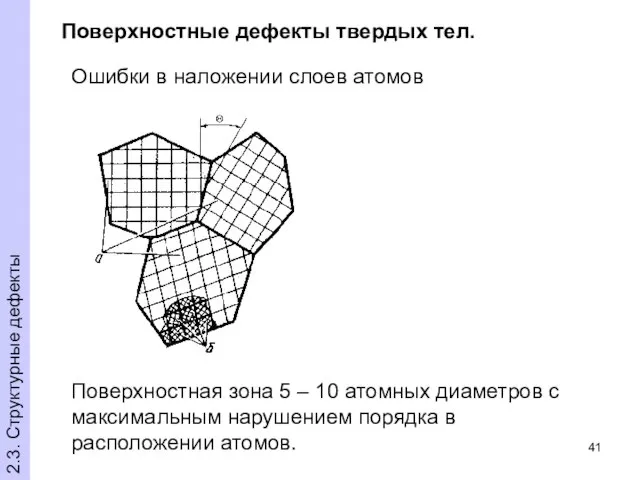
- 41. Поверхностные дефекты твердых тел. Поверхностная зона 5 – 10 атомных диаметров с максимальным нарушением порядка в
- 42. Объемные дефекты твердых тел. Имеют в трех измерениях сравнительно большие размеры несопоставимые с размерами атомов. К
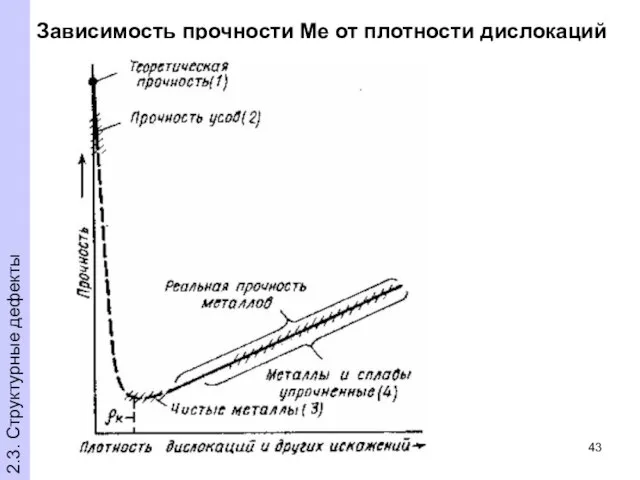
- 43. Зависимость прочности Ме от плотности дислокаций 2.3. Структурные дефекты
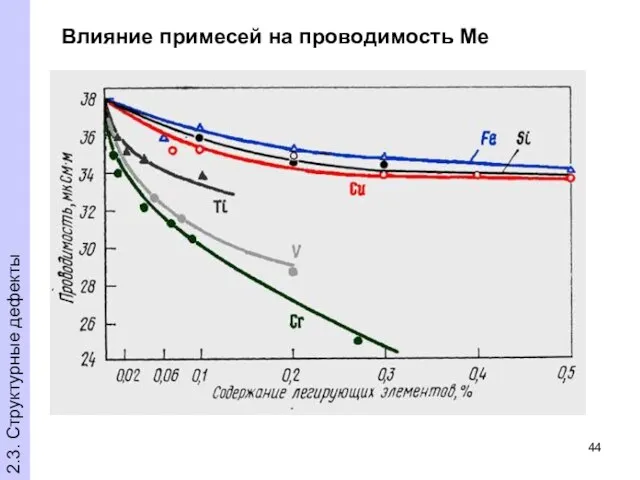
- 44. Влияние примесей на проводимость Ме 2.3. Структурные дефекты
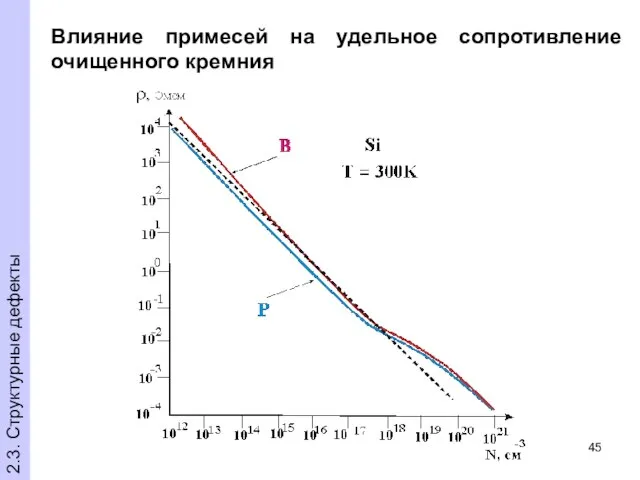
- 45. Влияние примесей на удельное сопротивление очищенного кремния 2.3. Структурные дефекты
- 47. Скачать презентацию















 маятник. волны
маятник. волны ДИНАМИКА в задачах (1)
ДИНАМИКА в задачах (1) Внутренняя энергия. Работа в термодинамике. Количество теплоты
Внутренняя энергия. Работа в термодинамике. Количество теплоты Презентация на тему Энергетические характеристики электрического поля
Презентация на тему Энергетические характеристики электрического поля  Лазеры
Лазеры Работа силы
Работа силы Занимательные физические опыты из подручных материалов
Занимательные физические опыты из подручных материалов Период полураспада. Закон радиоактивного распада
Период полураспада. Закон радиоактивного распада Количество теплоты. Удельная теплоёмкость
Количество теплоты. Удельная теплоёмкость Повторение систем карта. Электронный тест
Повторение систем карта. Электронный тест Визначення питомого опору провідника
Визначення питомого опору провідника Проводники и диэлектрики в электростатическом поле
Проводники и диэлектрики в электростатическом поле Расчет глушителей шума
Расчет глушителей шума Ньютон и свет
Ньютон и свет Сложное движение точки
Сложное движение точки Табличные величины см. таблицы сборника задач для 8 класса автор Генденштейн
Табличные величины см. таблицы сборника задач для 8 класса автор Генденштейн Определение расстояния до недоступной точки
Определение расстояния до недоступной точки Естественная радиоактивность. Закон радиоактивного распада
Естественная радиоактивность. Закон радиоактивного распада Давление твердых тел
Давление твердых тел Лекция 25
Лекция 25 Проводники и диэлектрики в электрическом поле. Решение задач
Проводники и диэлектрики в электрическом поле. Решение задач Применение ядерной энергии в различных отраслях. Доза радиоактивного излучения
Применение ядерной энергии в различных отраслях. Доза радиоактивного излучения Конденсаторы. Электроёмкость конденсатора. Энергия заряжённого конденсатора. Применение конденсаторов
Конденсаторы. Электроёмкость конденсатора. Энергия заряжённого конденсатора. Применение конденсаторов Шумоподавляющие фильтры
Шумоподавляющие фильтры 840842
840842 Ядерные реакции
Ядерные реакции Изменение в агрегатных состояний вещества
Изменение в агрегатных состояний вещества Развитие интереса к физике у детей начальной школы. Занимательные опыты
Развитие интереса к физике у детей начальной школы. Занимательные опыты