Содержание
- 2. Основной геохимический закон В.М. Гольдшмидта гласит: кларки элементов зависят от строения атомного ядра, а их миграция
- 3. Ядро состоит из нуклонов - положительно заряженных протонов (z) и не имеющих заряда нейтронов (n). Массы
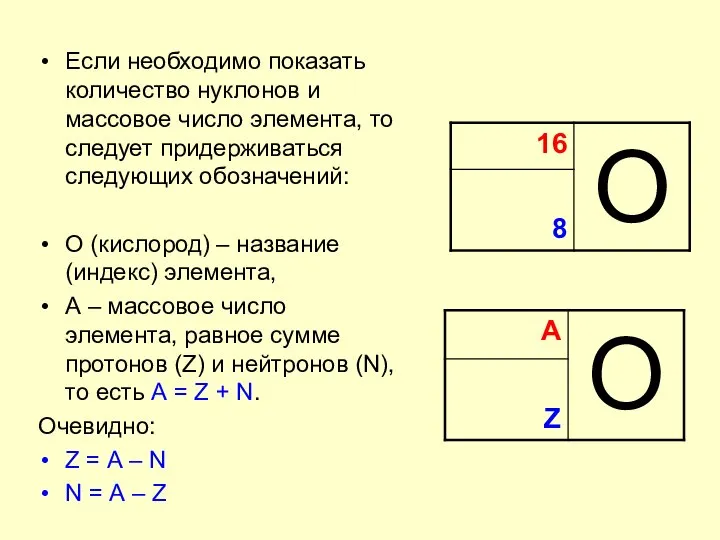
- 4. Если необходимо показать количество нуклонов и массовое число элемента, то следует придерживаться следующих обозначений: О (кислород)
- 5. Структура ядра однозначно не расшифрована Экспериментально установлено, что масса протонов и нейтронов в ядре всегда меньше
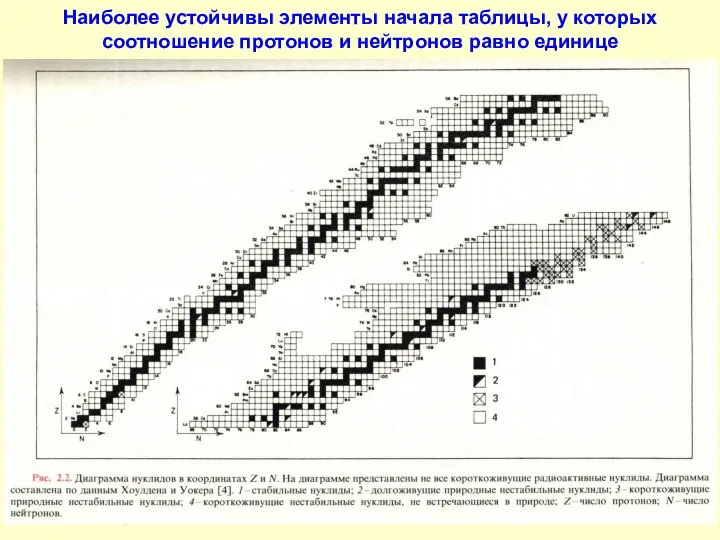
- 6. Наиболее устойчивы элементы начала таблицы, у которых соотношение протонов и нейтронов равно единице
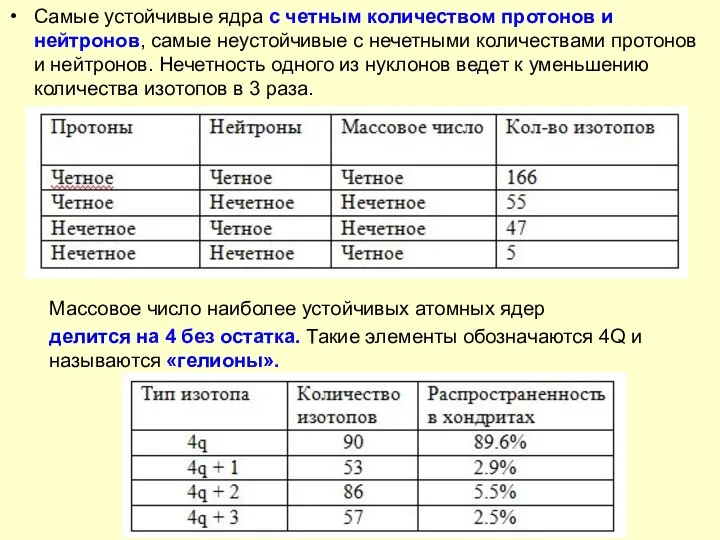
- 7. Самые устойчивые ядра с четным количеством протонов и нейтронов, самые неустойчивые с нечетными количествами протонов и
- 8. Ядра у которых количество протонов или нейтронов равно 2, 8, 20, 28, 50, 82, 126 -
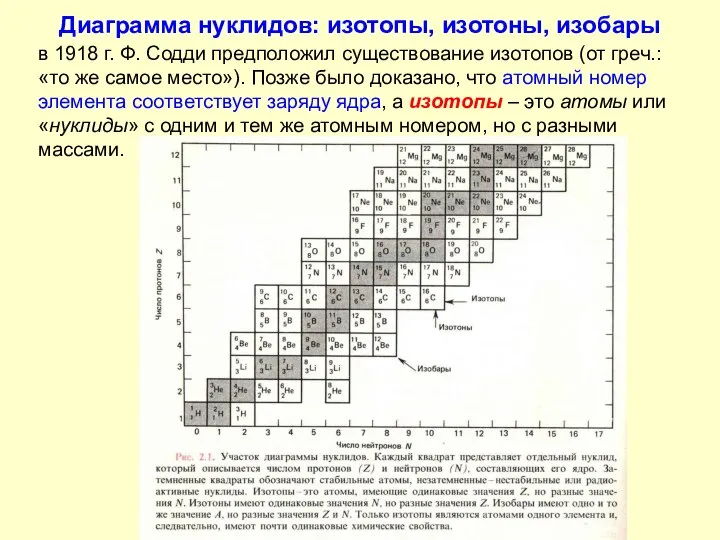
- 9. Диаграмма нуклидов: изотопы, изотоны, изобары в 1918 г. Ф. Содди предположил существование изотопов (от греч.: «то
- 10. Классификация нуклидов 1. Стабильные нуклиды. 2. Долгоживущие природные нестабильные нуклиды 3. Короткоживущие природные нестабильные нуклиды. 4.
- 12. Скачать презентацию





 Кинетическая и потенциальная энергия. Открытый урок по физике
Кинетическая и потенциальная энергия. Открытый урок по физике Фазовые переходы
Фазовые переходы Определить импульс фотона с энергией
Определить импульс фотона с энергией Энергия. Работа. Мощность
Энергия. Работа. Мощность Физикалық шама
Физикалық шама Электромагнитные волны
Электромагнитные волны Стартовый ускоритель
Стартовый ускоритель Явления тяготения. Сила тяжести
Явления тяготения. Сила тяжести Электрическая винто-моторная установка для БПЛА С
Электрическая винто-моторная установка для БПЛА С Эрнест Резерфорд
Эрнест Резерфорд Физика в эпоху античности
Физика в эпоху античности Исследование цепей с последовательным и параллельным соединением резисторов
Исследование цепей с последовательным и параллельным соединением резисторов Параметры сопряжения деталей
Параметры сопряжения деталей Системы АРУ. Примеры и реализация
Системы АРУ. Примеры и реализация Биологическое действие радиоактивных излучений
Биологическое действие радиоактивных излучений Механическая работа
Механическая работа Электромагнитные явления
Электромагнитные явления Использование электромагнитной индукции
Использование электромагнитной индукции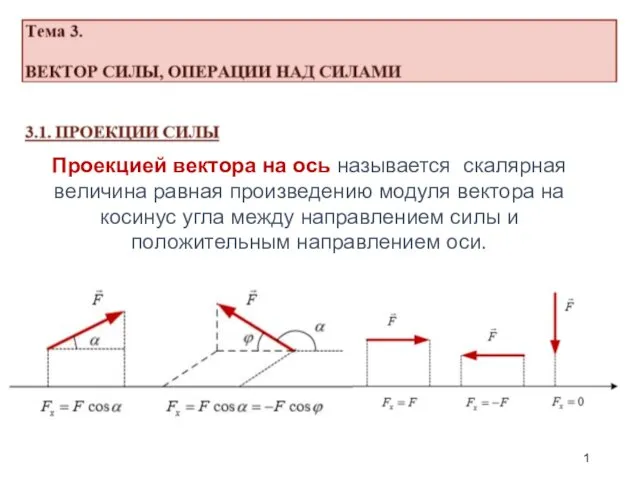 Вектор силы, операции над силами
Вектор силы, операции над силами M_P_Rezistivnye_M (1)
M_P_Rezistivnye_M (1) Радіо. Історія виникнення радіозв'язку
Радіо. Історія виникнення радіозв'язку Математическое введение
Математическое введение Фотоэффект
Фотоэффект Презентация ученицы 11 «А» класса Очеретиной Александры
Презентация ученицы 11 «А» класса Очеретиной Александры Последовательность операций
Последовательность операций Измерение температуры
Измерение температуры Шалаев Хиггс
Шалаев Хиггс Три состояния вещества
Три состояния вещества