Содержание
- 2. Понятие энергии относится ко всем результатам проявления действия силы или движения, вызывающего эти результаты или вызываемого
- 3. Среди этих различных форм энергии нас больше всего интересуют механическая и тепловая энергия, которые обычно называются
- 4. В своей книге "Теплота и беспорядок P.W.Atkins пишет: "Нагреть тело означает передать ему энергию особым способом
- 5. Работа Элементарное количество энергетического воздействия dz, приходящееся на каждую степень свободы, в механике выражают в виде
- 6. В случае деформационного воздействия (работа) роль обобщенной силы играет абсолютное давление Р, а сопряженной обобщенной координаты
- 7. Введем понятие «параметры начального состояния» это параметры системы в начале процесса n1,P1,V1,T1. Параметры определяющие конечное состояние
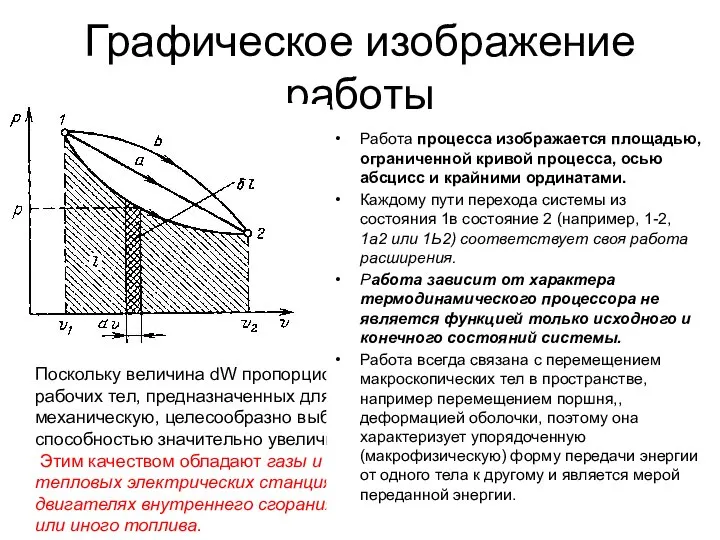
- 8. Графическое изображение работы Поскольку величина dW пропорциональна увеличению объема, то в качестве рабочих тел, предназначенных для
- 9. Теплота Помимо макрофизическои формы передачи энергии — работы существует также и микрофизическая, т. е. осуществляемая на
- 10. Теплота может передаваться либо при непосредственном контакте между телами (теплопроводностью, конвекцией), либо на расстоянии (излучением), причем
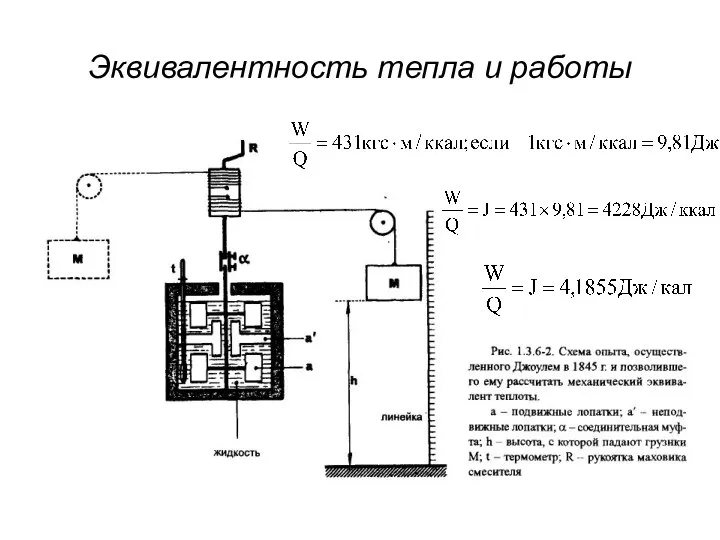
- 11. Эквивалентность тепла и работы
- 12. Внутренняя энергия системы «Внутренняя энергия", определяет энергетическое состояние системы в данный момент времени. Если обозначить через
- 13. Уравнение U2=U1+(W+Q) показывает, что вычислить конечную внутреннюю энергию можно, только зная начальную внутреннюю энергию. Поскольку нет
- 14. Энтальпия ΔU=Q+W-изменение внутренней энергии W=-P(ΔV)- работа сил давления ΔU=Q-PΔV Q1,2=ΔU1,2 +P(ΔV)1,2-давление поддерживается постоянным и система под
- 15. Энтальпия единицы массы идеального газа равна Δh=cp(T2-T1),a cp/cv=k=Δh/Δu
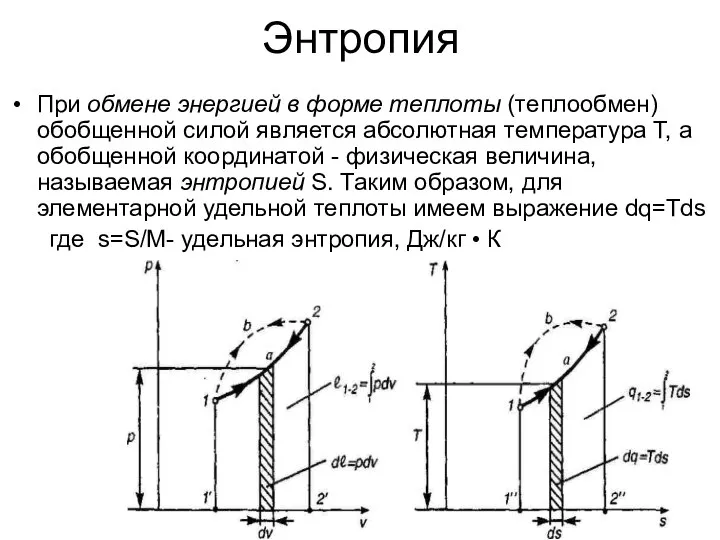
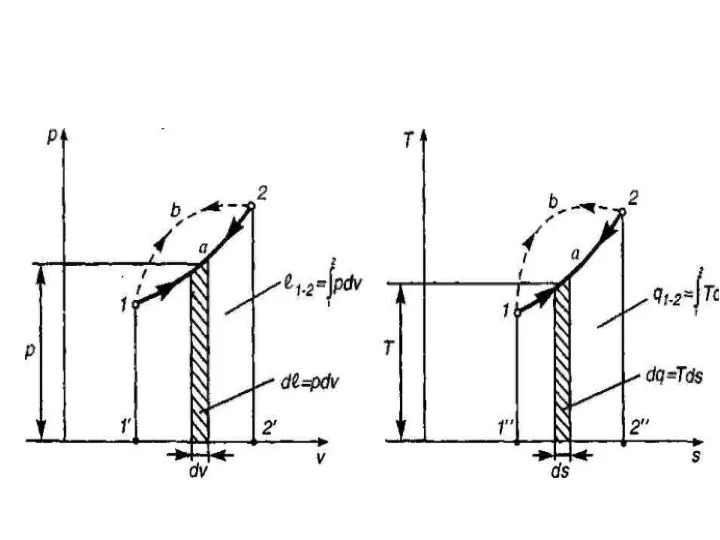
- 16. Энтропия При обмене энергией в форме теплоты (теплообмен) обобщенной силой является абсолютная температура T, а обобщенной
- 18. Если температура постоянна, то изменение энтропии равно частному от деления количества тепловой энергии, полученной или отданной,
- 19. Понятие энтропии позволяет дать количественную оценку способу, с помощью которого запасается энергия: когда она запасается при
- 20. Энтропийный кризис Земли "Такой подход к рассмотрению энтропии как величины, дающей количественную оценку способа, которым запасается
- 21. Формы энергии Различные формы энергии могут быть разделены на две группы: первая включает формы энергии, способные
- 22. вся энергия состоит частично из эксергии и частично из анергии, причем одна из этих частей может
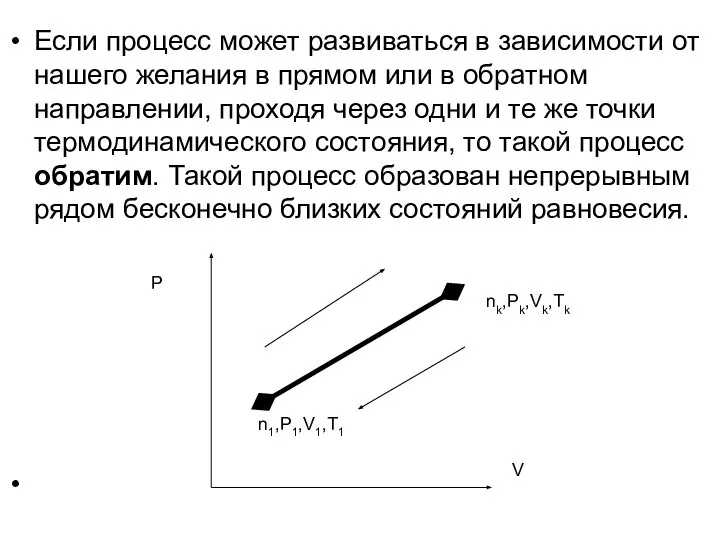
- 23. Если процесс может развиваться в зависимости от нашего желания в прямом или в обратном направлении, проходя
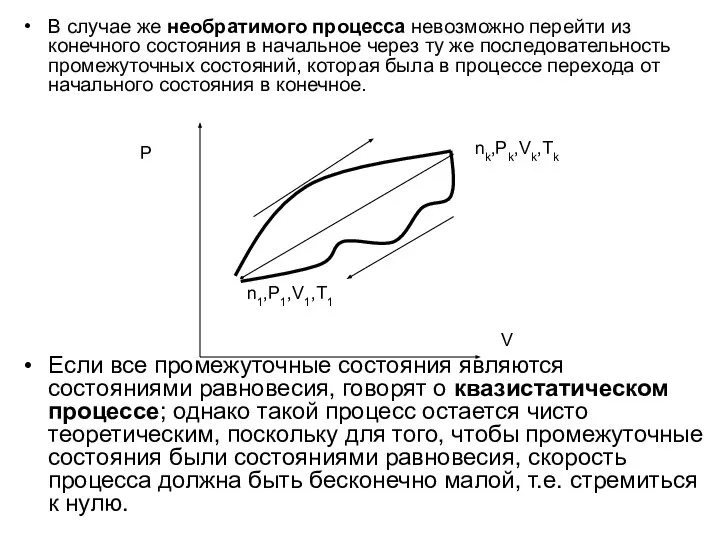
- 24. В случае же необратимого процесса невозможно перейти из конечного состояния в начальное через ту же последовательность
- 25. "В любом термодинамическом процессе алгебраическая сумма работы, совершенной над системой, и количества полученного ею тепла Q+W
- 27. Скачать презентацию


















 Ньютон (урок физики в 10 классе)
Ньютон (урок физики в 10 классе) Ультразвук. Понятие ультразвук
Ультразвук. Понятие ультразвук Использование электронных образовательных ресурсов в преподавании физики
Использование электронных образовательных ресурсов в преподавании физики Состояние вещества. Тест
Состояние вещества. Тест Математическая модель канала связи
Математическая модель канала связи Давление газа
Давление газа Презентация урока физики 8 класс. Тема: Агрегатные превращения веществ. Тип урока: обобщение изученного материала. Це
Презентация урока физики 8 класс. Тема: Агрегатные превращения веществ. Тип урока: обобщение изученного материала. Це Устройство и установка машинной иглы. 6 класс
Устройство и установка машинной иглы. 6 класс Энергия топлива. Удельная теплота сгорания топлива
Энергия топлива. Удельная теплота сгорания топлива Строение атомов
Строение атомов Флот начала XX века
Флот начала XX века Презентация на тему Оптические приборы
Презентация на тему Оптические приборы  Презентация на тему Сила Ампера
Презентация на тему Сила Ампера  Тест по теме Электрический ток
Тест по теме Электрический ток Przekladnie pasowe ang
Przekladnie pasowe ang Презентация на тему Парообразование и конденсация
Презентация на тему Парообразование и конденсация  Магнитное поле. Лекция 22. Магнитный поток. Закон фарадея. Самоиндукция
Магнитное поле. Лекция 22. Магнитный поток. Закон фарадея. Самоиндукция სიგნალის მათემატიკური წარმოდგენა
სიგნალის მათემატიკური წარმოდგენა Использование электромагнитов
Использование электромагнитов Способы представления технической и технологической информации. Электрическая схема. 7 класс
Способы представления технической и технологической информации. Электрическая схема. 7 класс Диагностика шума подвески кабины
Диагностика шума подвески кабины Решение задач. Мощность
Решение задач. Мощность Резонансное туннелирование электромагнитных волн через слой неоднородной плазмы ионосферы
Резонансное туннелирование электромагнитных волн через слой неоднородной плазмы ионосферы Презентация на тему Линзы
Презентация на тему Линзы  Основы динамического электричества
Основы динамического электричества Презентация на тему Внутренняя энергия. Количество теплоты
Презентация на тему Внутренняя энергия. Количество теплоты  Многоканальный эмиссионный спектрометр ДФС-7
Многоканальный эмиссионный спектрометр ДФС-7 Перископ. Введение
Перископ. Введение