Содержание
- 2. ПЛАН ЛЕКЦИИ 1. Основные понятия теории фазовых равновесий. 2. Правило фаз Гиббса. Фазовые диаграммы однокомпонентных и
- 3. В фармацевтической химии важным фактором является чистота веществ. Для очистки веществ используются такие методы, как возгонка,
- 4. ОСНОВНЫЕ ПОНЯТИЯ ТЕОРИИ ФАЗОВЫХ РАВНОВЕСИЙ Основными понятиями теории фазовых равновесий являются: фаза, компонент и степень свободы.
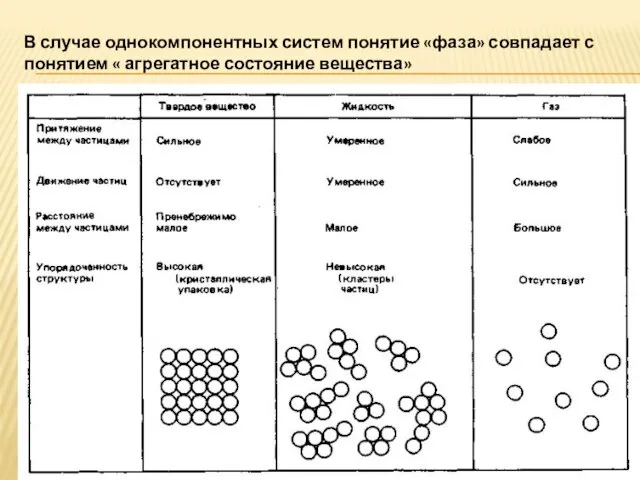
- 5. В случае однокомпонентных систем понятие «фаза» совпадает с понятием « агрегатное состояние вещества»
- 6. ФАЗОВЫЕ СОСТОЯНИЯ По ощущениям, которые производят различные вещества на органы чувств человека, они могут быть разделены
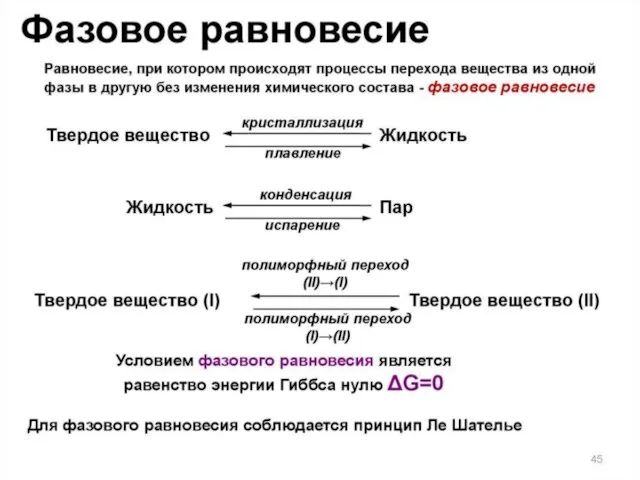
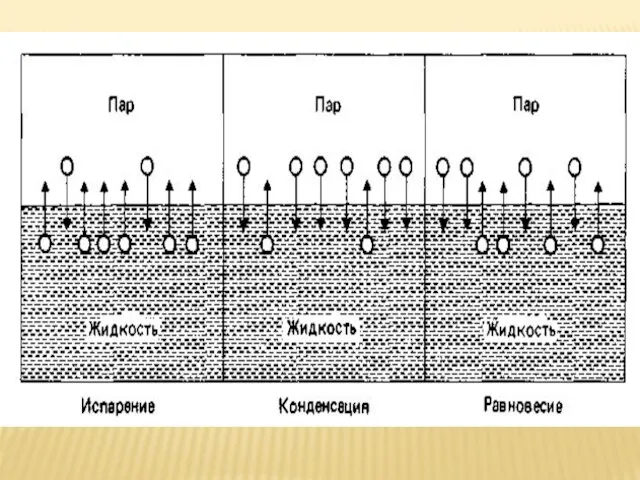
- 7. ФАЗОВЫЕ ПЕРЕХОДЫ Переход вещества из одного фазового состояния в другое - фазовый переход – сопровождается скачкообразным
- 10. Температура плавления Тпл, К- температура, которая соответствует фазовому равновесию Т⇄Ж, при постоянном давлении она устанавливается от
- 11. Существование вещества в том или ином фазовом состоянии зависит от температуры и давления. Повышение температуры всегда
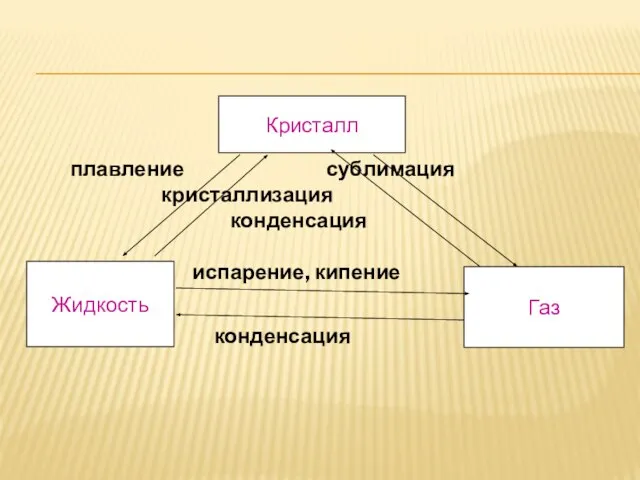
- 12. плавление сублимация кристаллизация конденсация испарение, кипение конденсация Кристалл Жидкость Газ
- 13. Фазовые переходы сопровождаются выделением или поглощением теплоты и значительным изменением энтропии. Если фазовый переход вещества совершаются
- 14. Если переход совершается при понижении температуры (конденсация, сжижение, отвердевание), то он сопровождается выделением теплоты и для
- 15. Принято при символе изменения H и S указывать название ф.п. ΔHИСП, ΔSПЛ. Кристаллическое состояние одного и
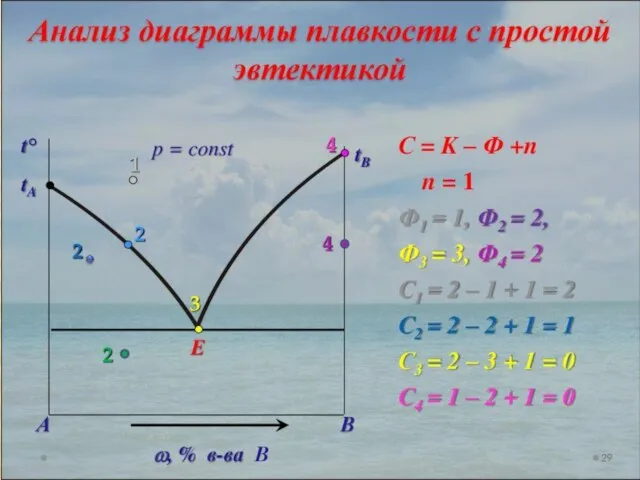
- 18. ПРАВИЛО ФАЗ ГИББСА Число степеней свободы равновесной термодинамической системы, на которую из внешних факторов влияют только
- 19. Правило фаз Гиббса позволяет определить максимальное число фаз в момент равновесия; определить наименьшее число параметров, необходимых
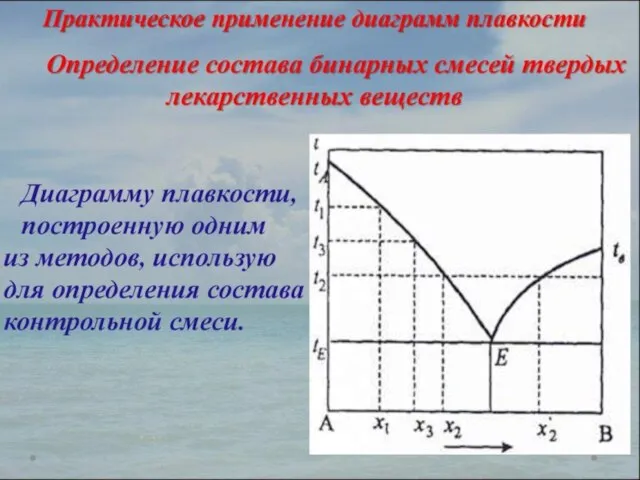
- 22. ПОНЯТИЕ О ФИЗИКО-ХИМИЧЕСКОМ АНАЛИЗЕ. ТЕРМИЧЕСКИЙ АНАЛИЗ Учение о зависимости свойств многокомпонентных систем (давление пара, температура плавления,
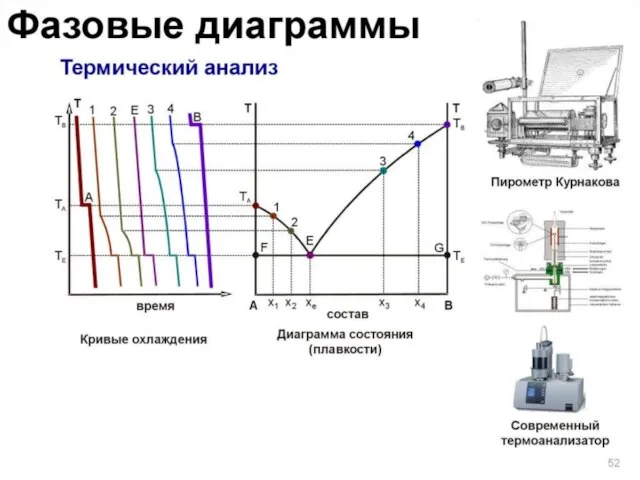
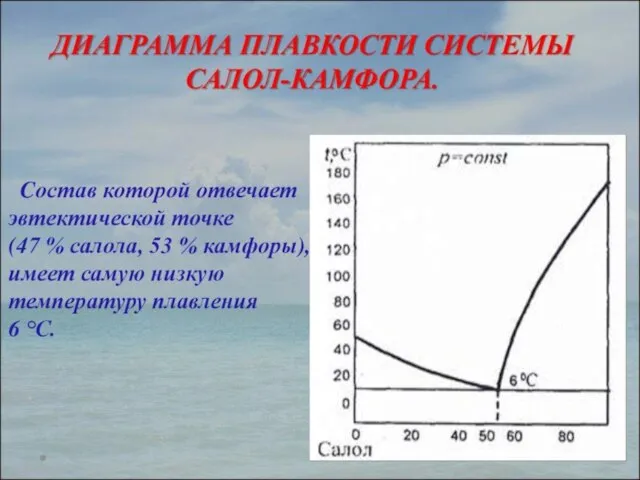
- 23. ТЕРМИЧЕСКИЙ АНАЛИЗ раздел физико-химического анализа, который изучает зависимость температуры кристаллизации или плавления исследуемой системы от ее
- 24. Физико-химический метод анализа основан на построении диаграмм «состав-свойство». Курнаковым сформулированы принципы построения таких диаграмм: принцип соответствия
- 25. Принцип соответствия Согласно принципу соответствия, на диаграмме состояния системы каждой фазе соответствует часть плоскости – поле
- 26. Важнейшим методом физико-химического анализа является термический метод. Существует две разновидности термического анализа: Визуальный метод и метод
- 27. Визуальный метод применяется, если система состоит из прозрачных компонентов и температура не слишком низкая и не
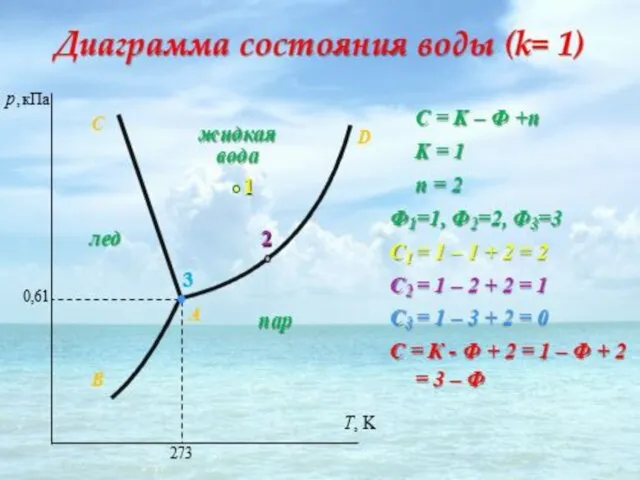
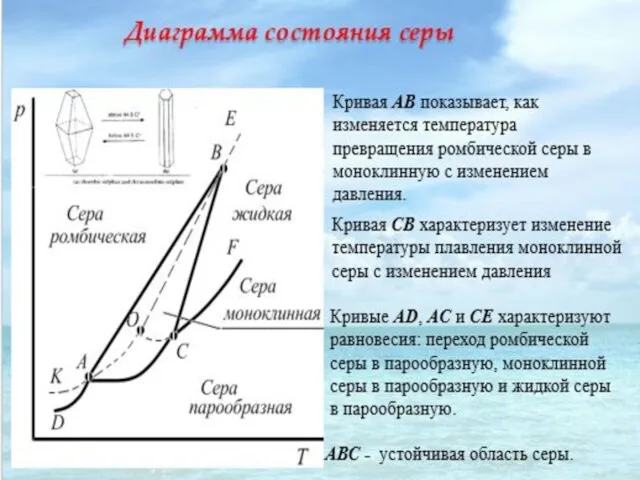
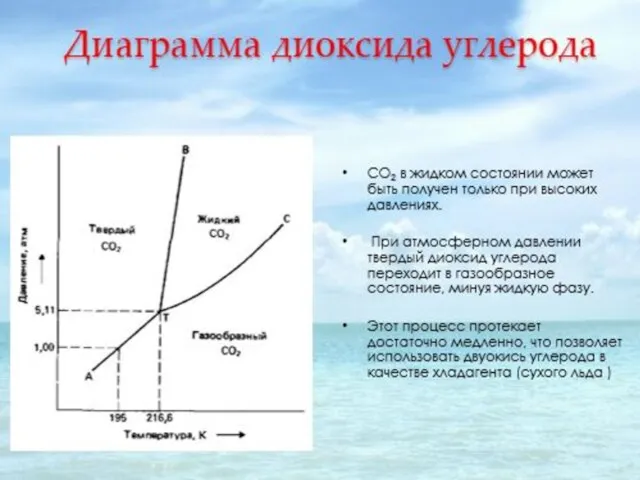
- 29. Примером однокомпонентной системы может служить простое вещество или химическое соединение, обладающее строго определенным составом во всех
- 34. Анализ на основе правила фаз Гиббса: Если фигуративная точка лежит в плоскости между линиями, то система
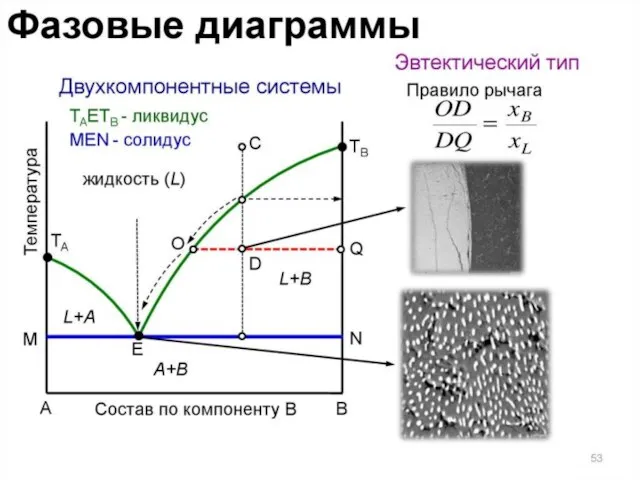
- 36. Линия ликвидуса (или линия жидкости) – линия, изображающая зависимость от состава температуры начала выделения из жидкой
- 37. Линии ao и bo называется линиями ликвидуса. Выше этих линий смесь находится в жидком состоянии, ниже
- 42. Экстракция — это процесс извлечения одного или нескольких веществ из сложных систем (жидких или твердых) селективным
- 44. Отношение равновесных концентраций вещества в органическом растворителе и в воде есть величина постоянная при данной температуре.
- 45. Уравнение Клаузиса-Клайперона Кривые на фазовой диаграмме описываются с помощью уравнения Клайперона–Клаузиуса. Каждый фазовый переход — процесс
- 46. ПРИМЕНЕНИЕ УРАВНЕНИЯ КЛАУЗИСА –КЛАЙПЕРОНА К РАВНОВЕСИЯМ Ж⇄Г,Т⇄Г При изучении процессов испарения и возгонки в первую очередь
- 47. ПРИМЕНЕНИЕ УРАВНЕНИЯ КЛАУЗИСА –КЛАЙПЕРОНА К РАВНОВЕСИЯМ Т⇄Ж В этом случае уравнение Клаузиса-Клайперона примет вид: ΔHпл>0, ΔТпл>0,
- 49. Скачать презентацию

































 Опыты Резерфорда. Ядерная модель атома
Опыты Резерфорда. Ядерная модель атома Двигатели WJ. Описание и эксплуатация идентификация двигателей
Двигатели WJ. Описание и эксплуатация идентификация двигателей Неньютоновская жидкость
Неньютоновская жидкость Устройство, работа, возможные неисправности системы охлаждения двигателя КамАЗ -740. ТО системы охлаждения
Устройство, работа, возможные неисправности системы охлаждения двигателя КамАЗ -740. ТО системы охлаждения физика
физика Фотометрия Бугера, Ламберта, Бера
Фотометрия Бугера, Ламберта, Бера Датчика изгиба (Роборука)
Датчика изгиба (Роборука) Дробилка безрешетная
Дробилка безрешетная Давление в твердых телах, жидкостях и газах
Давление в твердых телах, жидкостях и газах Электрооборудование троллейбуса
Электрооборудование троллейбуса Презентация на тему Радиоактивные отходы
Презентация на тему Радиоактивные отходы  Механические волны
Механические волны Внутренняя энергия идеального газа и степени свободы
Внутренняя энергия идеального газа и степени свободы Точка росы
Точка росы Відновлення працездатності засобами фізичної рекреації
Відновлення працездатності засобами фізичної рекреації Что и как изучает физика
Что и как изучает физика Учебное пособие Jatco 4 AТ
Учебное пособие Jatco 4 AТ График плавления и отвердевания кристаллических тел
График плавления и отвердевания кристаллических тел PITSTOP_05 Project Summary
PITSTOP_05 Project Summary Стенд для лабораторных работ Зубчатые передачи
Стенд для лабораторных работ Зубчатые передачи 11 класс
11 класс Отражение и преломление света
Отражение и преломление света Объяснение физических явлений
Объяснение физических явлений Потенциально-обратные двухполюсники и условия их взаимной обратимости
Потенциально-обратные двухполюсники и условия их взаимной обратимости Виды зубчатых передач
Виды зубчатых передач Ионизация воздуха
Ионизация воздуха Переходные процессы
Переходные процессы Презентация на тему Что изучает физика?
Презентация на тему Что изучает физика?