Слайд 2Ф.Энгельс писал:
« Жизнь есть способ существования белковых тел , существенным моментом которого является постоянный обмен веществ с окружающей их

внешней природой, причем с прекращением этого обмена веществ прекращается и жизнь , что приводит к разложению белка»
Слайд 3Введение:
Белки – природные высокомолекулярные азотосодержащие органические соединения. Они играют первостепенную роль во

всех жизненных процессах, являются носителями жизни. Белки содержатся во всех тканях организмов, в крови, в костях. Ферменты (энзимы), многие гормоны представляют собой сложные белки. Кожа, волосы, шерсть, перья, рога, копыта, кости, нити натурального шелка образованы белками. Белок, так же как углеводы и жиры, - важнейшая необходимая составная часть пищи.
Слайд 4Состав
В состав белков входят С, N2, H2, O2, и частично P, S,
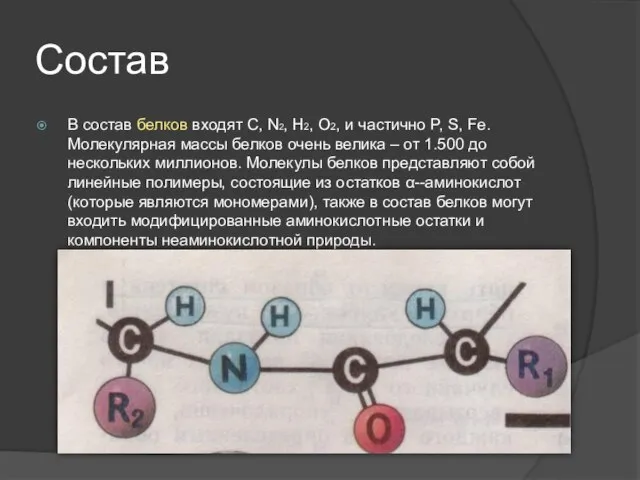
Fe. Молекулярная массы белков очень велика – от 1.500 до нескольких миллионов. Молекулы белков представляют собой линейные полимеры, состоящие из остатков α--аминокислот (которые являются мономерами), также в состав белков могут входить модифицированные аминокислотные остатки и компоненты неаминокислотной природы.
Слайд 5Проблема строения и синтеза белков – одна из важнейших в современной науке.

Установлено, что десятки, сотни и тысячи молекул аминокислот, образующих гигантские молекулы белков, соединяются друг с другом, выделяя воду за счет карбоксильных и аминогрупп.
H2N-CH-(R)-C(=O)-… H2N-CH-(R’)-C(=O)-… H2N-CH-(R”)-C(=O)-…
Слайд 6Арахис как чистый белок
Арахис содержит много белка, поэтому он очень питателен. Белки,

которые содержатся в арахисе, перевариваются в желудке и тонкой кишке под действием ферментов. Длинные цепи молекулы белка превращаются в более короткие цепи. Молекулы аминокислот теперь могут поглощаться организмом.
Слайд 7Знаете ли вы, что…
Актин и миозин – это белки, которые помогают наращивать

мышцы
Белковой молекулы в живой клетке в много раз больше, чем других (разумеется, кроме воды).
Слайд 8В молекулах белков многократно повторяются группы атомов –CO-NH- их называют амидными, или

в химии белков – пептидными группами. Соответственно белки относят к природным высокомолекулярных полиамидами или полипептидам.
Слайд 9Все многообразие белков образовано 20 различными аминокислотами; при том для каждого белка
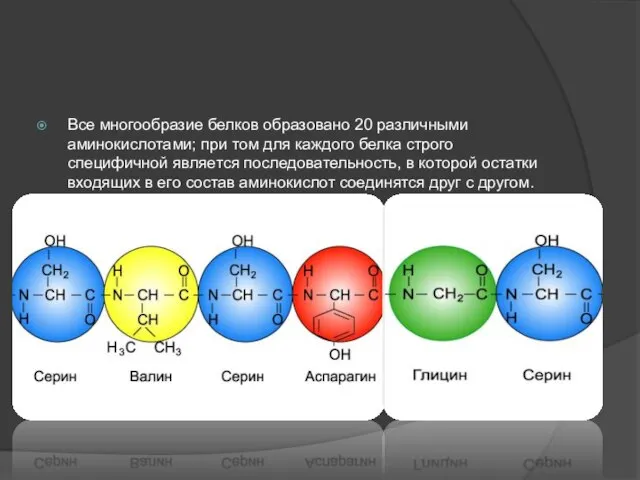
строго специфичной является последовательность, в которой остатки входящих в его состав аминокислот соединятся друг с другом.
Слайд 10Физические свойства
- высокая молекулярная масса
- в живых организмах белки находятся в
твердом и растворенном состоянии.
Встречаются в виде кристаллов на космическом станции «Мир».
- бывают растворимые и нерастворимые
(волосы, ногти)
- образовывают коллоидные растворы
Слайд 11Химически свойства
1. Денатурация. Денатурацией белка называют любые изменения в его биологической

активности и/или физико-химических свойствах, связанные с потерей четвертичной, третичной или вторичной структуры.
Слайд 12При денатурации белок теряет способность выполнять присущие ему в организме функции (отсюда
и название данного процесса: от лат. denaturare – «лишать природных свойств»). Денатурированные белки легче усваиваются организмом.
Слайд 132. Цветные реакции белка.
Например, при добавлении к белкам концентрированной азотной кислоты,

белки окрашиваются в ярко желтый цвет. Опыт доказывает, что в составе молекулы белка входят остатки ароматических аминокислот.
Слайд 14Другой пример:
Биуретовая реакция – взаимодействие слабощелочных растворов белков с раствором сульфата меди

(II), в результате которой появляется фиолетово-синяя окраска
Слайд 153. Гидролиз. При нагревании белков со щелочами или кислотами происходит гидролиз.

Слайд 16Виды гидролиза белка
- кислотный (используется для определения структуры белка)
- ферментативный (происходит

в желудке и кишечнике под действием пищеварительных фермнетов)
Слайд 18Структура белковой молекулы
Первичная вторичная третичная четвертичная
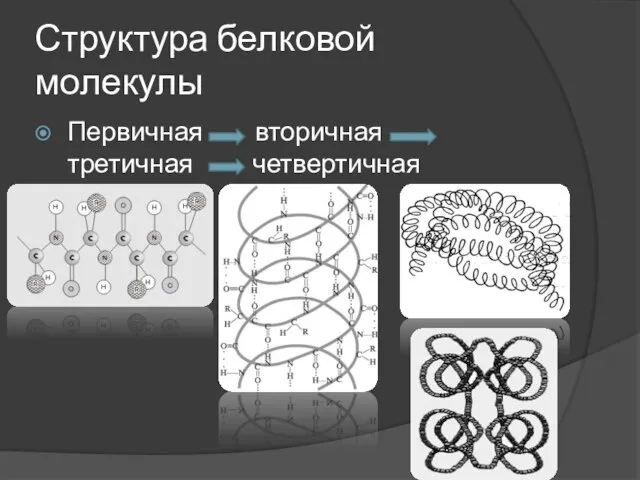
Слайд 19Первичная структура
Последовательность чередования аминокислотных остатков в полипептидной цепи.

Слайд 20Вторичная структура
Вторичная структура – пространственная
конфигурация полипептидной цепи, то есть ее

возможное расположение в пространстве.
Для белков наиболее часто
встречающимся вариантом вторичной
структуры является спираль.
Слайд 21Третичная структура
Третичная структура – трехмерная конфигурация, которую принимает в пространстве закрученная

спираль.
Третичной структурой объясняется специфичность белковой молекулы и ее биологическая активность.
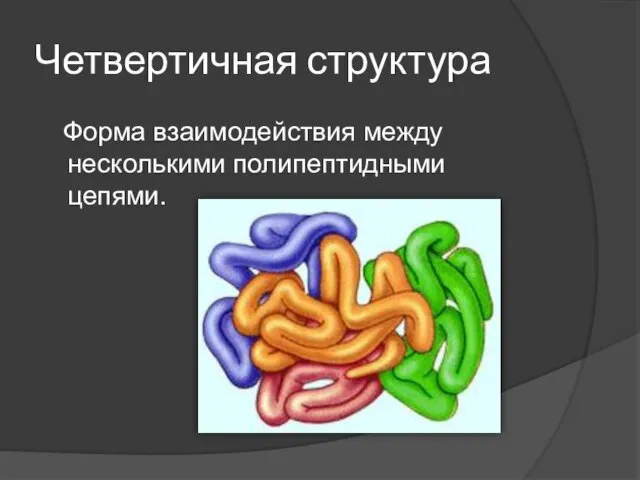
Слайд 22Четвертичная структура
Форма взаимодействия между несколькими полипептидными цепями.
Слайд 23Белки (от греч. «протос» - «первый») – это природные органические соединения, которые

обеспечивают все жизненные процессы любого организма. Из белков построен хрусталик глаза, паутина и даже яды грибов.
Слайд 24Казеин – один из главных белков
Белок казеин в молоке присутствует в

связанном виде – ковалентно присоединенные к аминокислоте фосфатные группы образуют соли с ионами кальция. В желудке человека под действием особых ферментов происходит процесс, называемый «створаживанием казеина». Створоженный казеин выпадает в осадок и медленно выводится из организма. Казеин очень питателен, ведь в его состав входит почти все аминокислоты. Казеин безвкусен, не растворим в воде.
Слайд 25Инсулин – важнейший белок для жизнедеятельности человека
Инсулин — это белок, образуемый бета-клетками

так называемых островков эндокринной части поджелудочной железы. Инсулин был открыт в 1921 году двумя канадскими учеными — Ф. Бантингом и Ч. Бестом. В 1923 г. это открытие было удостоено Нобелевской премии по медицине. За 90 лет, прошедших с момента этого поистине великого события, были усовершенствованы как препараты инсулина, так и средства для его введения.
Слайд 26Немного истории
Впервые белок был выделен (в виде клейковины) в 1728 г.

итальянцем Якопо Бартоломео Беккари (1682-1766) из пшеничной муки. Это событие принято считать рождением химии белка. С тех пор почти за три столетия из природных источников получены тысячи различных белков и исследованы их свойства.
Слайд 27Антуан Франсуа де Фуркруа – французский химик, основоположник изучения белка.

Слайд 28Первые пространственные
модели молекул белка –
миоглобина и гемоглобина –
построили в

конце 50-х гг.
двадцатого века английские
биохимики Джон Коудери
Кендрю и Макс Фердинанд
Перуц.
Слайд 29Белок – высшая форма развития органических веществ

Слайд 30 При полном расщеплении 1 грамма белка освобождается 17,6 кДж энергии.
1

г. белка 17,6 кДж Е





























 Алкадиены
Алкадиены Презентация на тему Ионные уравнения реакций (8 класс)
Презентация на тему Ионные уравнения реакций (8 класс)  Презентация на тему Нанохимия
Презентация на тему Нанохимия  Основные положения о строении вещества
Основные положения о строении вещества Окислительно-восстановительные реакции (ОВР)
Окислительно-восстановительные реакции (ОВР) Строение вещества. Виды химической связи
Строение вещества. Виды химической связи химия
химия Кристаллы и аморфные тела
Кристаллы и аморфные тела Chem-квест. Химический диктант
Chem-квест. Химический диктант Алифатические углеводороды
Алифатические углеводороды Основные классы неорганических соединений
Основные классы неорганических соединений Алкадиены: кумулированные, сопряженные, изолированные
Алкадиены: кумулированные, сопряженные, изолированные Электрохимия. Электролиты
Электрохимия. Электролиты Растворы. Растворение веществ. 8 класс
Растворы. Растворение веществ. 8 класс Химические средства защиты растений. Последствия применения пестицидов
Химические средства защиты растений. Последствия применения пестицидов Углеводы. Дисахариды. Полисахариды. Лекция 6
Углеводы. Дисахариды. Полисахариды. Лекция 6 Технические материалы. Металлические и неметаллические. (Тема 1)
Технические материалы. Металлические и неметаллические. (Тема 1) Выберите вещества
Выберите вещества Природные источники углеводородов. Нефть и природный газ, их применение. Полимеры
Природные источники углеводородов. Нефть и природный газ, их применение. Полимеры Химическая школа ДПИ НГТУ
Химическая школа ДПИ НГТУ Химия как наука. Краткая история развития химии. Значение химии
Химия как наука. Краткая история развития химии. Значение химии Стехиометрические законы
Стехиометрические законы Неорганические вещества
Неорганические вещества Химия и производство
Химия и производство Анализ спорных ситуаций при оценивании заданий с развернутым ответом. Химия
Анализ спорных ситуаций при оценивании заданий с развернутым ответом. Химия Аминокислоты и белки. Химия
Аминокислоты и белки. Химия Мыло. Синтетические моющие средства
Мыло. Синтетические моющие средства Свойства оксидов. Тест с подсказками. 8 класс
Свойства оксидов. Тест с подсказками. 8 класс