Содержание
- 2. Учителя химии: Гершановская Евгения Владимировна ГБОУ СОШ № 880 Город Москва Попова Светлана Анатольевна ГБОУ СОШ
- 3. СОДЕРЖАНИЕ Ученые, получившие алюминий Характеристика элемента - алюминия Нахождение в природе Физические свойства Химические свойства Применение
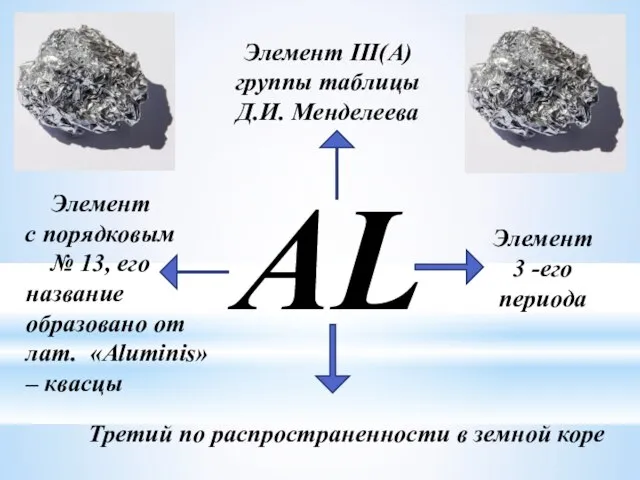
- 4. AL Элемент III(A) группы таблицы Д.И. Менделеева Элемент с порядковым № 13, его Элемент 3 -его
- 5. Датский физик Ганс Эрстед (1777-1851) Впервые алюминий был получен им в 1825 году действием амальгамы калия
- 6. Современное получение алюминия Современные метод получения был разработан независимо друг от друга: американцем Чарльзом Холлом и
- 7. Будучи студентом Оберлинского колледжа, он узнал, что можно разбогатеть и получить благодарность человечества, если изобрести способ
- 8. Поль Эру (1863-1914) – французский инженер - химик В 1889 году открыл алюминиевый завод во Фроне
- 9. Нахождение в природе Важнейшим на сегодня минералом алюминия является боксит Основной химический компонент боксита - глинозем
- 10. Физические свойства мягкий легкий (с малой плотностью – 2,7 г/см3) с высокой тепло- и электропроводностью легкоплавкий
- 11. с серой, образуя сульфид алюминия: 2Al + 3S = Al2S3 с азотом, образуя нитрид алюминия: 2Al
- 12. Химические свойства 1. с водой (после удаления защитной оксидной пленки) 2Al + 6H2O = 2Al(OH)3 +
- 13. ПРИМЕНЕНИЕ АЛЮМИНИЯ Легкий сплав дюраль используется в различных областях В Авиации В Космической технике В Электротехнике
- 14. Соединения алюминия Оксид алюминия (AL2O3) Гидроксид алюминия AL(OH)3
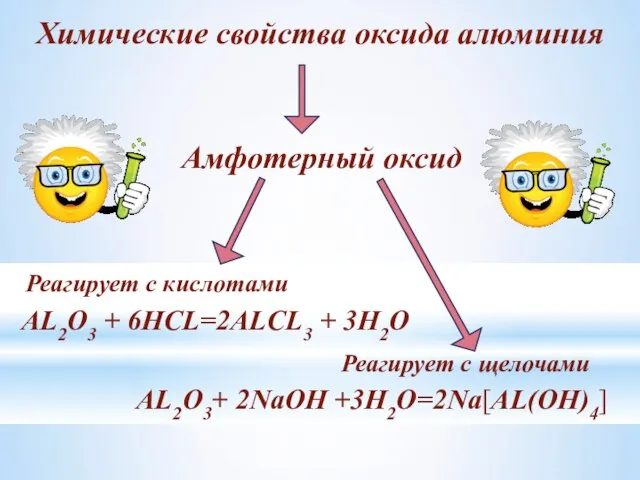
- 15. Химические свойства оксида алюминия Амфотерный оксид Реагирует с кислотами Реагирует с щелочами AL2O3 + 6HCL=2ALCL3 +
- 16. AL2O3 Глинозём Корунд сапфир рубин Боксит
- 17. Применение сапфиров знаменитые сапфиры английской королевской семьи
- 18. Применение рубинов
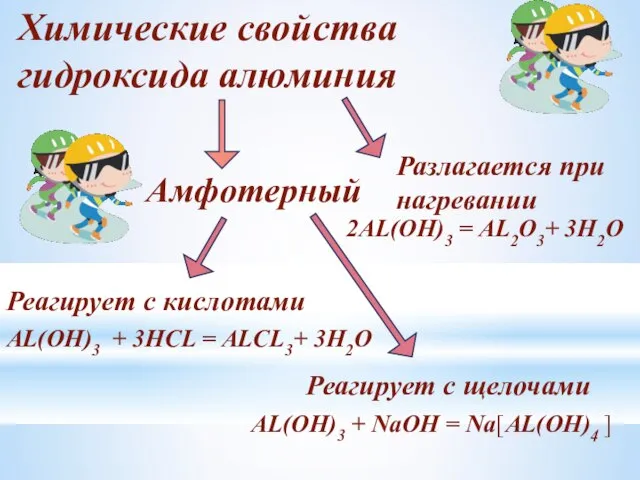
- 19. Химические свойства гидроксида алюминия Амфотерный Реагирует с кислотами Реагирует с щелочами AL(OH)3 + 3HCL = ALCL3+
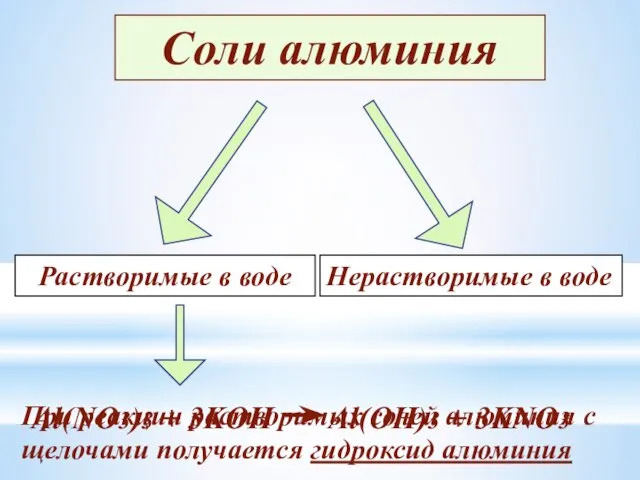
- 20. Соли алюминия Растворимые в воде Нерастворимые в воде При реакции растворимых солей алюминия с щелочами получается
- 21. Вставьте пропущенные слова в текст: Проверьте себя: Алюминий – это металл, у которого в соединениях степень
- 22. Какие из соединений вступят в реакцию с алюминием: Cl2 K2O CuSO4 H2O S BaSO4 HCL Cr
- 24. Скачать презентацию
















 Степень окисления
Степень окисления Электролит
Электролит Chemia kosmetyczna
Chemia kosmetyczna Сложные неорганические вещества
Сложные неорганические вещества Подготовка к итоговой контрольной работе
Подготовка к итоговой контрольной работе Основы химической термодинамики
Основы химической термодинамики Химические свойства оксидов
Химические свойства оксидов Азотистые основания. Нуклеозиды. Нуклеотиды. Нуклеиновые кислоты. Лекция 7
Азотистые основания. Нуклеозиды. Нуклеотиды. Нуклеиновые кислоты. Лекция 7 Турнир Деда Мороза. Викторина по химии
Турнир Деда Мороза. Викторина по химии Степень окисления (СО) – § 18
Степень окисления (СО) – § 18 Презентация на тему Движение электрона в атоме
Презентация на тему Движение электрона в атоме  Выполнил ученик 9-го класса Сенов Виктор 2007-2008уч.год
Выполнил ученик 9-го класса Сенов Виктор 2007-2008уч.год Материаловедение. Деформация и разрушение материалов. (Тема 4)
Материаловедение. Деформация и разрушение материалов. (Тема 4) Химическое вещество золото
Химическое вещество золото Металлическая химическая связь
Металлическая химическая связь Предельные углеводороды
Предельные углеводороды Способы выражения концентраций растворов
Способы выражения концентраций растворов Алкадиены: кумулированные, сопряженные, изолированные
Алкадиены: кумулированные, сопряженные, изолированные Технологии получения и преобразования текстильных материалов. Синтетические волокна (9 класс)
Технологии получения и преобразования текстильных материалов. Синтетические волокна (9 класс) Алканы
Алканы Модель атома
Модель атома Основные соединения кальция и их применение – вчера, сегодня, завтра.
Основные соединения кальция и их применение – вчера, сегодня, завтра. Вода. Строение молекулы. Водородная связь. Физические и химические свойства
Вода. Строение молекулы. Водородная связь. Физические и химические свойства Исследование зависимости интенсивности люминесценции пленок оксида цинка от уровня фотовозбуждения
Исследование зависимости интенсивности люминесценции пленок оксида цинка от уровня фотовозбуждения Простые и сложные вещества
Простые и сложные вещества Презентация на тему Алканы (10 класс)
Презентация на тему Алканы (10 класс)  Гидролиз солей
Гидролиз солей Понятие биотехнологии
Понятие биотехнологии