Содержание
- 2. « АТОМЫ ХИМИЧЕСКИХ ЭЛЕМЕНТОВ» ОБОБЩАЮЩИЙ УРОК Презентация составлена учителем химии МБОУ Вадьковская СОШ Живанковой Н.В.
- 3. Цели: Повторить, обобщить и систематизировать сведения о строении атома, структуре периодической таблицы и периодичности свойств атомов
- 4. КОМАНДА «АТОМ» КОМАНДА «МОЛЕКУЛА»
- 5. Станция «Строение атома»
- 6. Разновидности атомов одного и того же химического элемента, имеющие одинаковый заряд ядра, но разное массовое число
- 7. Задание№1. Для атома фосфора определить чему равен заряд ядра, число электронов, протонов, нейтронов. Задание №2. Запишите
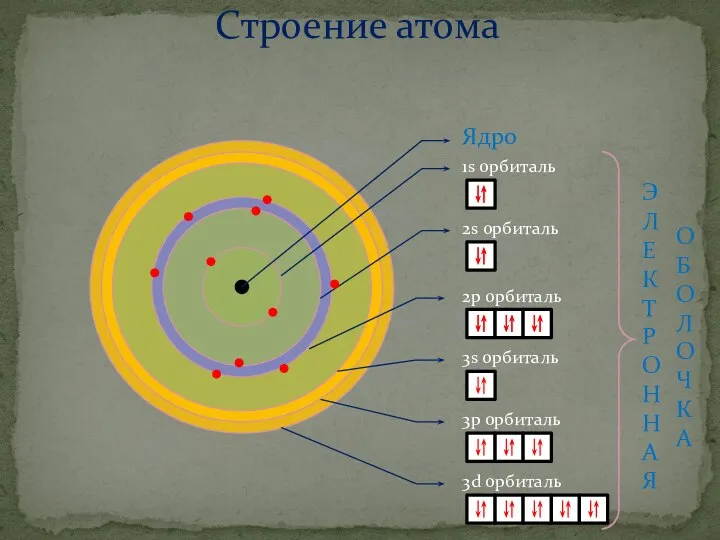
- 8. Строение атома Ядро 1s орбиталь 2s орбиталь 2p орбиталь 3s орбиталь 3p орбиталь 3d орбиталь Э
- 9. Распределение электронов по энергетическим уровням. Составление электронных схем Номер периода совпадает с числом энергетических уровней элемента.
- 10. Станция: «Периодическая система химических элементов Д.И.Менделеева и строение атома»
- 11. Задание№1. Расположите элементы в порядке увеличения их металлических свойств: Sr, Mg, Ca, Ba. Кто является самым
- 12. Увеличиваются заряды атомных ядер; Число электронов на внешнем энергетическом уровне остаётся неизменным; Увеличивается число энергетических уровней;
- 13. Увеличиваются заряды атомных ядер; Увеличивается число электронов на внешнем энергетическом уровне; Число энергетических уровней постоянно; Радиус
- 14. Станция «Химическая связь»
- 15. ЗАДАНИЯ -Запишите механизм образования ковалентной неполярной связи для O2 -Запишите механизм образования металлической связи для Mg
- 16. Ионы и ионная химическая связь. Химическая связь, образующуюся между ионами, называется ионной. Ион – это частица
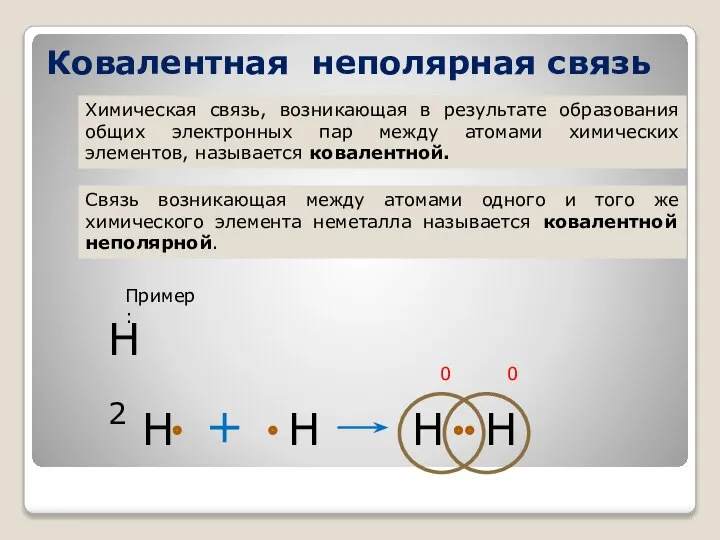
- 17. Ковалентная неполярная связь Химическая связь, возникающая в результате образования общих электронных пар между атомами химических элементов,
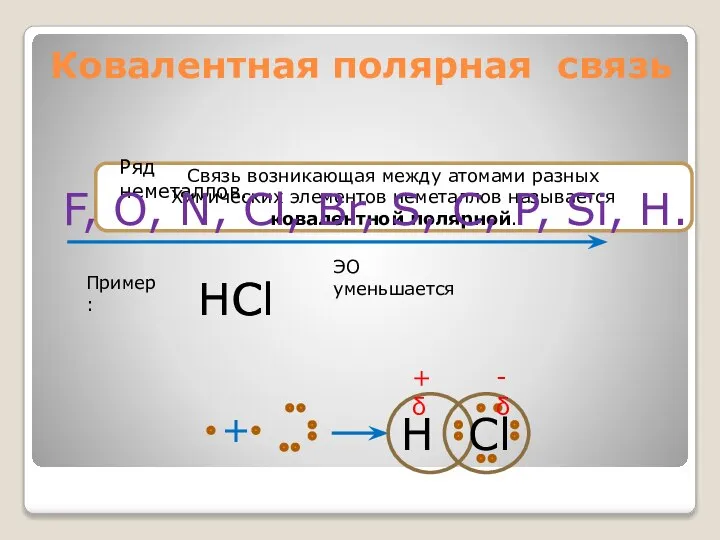
- 18. Ковалентная полярная связь Связь возникающая между атомами разных Химических элементов неметаллов называется ковалентной полярной. Ряд неметаллов.
- 19. МЕТАЛЛИЧЕСКАЯ СВЯЗЬ Металлическая связь- это связь возникающая в металлах между ионами и атомами посредством обобществлённых электронов.
- 20. Станция: «Периодическая система химических элементов Д.И.Менделеева и строение атома» Станция «Строение атома» Станция «Химическая связь
- 21. Задачи: - отработать навыки владения «химическим языком» - уметь определять число электронов, протонов, нейтронов в атомах
- 23. Скачать презентацию

















 Кислород
Кислород Промышленное получение аминокислот и их применение в медицине и диетологии
Промышленное получение аминокислот и их применение в медицине и диетологии Тестовая работа по теме: Реакции ионного обмена. Химия. 9 класс
Тестовая работа по теме: Реакции ионного обмена. Химия. 9 класс Деформация полимеров
Деформация полимеров Окислительно-восстановительные реакции
Окислительно-восстановительные реакции Внутренняя среда организма. Система крови. Физико-химические свойства крови
Внутренняя среда организма. Система крови. Физико-химические свойства крови Флотационный способ обогащения
Флотационный способ обогащения Неорганическая и органическая химия
Неорганическая и органическая химия Консультация по химии
Консультация по химии Изомерия
Изомерия Произведение растворимости
Произведение растворимости Химические соединения в живых организмах. Неорганические вещества
Химические соединения в живых организмах. Неорганические вещества Дифференцированный подход в преподавании химии
Дифференцированный подход в преподавании химии Основания
Основания Приходченко ФЕР-2031
Приходченко ФЕР-2031 Процессы подготовки горючих ископаемых к переработке. Лекция № 2
Процессы подготовки горючих ископаемых к переработке. Лекция № 2 Учебник системы учебно-методических комплектов Алгоритм успеха
Учебник системы учебно-методических комплектов Алгоритм успеха Органические соединения
Органические соединения Строение сложного фермента
Строение сложного фермента Окислительно-восстановительные реакции
Окислительно-восстановительные реакции Белки. Структуры белков
Белки. Структуры белков Современные сплавы на основе циркония
Современные сплавы на основе циркония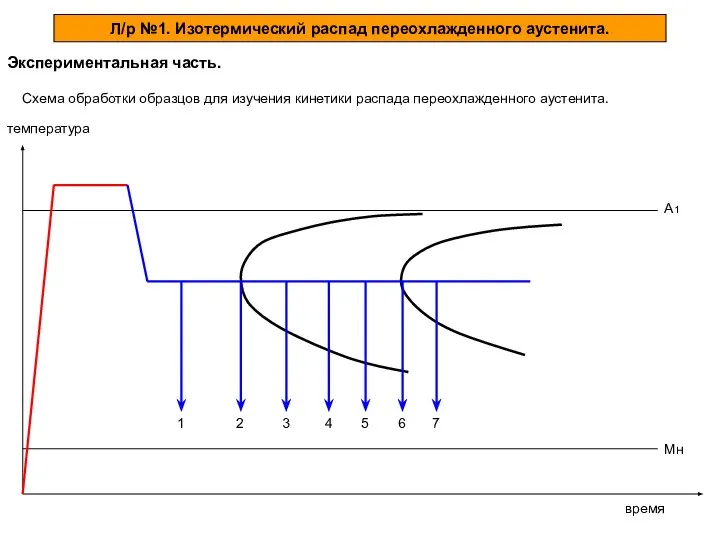 Изотермический распад переохлажденного аустенита. Экспериментальная часть
Изотермический распад переохлажденного аустенита. Экспериментальная часть Алкены
Алкены Цикл фосфора (окончание). Цикл в реках и в море
Цикл фосфора (окончание). Цикл в реках и в море Reshenie_zadach
Reshenie_zadach Салқындатқыш агенттер және оларды салқындату әдістері
Салқындатқыш агенттер және оларды салқындату әдістері Химия в жизни человека
Химия в жизни человека