Содержание
- 2. Окислительно-восстановительное титрование - группа титриметрических методов анализа, основанных на использовании окислительно-восстановительных реакций. Red1+Ox2=Ox1+Red2 Метод - фармакопейный,
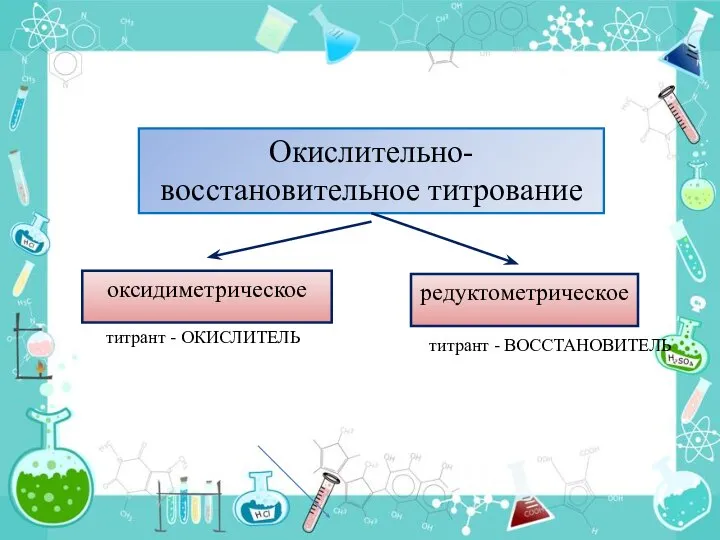
- 3. оксидиметрическое редуктометрическое титрант - ОКИСЛИТЕЛЬ титрант - ВОССТАНОВИТЕЛЬ Окислительно-восстановительное титрование
- 4. - вещества, используемые в качестве титрантов в окислительно-восстановительном титровании должны быть сильными окислителями и восстановителями, -
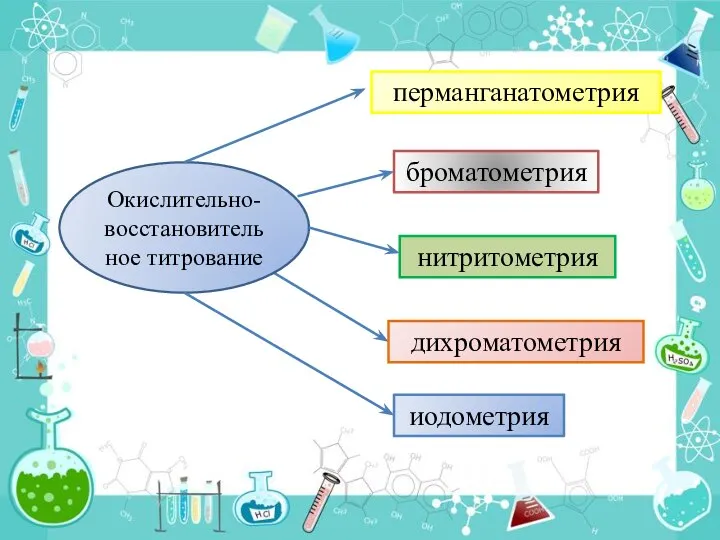
- 5. перманганатометрия броматометрия нитритометрия иодометрия дихроматометрия Окислительно-восстановительное титрование
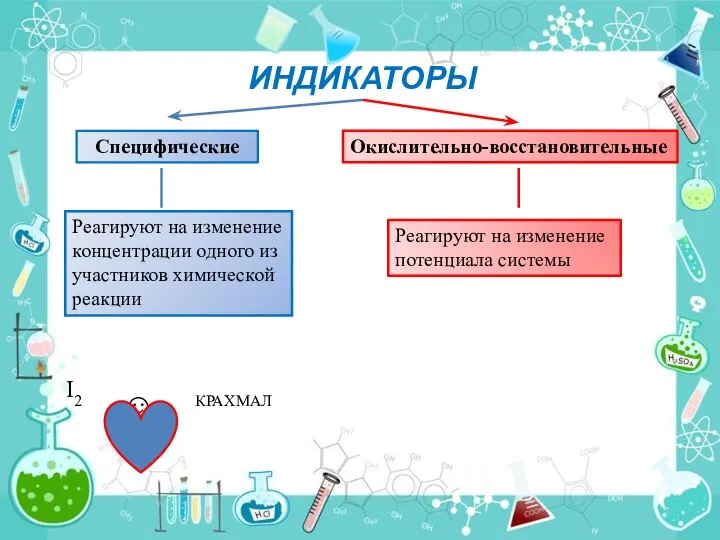
- 6. ИНДИКАТОРЫ Специфические Окислительно-восстановительные Реагируют на изменение концентрации одного из участников химической реакции Реагируют на изменение потенциала
- 7. Окислительно-восстановительные индикаторы - вещества, способные окисляться или восстанавливаться с изменением окраски в точке эквивалентности либо вблизи
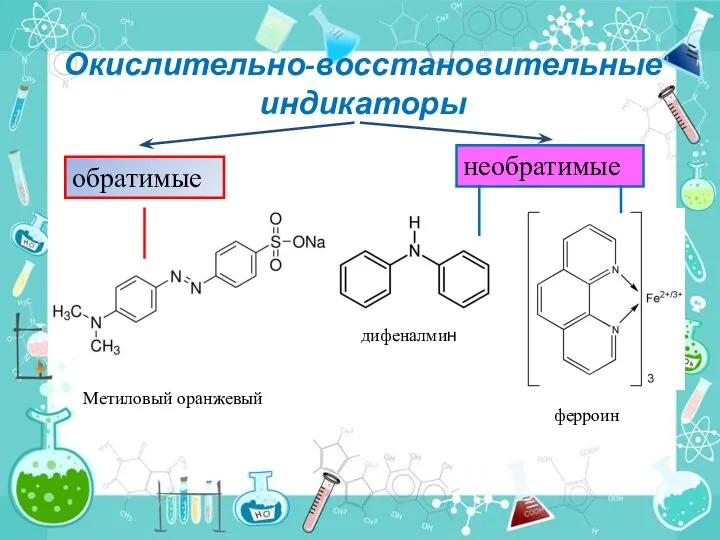
- 8. Окислительно-восстановительные индикаторы обратимые необратимые дифеналмин ферроин Метиловый оранжевый
- 9. Перманганатометрия
- 10. ТИТРАНТ перманганатометрического титрования Вторичный стандартный раствор (раствор с установочным титром) 0,1 моль/л KMnO4 Первичные стандартные растворы
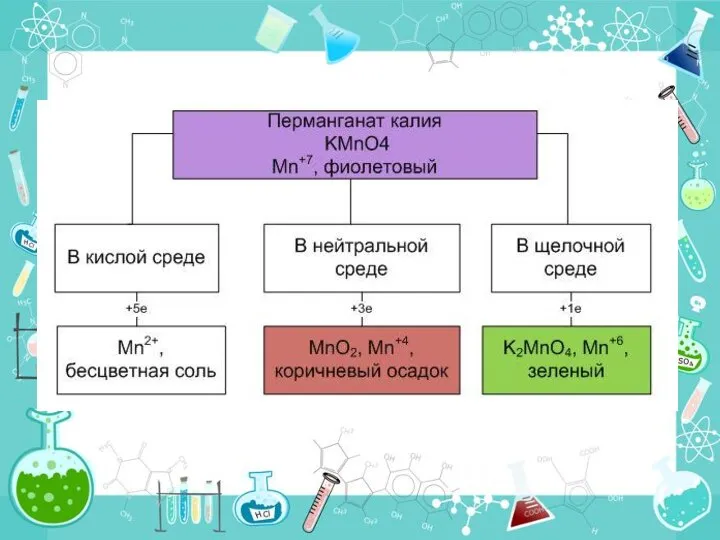
- 12. В зависимости от среды KMnO4 восстанавливается до различных конечных продуктов ! В кислой среде ионы MnO4–→
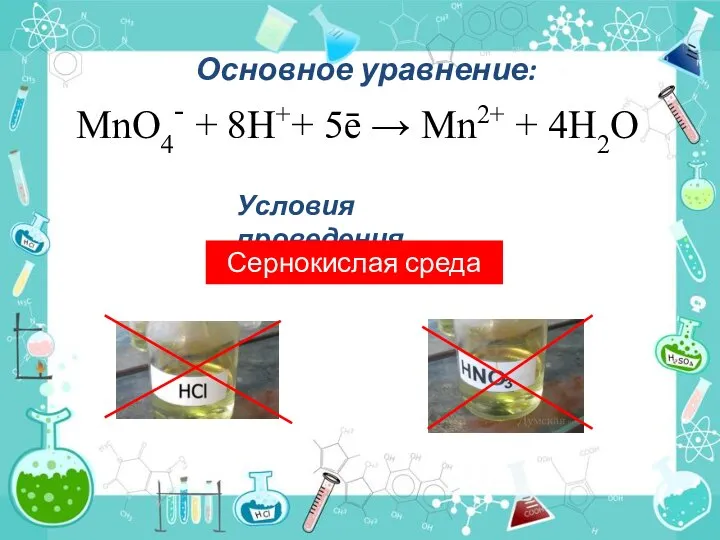
- 13. Основное уравнение: МnО4- + 8Н++ 5ē → Мn2+ + 4Н2О Условия проведения Сернокислая среда
- 14. ионы МnО4- восстанавливаются до бесцветных ионов Мn2+ МnО4- + 8Н++ 5ē → Мn2+ + 4Н2О
- 15. Точка эквивалентности В момент, когда в растворе не останется восстановителя, от прибавления одной капли КМnО4 титруемая
- 16. Условия проведения Влияние температуры - чаще всего при комнатной температуре, исключение реакция перманганат-иона с щавелевой кислотой
- 17. Используемые в работе растворы KMnO4 интенсивно окрашены, поэтому отсчёты показаний по шкале бюретки делают по верхнему
- 18. Титрованный раствор перманганата калия КМnО4 по точной навеске приготовить нельзя т.к. содержит примеси (чаще всего МnО2);
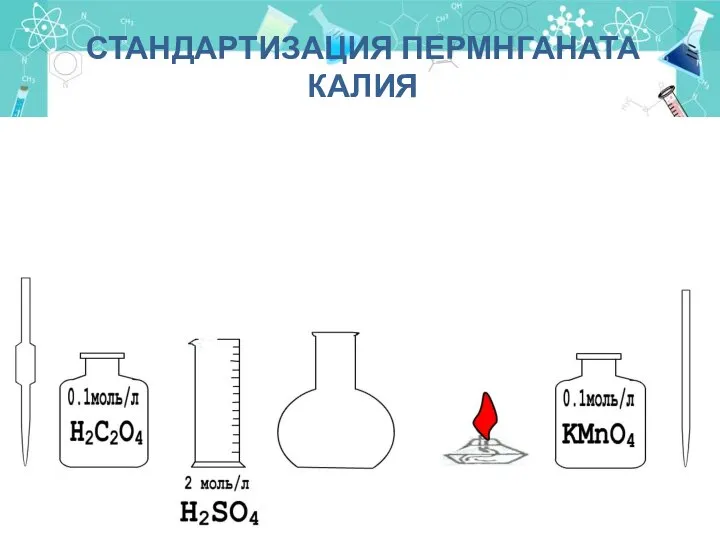
- 19. СТАНДАРТИЗАЦИЯ ПЕРМНГАНАТА КАЛИЯ Первичный стандартный раствор- щавелевая кислота Н2С2О4 ⋅ 2H2O При титровании протекает следующая реакция:
- 20. СТАНДАРТИЗАЦИЯ ПЕРМНГАНАТА КАЛИЯ
- 22. Применение: для определения веществ, играющих по отношению к перманганат-иону роль восстановителей (H2O2, MgO2, металлическое железо и
- 23. Иодометрия
- 24. Иодометрическое титрование - титриметрический метод анализа, основанный на определении количества иода, затраченного для реакции с веществом,
- 25. В основе метода лежит реакция 2I- ˗ 2е→I20 I20+2е→2I- Иодометрическое титрование окислитель восстановитель
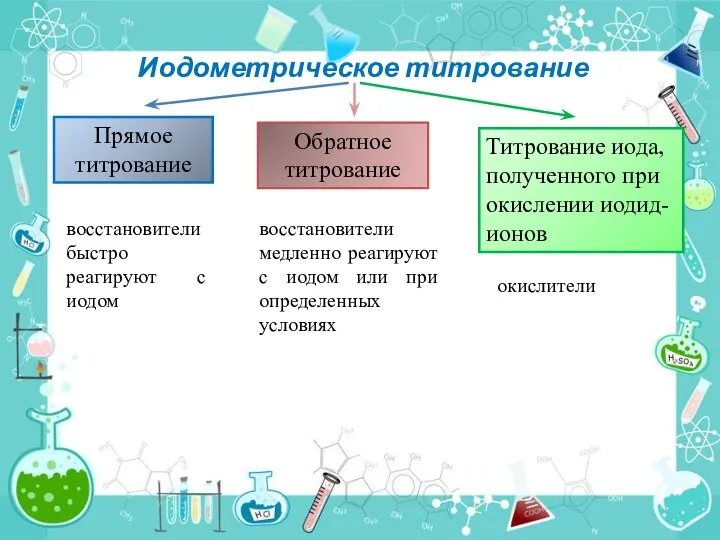
- 26. Иодометрическое титрование Прямое титрование Обратное титрование Титрование иода, полученного при окислении иодид-ионов восстановители быстро реагируют с
- 27. Титрант I2 0,1 моль/л Na2S2O3 ∙5H2O 0,1 моль/л Кристаллический йод малорастворим в воде. Поэтому обычно применяют
- 28. ТИТРАНТЫ иодометрического титрования Вторичный стандартный раствор (раствор с установочным титром) I2 0,1 моль/л Na2S2O3 ∙5H2O 0,1
- 29. Индикатор свежеприготовленный 1% раствор крахмала Чувствительность реакции иода с крахмалом уменьшается при нагревании раствора. Вследствие гидролиза
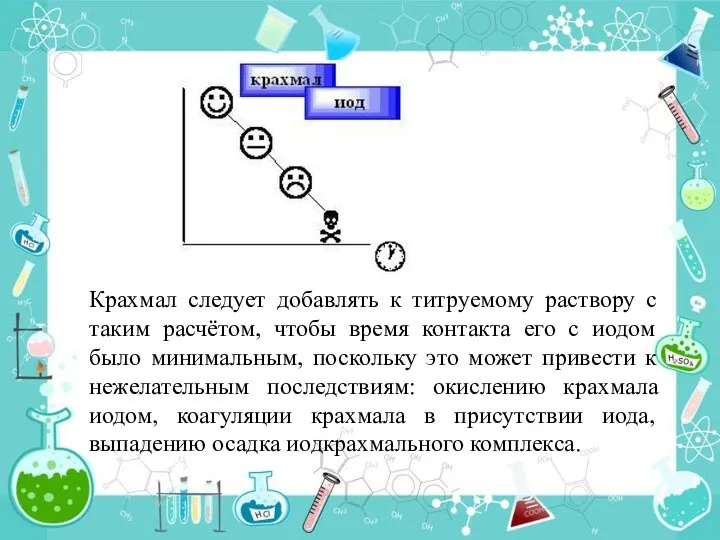
- 30. . Крахмал следует добавлять к титруемому раствору с таким расчётом, чтобы время контакта его с иодом
- 31. Обнаружение конечной точки титрования если в титруемом растворе содержится иод то крахмал следует добавлять незадолго до
- 32. Обнаружение конечной точки титрования В случае прямого титрования раствором иода крахмал добавляют в начале титрования. О
- 33. Условия проведения: 1) Чтобы реакция между окислителем и иодидом калия протекала практически до конца, ее нужно
- 34. Условия проведения: 2) Титрование ведут на холоду, так как при нагревании йод может частично улетучиться, а
- 35. Условия проведения: 3) При определении окислителя необходимо применять значительный избыток иодида калия. Растворимость иода в воде
- 36. Условия проведения: 4) Скорость реакции между иодидом калия и окислителем недостаточно велика, поэтому к титрованию выделившегося
- 37. Условия проведения: 5) При стоянии перед началом титрования реакционную смесь необходимо сохранять в затемненном месте, так
- 38. Титрованный раствор тиосульфата натрия Na2S2O3 по точной навеске приготовить нельзя т.к. - разлагается под действием микроорганизмов;
- 39. Установочным веществом служит дихромат калия К2Сг2О7 0,1моль/л При титровании протекает следующая реакция: К2Сг2О7 + 6KI +
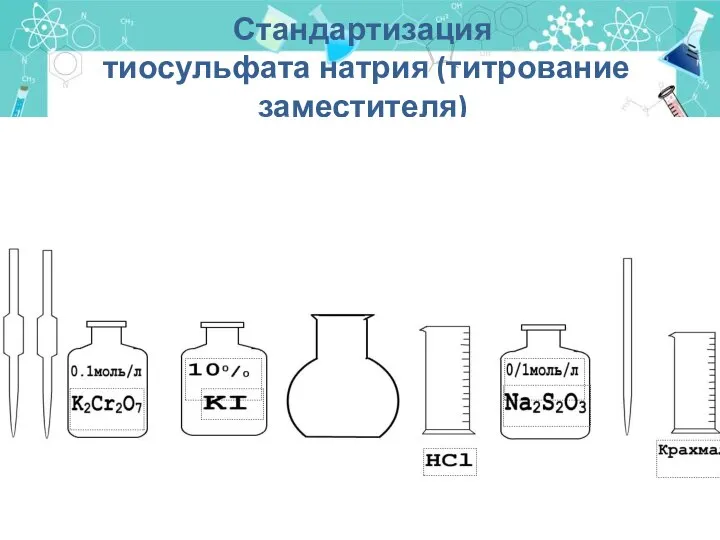
- 40. Стандартизация тиосульфата натрия (титрование заместителя)
- 42. Применение Методом йодометри можно определять те окислители, которые количественно окисляют I- в свободный I2. Чаще всего
- 44. Скачать презентацию































 Презентация на тему Вещества и их свойства
Презентация на тему Вещества и их свойства  Валентность
Валентность Роль химии в Великой Отечественной войне
Роль химии в Великой Отечественной войне Материаловедение. Адсорбционные материалы. Металлоорганические каркасы
Материаловедение. Адсорбционные материалы. Металлоорганические каркасы Моделирование деформаций углеродных слоёв при функционализации технического углерода
Моделирование деформаций углеродных слоёв при функционализации технического углерода Обобщение темы Органические вещества. Классификация органических веществ по углеродному скелету
Обобщение темы Органические вещества. Классификация органических веществ по углеродному скелету Жиры. 10 класс
Жиры. 10 класс Степень окисления. Составление формул бинарных соединений
Степень окисления. Составление формул бинарных соединений Спирт и его влияние на организм человека
Спирт и его влияние на организм человека Алканы. Зачетная работа
Алканы. Зачетная работа Чугуны
Чугуны Дивный мир турмалинов
Дивный мир турмалинов Металлы побочных подгрупп
Металлы побочных подгрупп Полимерные материалы
Полимерные материалы Техника безопасности (3)
Техника безопасности (3) Комплексонометрическое титрование. 5 лекция. Часть 2
Комплексонометрическое титрование. 5 лекция. Часть 2 Концентрации растворов и эквиваленты веществ
Концентрации растворов и эквиваленты веществ Круговорот азота
Круговорот азота Структура електронної оболонки атома. Енергетичні рівні та підрівні
Структура електронної оболонки атома. Енергетичні рівні та підрівні Вторичная переработка нефти. Риформинг
Вторичная переработка нефти. Риформинг Кинетика химических реакций и химическое равновесие. Лекция №4
Кинетика химических реакций и химическое равновесие. Лекция №4 Алкены (этиленовые углеводороды)
Алкены (этиленовые углеводороды) Учебник системы учебно-методических комплектов Алгоритм успеха
Учебник системы учебно-методических комплектов Алгоритм успеха Соли
Соли Хромофорная теория кислотно-основных индикаторов
Хромофорная теория кислотно-основных индикаторов Спирты
Спирты Поликарбонат мономерлері
Поликарбонат мономерлері Соли азотной кислоты- нитраты
Соли азотной кислоты- нитраты