Содержание
- 3. Все вещества по отношению к элект- рическому току можно разделить на : их растворы или расплавы
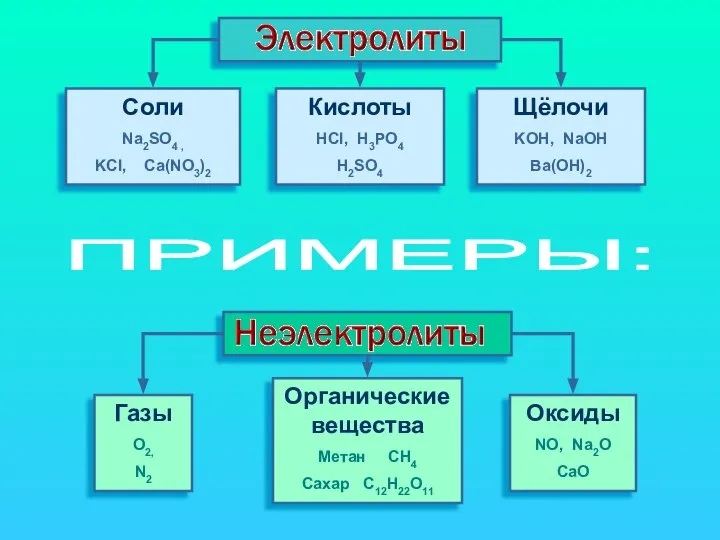
- 4. Cоли Na2SO4 , KCl, Ca(NO3)2 Кислоты HCl, H3PO4 H2SO4 Щёлочи KOH, NaOH Ba(OH)2 Газы O2, N2
- 5. Процесс появления гидратированных ионов в водном растворе называется электролитической диссоциацией (С. Аррениус, 1887 г.) .
- 7. Все вещества по их способности проводить электрический ток в растворах или расплавах делятся на электролиты и
- 8. В растворах электролиты диссоциируют ( распадаются) на положительные и отрицательные ионы. Процесс распада электролита на ионы
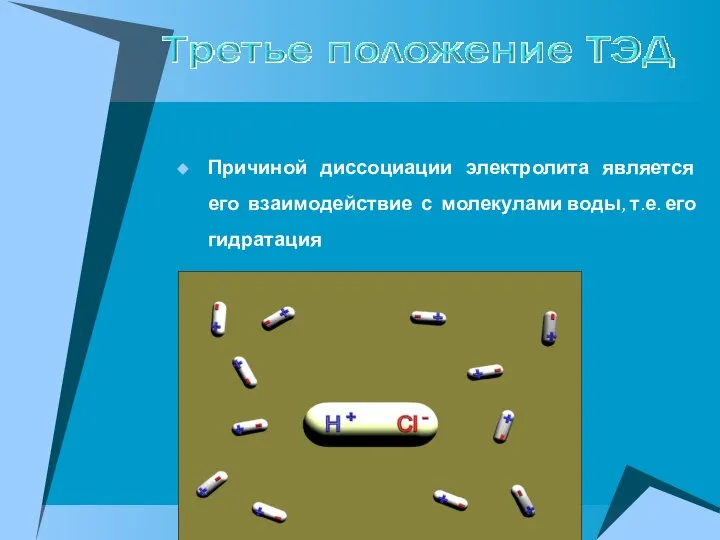
- 9. Причиной диссоциации электролита является его взаимодействие с молекулами воды, т.е. его гидратация
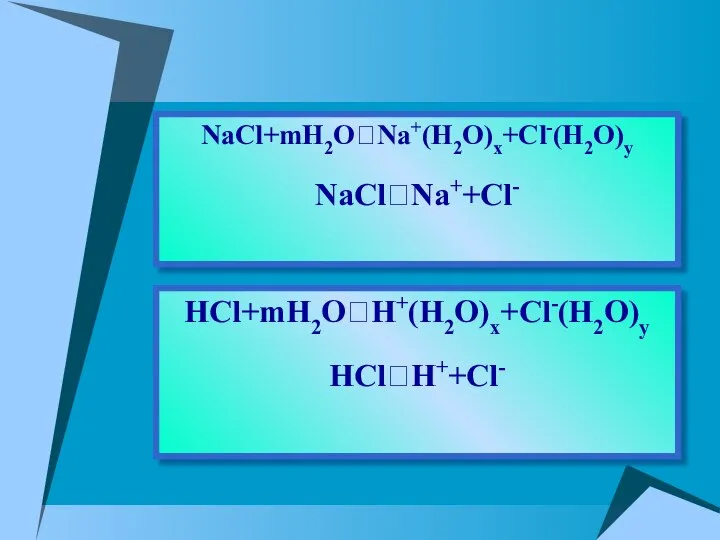
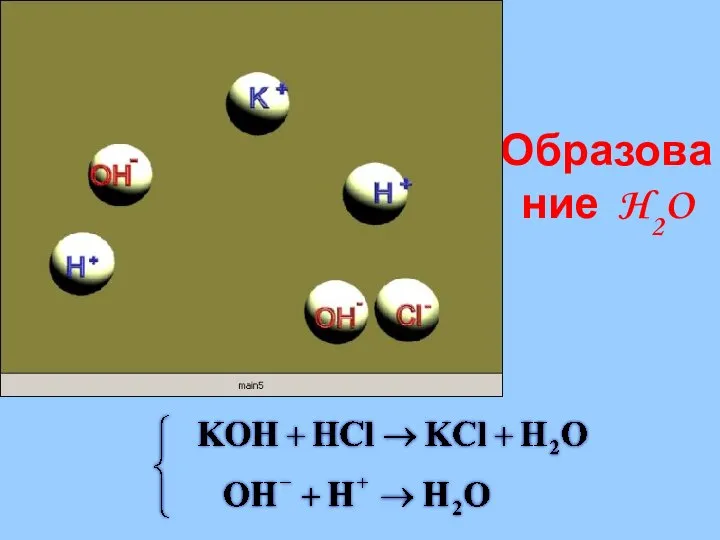
- 10. HCl+mH2O⮀H+(H2O)x+Cl-(H2O)y HCl⮀H++Cl- NaCl+mH2O⮀Na+(H2O)x+Cl-(H2O)y NaCl⮀Na++Cl-
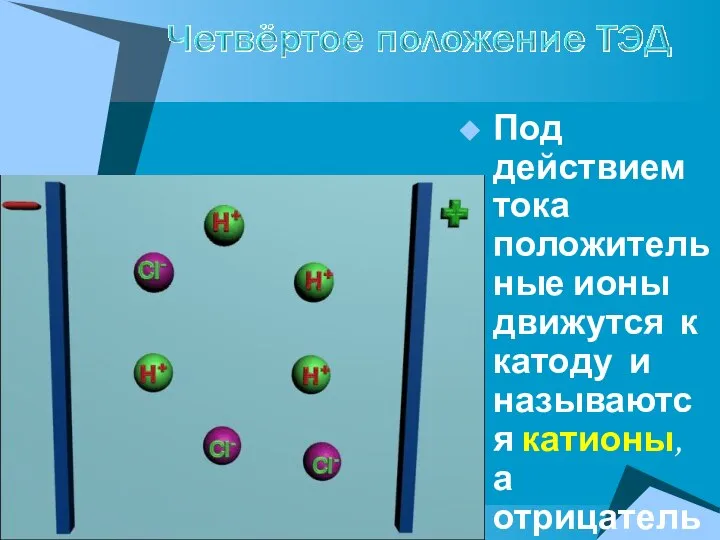
- 11. Под действием тока положительные ионы движутся к катоду и называются катионы, а отрицательные – к аноду
- 12. Не все электролиты в одинаковой мере диссоциируют на ионы КЛАССИФИКАЦИЯ ЭЛЕКТРОЛИТОВ
- 13. - степень электролитической диссоциации n – число молекул, которые распались на ионы в растворе N –
- 14. Сильные электролиты α > 30% Средние водорастворимые соли NaCl, K2SO4, Ba(NO3)2 и т д; Гидроксиды щелочных
- 15. Электролиты средней силы 3% ≤ α ≤ 30% H3PO3, H3PO4, H4P2O7, H2SO3, HF, HClO2, Fe(OH)2,
- 16. Слабые электролиты α Органические кислоты: HCOOH, CH3COOH, C2H5COOH Минеральные кислоты: HNO2, HClO, H2CO3, H2SiO3, H3BO3, H3PO3,
- 17. Свойства растворов электролитов определяются свойствами тех ионов, которые они образуют при диссоциации.
- 18. Классы неоргани-ческих веществ с точки зрения ТЭД
- 19. С точки зрения ТЭД, кислотами называются электролиты, которые в водном растворе диссоциируют на ионы водорода и
- 20. HCl = H+ + Cl- HNO3 = H+ + NO3- HClO4 = H+ + ClO4- Кислоты
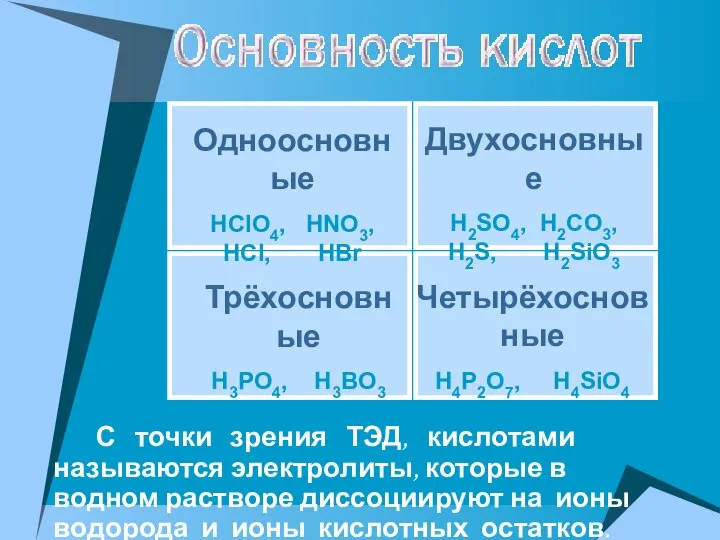
- 21. Многоосновные кислоты диссоциируют ступенчато. Каждая последующая степень протекает хуже предыдущей. Сильный электролит H2SO4⮀H++ HSO4-α1 HSO4 -
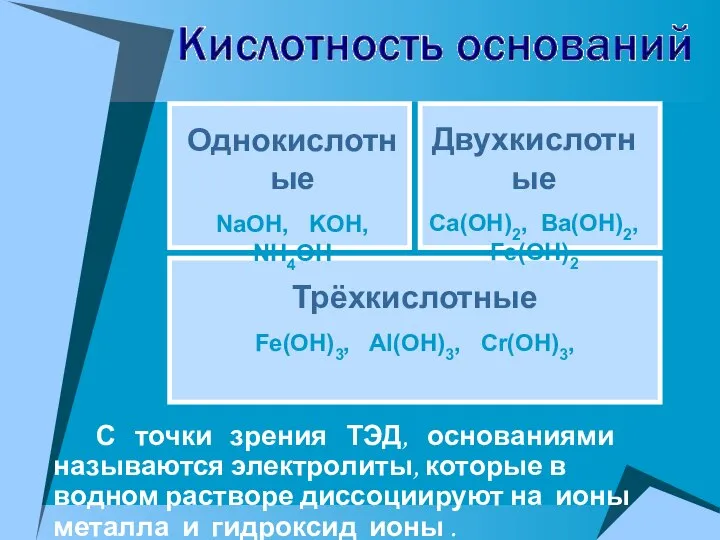
- 22. С точки зрения ТЭД, основаниями называются электролиты, которые в водном растворе диссоциируют на ионы металла и
- 23. NaOH = Na+ + OH- Ba(OH)2 = BaOH+ + OH- → Ba2+ + 2OH- KOH =
- 24. Соли – это электролиты, которые диссоциируют на катионы металла или аммония NH4+ и анионы кислотных остатков.
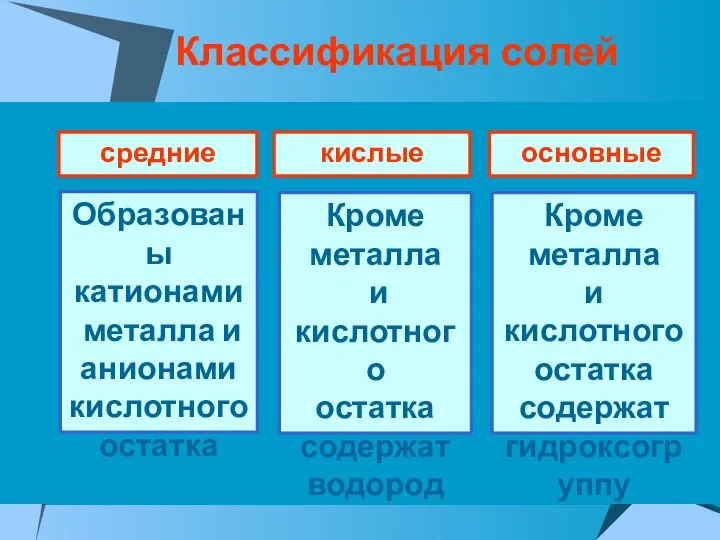
- 25. Классификация солей средние кислые основные Образованы катионами металла и анионами кислотного остатка Кроме металла и кислотного
- 26. Na2SO4 = 2Na+ + SO42- AlCl3 = Al3+ + 3Cl- Fe2(SO4)3 = 2Fe3+ + 3SO42- С
- 27. С точки зрения ТЭД, кислыми солями называются электролиты, которые в водном растворе диссоциируют на ионы металла
- 28. С точки зрения ТЭД, основными солями называются электролиты, которые в водном растворе диссоциируют на ионы металла
- 29. Реакции в растворах электролитов протекают до конца если: Образуется или растворяется осадок; Выделяется газ; Образуется малодиссоциирующее
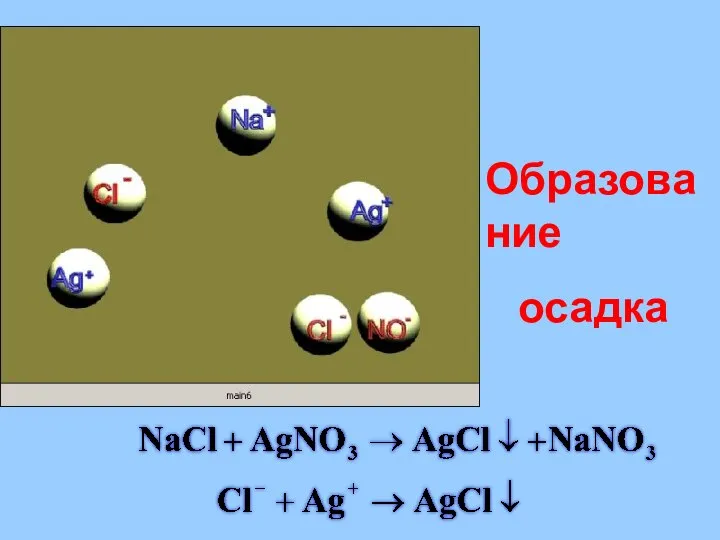
- 30. Образование осадка
- 31. Образование H2O
- 33. Скачать презентацию





















 Вода И её значение
Вода И её значение Тест: Азот
Тест: Азот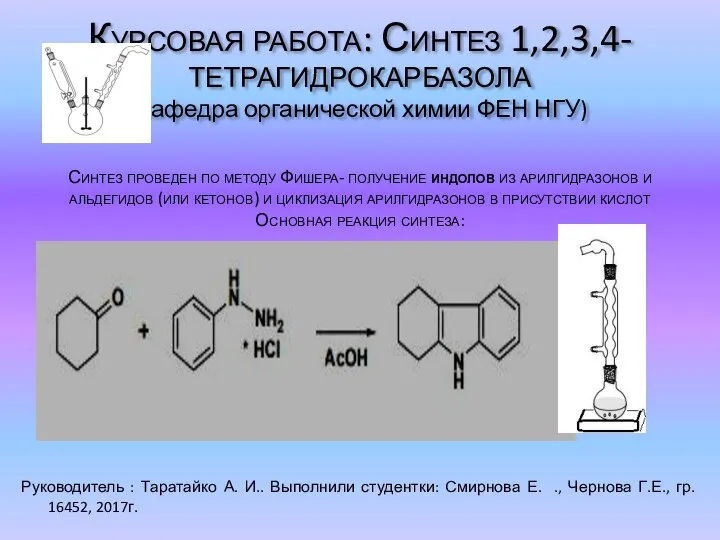 Синтез 1,2,3,4-тетрагидрокарбазола
Синтез 1,2,3,4-тетрагидрокарбазола Реактор гидроочистки дизельного топлива. Контроль и автоматизация
Реактор гидроочистки дизельного топлива. Контроль и автоматизация Предмет органической химии. Органические вещества
Предмет органической химии. Органические вещества Кислородные соединения азота, азотная кислота. Соли азотной кислоты. Удобрения
Кислородные соединения азота, азотная кислота. Соли азотной кислоты. Удобрения Условия, замедляющие выход водорастворимых питательных веществ из удобрений на примере аммофоса
Условия, замедляющие выход водорастворимых питательных веществ из удобрений на примере аммофоса Адсорбция и смачивание
Адсорбция и смачивание Полезные кирпичи окружающего мира
Полезные кирпичи окружающего мира Презентация на тему Фосфор. Соединения фосфора
Презентация на тему Фосфор. Соединения фосфора  Полимеры. Полимерные материалы
Полимеры. Полимерные материалы ЭТА УВЛЕКАТЕЛЬНАЯ ХИМИЯ… Первый урок химии в 8 классе Абрамова С.И., учитель химии МОУ «Лихославльская СОШ №2» Тверской области
ЭТА УВЛЕКАТЕЛЬНАЯ ХИМИЯ… Первый урок химии в 8 классе Абрамова С.И., учитель химии МОУ «Лихославльская СОШ №2» Тверской области Рубидий (Rb). Цезий (Cs). Франций (Fr)
Рубидий (Rb). Цезий (Cs). Франций (Fr) Электролитическая диссоциация
Электролитическая диссоциация Химия - наука чудес и превращений
Химия - наука чудес и превращений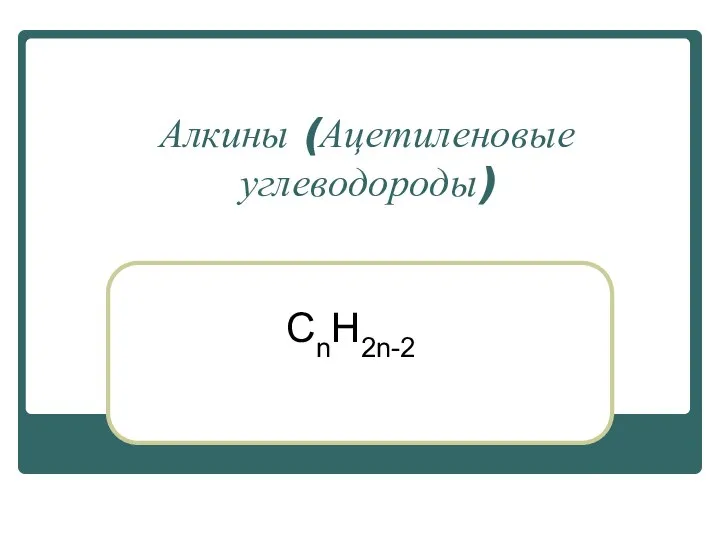 Алкины (Ацетиленовые углеводороды)
Алкины (Ацетиленовые углеводороды) Ковалентная химическая связь
Ковалентная химическая связь Химические понятия. Вещество. Химические явления. Выдающиеся ученые-химики
Химические понятия. Вещество. Химические явления. Выдающиеся ученые-химики Уран гексафториді
Уран гексафториді Теория-кинетика
Теория-кинетика Водород – топливо будущего
Водород – топливо будущего Курсовой синтез ацетоуксусного эфира
Курсовой синтез ацетоуксусного эфира Полиэтилен. Получение полиэтилена
Полиэтилен. Получение полиэтилена Растворы. 8 класс
Растворы. 8 класс obschaya_kharakteristika_prostykh_alifaticheskikh_efirov
obschaya_kharakteristika_prostykh_alifaticheskikh_efirov Ароматические и гетероциклические соединения. Электронная спектроскопия
Ароматические и гетероциклические соединения. Электронная спектроскопия Элементы принадлежащие к VII группе периодической таблицы - галогены
Элементы принадлежащие к VII группе периодической таблицы - галогены Алкены. Химические и физические свойства
Алкены. Химические и физические свойства