Содержание
- 2. ПРОАНАЛИЗИРУЕМ, ЧТО МЫ УЖЕ ЗНАЕМ О СТРОЕНИИ АТОМА, А ЧТО ЕЩЕ НЕТ
- 3. Факт №1 Экспериментально было установлено, что … а) электрон имеет определенный заряд Электрон (е-) несет отрицательный
- 4. Факт №2 Пучок электронов, рассеиваемый кристаллом, дает такую же дифракционную картину, как и рентгеновское излучение. Вывод
- 5. В 1924 г. Луи де Бройль высказал гипотезу, что все объекты микромира характеризуются двойственной природой, обладая
- 6. Двойственная природа электрона Электрон имеет массу и заряд, как частица. Электрон проявляет волновые свойства – способен
- 7. Электрон в атоме может находиться в любой точке пространства вокруг ядра, однако вероятность его пребывания в
- 8. В настоящее время считается, что состояние каждого электрона в атоме определяется с помощью четырех квантовых чисел.
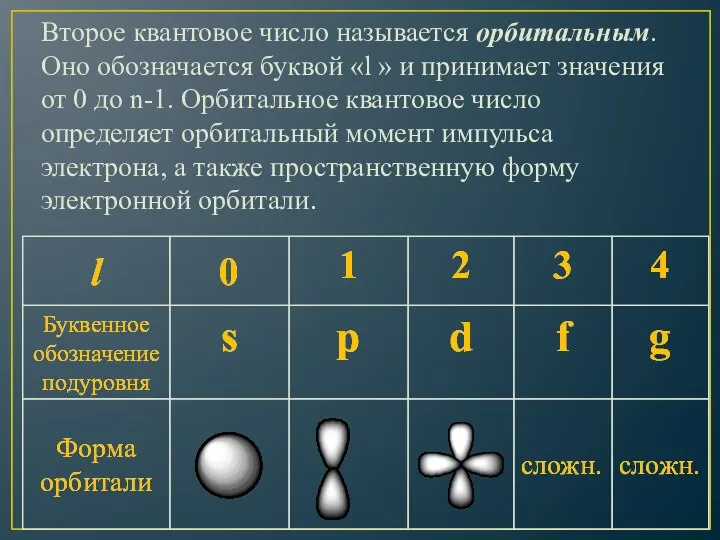
- 9. Второе квантовое число называется орбитальным. Оно обозначается буквой «l » и принимает значения от 0 до
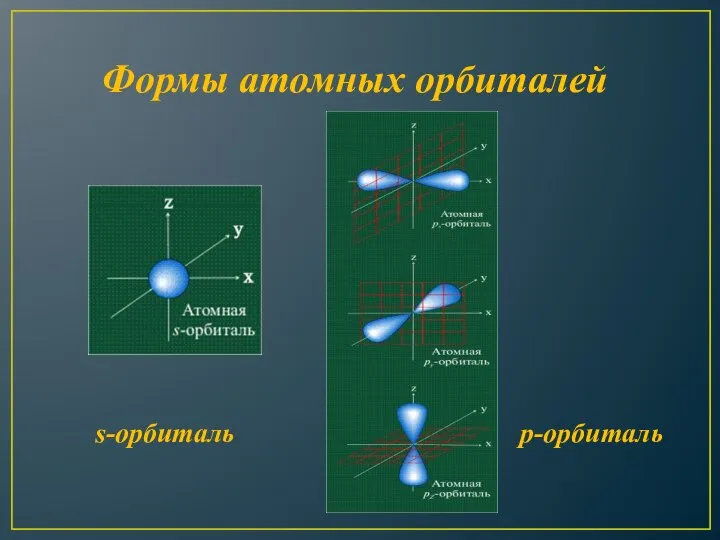
- 10. Формы атомных орбиталей s-орбиталь p-орбиталь
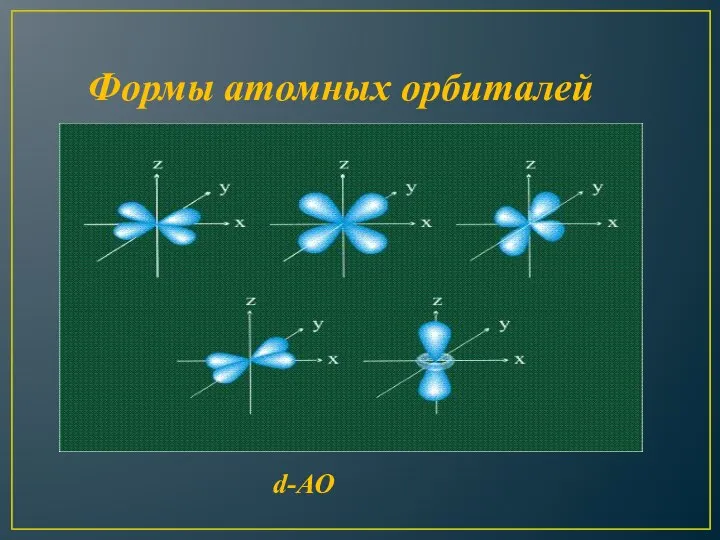
- 11. Формы атомных орбиталей d-АО
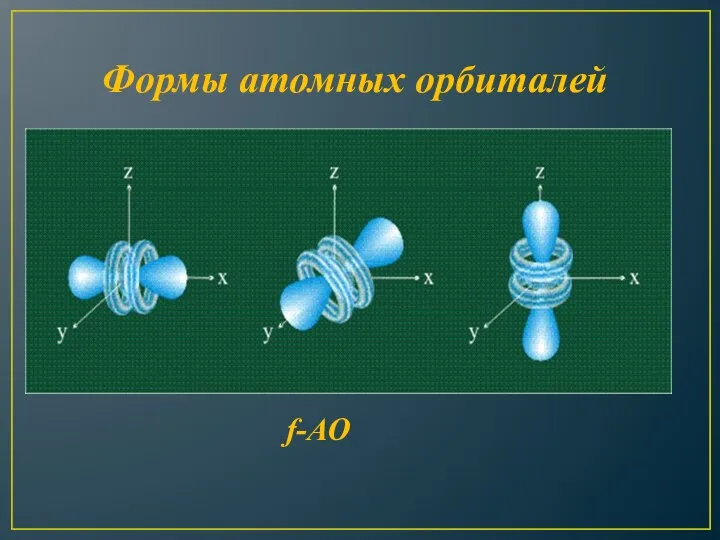
- 12. Формы атомных орбиталей f-АО
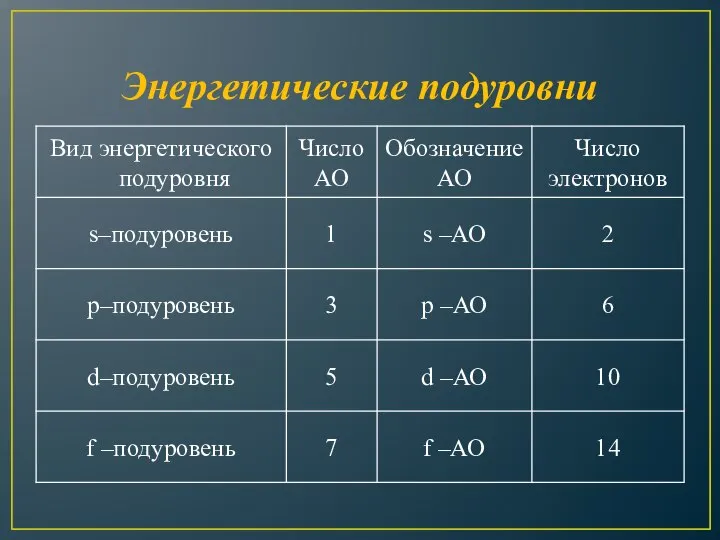
- 13. Число подуровней, на которые расщепляется энергетический уровень равно номеру уровня. Энергетический подуровень – это совокупность электронных
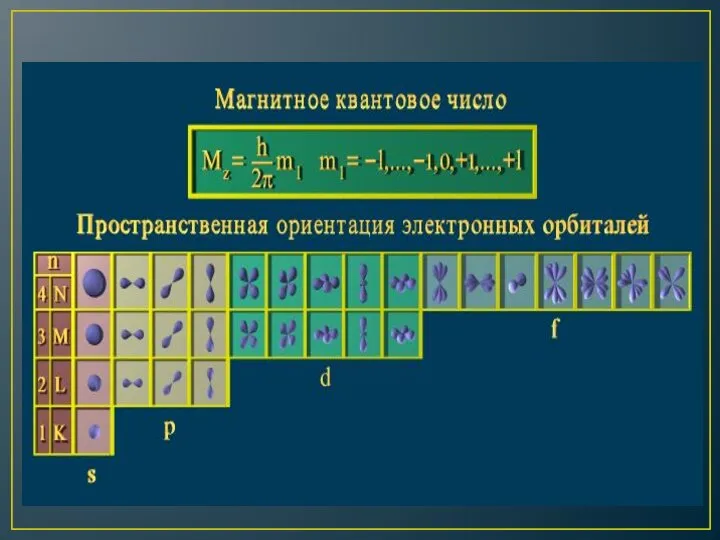
- 14. Магнитное квантовое число ml определяет значения проекции орбитального момента на одной из осей, а также пространственную
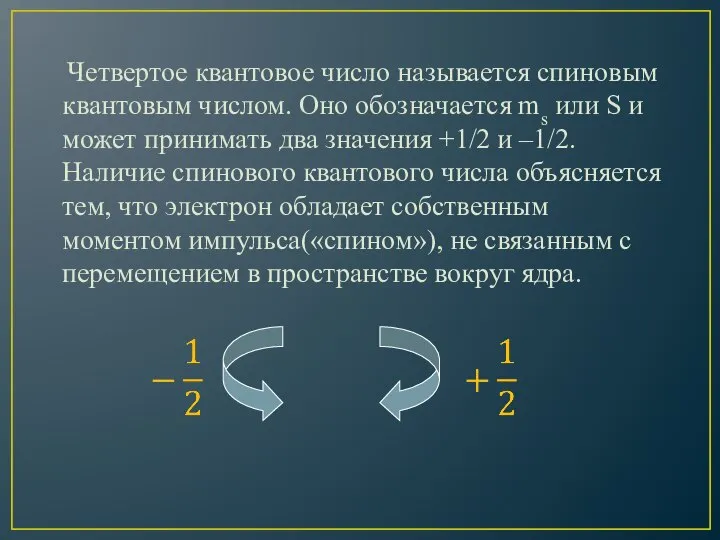
- 16. Четвертое квантовое число называется спиновым квантовым числом. Оно обозначается ms или S и может принимать два
- 17. Общая характеристика состояния электрона в многоэлектронном атоме определяется принципом Паули: в атоме не может быть двух
- 18. Порядок заполнения орбиталей электронами 1s2 2s22p6 3s23p6 4s23d104p6 5s24d105p6 6s25d14f145d96p6 7s26d15f146d7… Причем, строение электронной оболочки предыдущего
- 19. Энергетические уровни атома
- 20. Энергетические подуровни
- 21. Упражнения Пример 1. Составим схему электронного строения и электронную формулу элемента с порядковым номером 7. Решение.
- 22. Упражнения Пример 2. Составим схему электронного строения и электронную формулу элемента с порядковым номером 23. Решение.
- 24. Скачать презентацию














 10_KhimiaKlassifikatsia_organicheskikh_soedieniy (1)
10_KhimiaKlassifikatsia_organicheskikh_soedieniy (1) Замедленное коксование гудрона
Замедленное коксование гудрона Оксиды в свете ТЭД
Оксиды в свете ТЭД Иерархия классов методов моделирования. Атомистические и микроскопические методы
Иерархия классов методов моделирования. Атомистические и микроскопические методы Амфотерные гидроксиды
Амфотерные гидроксиды Тесты по химии (вопросы)
Тесты по химии (вопросы) Натуральный каучук
Натуральный каучук Презентация на тему Из чего сделаны северные трубопроводы
Презентация на тему Из чего сделаны северные трубопроводы  Простые вещества - металлы
Простые вещества - металлы Общая характеристика элементов IIА группы
Общая характеристика элементов IIА группы Вывод формул химических веществ
Вывод формул химических веществ Химия в косметике
Химия в косметике Простые вещества - неметаллы
Простые вещества - неметаллы Алкадиены: кумулированные, сопряженные, изолированные
Алкадиены: кумулированные, сопряженные, изолированные Zirconium Dioxide
Zirconium Dioxide Приходченко ФЕР-2031
Приходченко ФЕР-2031 Методы восстановления. Формирование СН-связей декарбоксилированием и декарбонилированием
Методы восстановления. Формирование СН-связей декарбоксилированием и декарбонилированием Периодическая система Д.И.Менделеева
Периодическая система Д.И.Менделеева Предельные углеводороды. Алканы
Предельные углеводороды. Алканы Сравнение активностей металлов
Сравнение активностей металлов Силумины. Виды силуминов
Силумины. Виды силуминов Современные представления о механизме реакций отщепления. Спектр механизмов E1-E2-E1cB. Диаграммы Дженкса-О’Феррола
Современные представления о механизме реакций отщепления. Спектр механизмов E1-E2-E1cB. Диаграммы Дженкса-О’Феррола Алкины. Строение алкинов
Алкины. Строение алкинов Значение воды на Земле
Значение воды на Земле Химическое равновесие в гомогенных системах
Химическое равновесие в гомогенных системах Чистые вещества и смеси
Чистые вещества и смеси Сырьё для каменного литья и производства минеральной ваты
Сырьё для каменного литья и производства минеральной ваты Непредельные углеводороды. Алкены
Непредельные углеводороды. Алкены